MgO + HF = MgF2 = H2O решите уравниения?
Химия | 10 — 11 классы
MgO + HF = MgF2 = H2O решите уравниения.
MgO + HF = MgF₂ + H₂O
MgO + 2HF = MgF₂ + H₂O
KOH + MgO = ?
Согласно степеням окислениям составить правильную формулу hcl?
Согласно степеням окислениям составить правильную формулу hcl.
1) MgO + CaO = ?
Решить цепочку : Mg⇒MgO⇒MgCl⇒MgCO⇒MgSO⇒Mg(OH)⇒MgO?
Решить цепочку : Mg⇒MgO⇒MgCl⇒MgCO⇒MgSO⇒Mg(OH)⇒MgO.
Выпишите из предложенного ряда отдельно формулы веществ молекулярного и немолекулярного строения : O2, MgF, H2S, H2O, CaO, AlF3?
Выпишите из предложенного ряда отдельно формулы веществ молекулярного и немолекулярного строения : O2, MgF, H2S, H2O, CaO, AlF3.
Mg = MgO = MgCl2 = MgS решите цепочку?
Mg = MgO = MgCl2 = MgS решите цепочку.
Помогите решить химическую цепочку MgO — MgSO4 — Mg(OH)2 — MgO?
Помогите решить химическую цепочку MgO — MgSO4 — Mg(OH)2 — MgO.
Mg — — > ; MgO — — > ; MgSO4 — — > ; Mg(OH)2 — — > ; MgO решите пожалуйста?
Mg — — > ; MgO — — > ; MgSO4 — — > ; Mg(OH)2 — — > ; MgO решите пожалуйста.
Mg — — > ; MgO — — > ; MgSO4 — — > ; Mg(OH)2 — — > ; MgO решите пожалуйста?
Mg — — > ; MgO — — > ; MgSO4 — — > ; Mg(OH)2 — — > ; MgO решите пожалуйста.
Решите уравнения KOH + CO2 ; SiO2 + MgO?
Решите уравнения KOH + CO2 ; SiO2 + MgO.
На странице вопроса MgO + HF = MgF2 = H2O решите уравниения? из категории Химия вы найдете ответ для уровня учащихся 10 — 11 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
Добавь NaOH + CuCl2 = Cu(OH)2 + NaCL.
Ептить, где начало? ))).
Na2SiO3 + 2HNO3 — — >2NaNO3 + H2SiO3 — обмена нитрат натрия + кремневая кислота.
Я ВАС ОЧЕНЬ ОЧЕНЬ ЛЮБИМ Ч БУДУ ХОРОШО УЧИТЬ Я ВАС УВАЖАЮ ЕСЛИ ВЫ ЧЁ ХОЧЕТЕ Ч ВАМ ВСЕ ПОДАРЮ БАБУШКА ТЫ МАЯ ЛЮБИМАЯ Я ВАС УВАЖАЮ ПОТОМУШТА ВЫ МНЕ МНОГА ЗНАНИЯ ДАЛИ ПОСИБА ЗА ЭТО БАБУШКА.
В реакции должен быть осадок, вода или газ тогда она возможна. Надеюсь верно. Фосфат алюминия в осадке . Не проставлено.
Щелочные металлы — Li, K, Na. Значит, ответ 3.
Атомы щелочно — земельных металлов отличаются друг от друга количеством энергетических уровней, т. К. они находятся в разных периодах.
13, 2 / 44 = 0, 3 моль углекислого газа образовалось значит в составе углеводорода было 0, 3 моль углерода. Молекулярная масса углеводорода 43 * 2 = 86 г / моль. 4, 3 / 86 = 0, 05 моль 0, 3 / 0, 05 = 6 атомов углерода в составе углеводорода. 86 — ..
M = 352 (г) M(FeS) = 56 + 32 = 88 (г / моль) n = m / M = 352 / 88 = 4 (моль).
CH₃ — C≡C — CH₃ + H₂ → CH₃ — CH = CH — CH₃ бутен — 2 CH₃ — C≡C — CH₃ + 2H₂ → CH₃ — CH₂ — CH₂ — CH₃ бутан CH₃ — C≡CH + HCl → CH₃ — CCl = CH₂ 2 — хлорпропен CH₃ — C≡CH + 2HCl → CH₃ — CCl₂ — CH₃ 2, 2 — дихлорпропан CH₃ — CH₂ — C≡CH + Br₂ → CH₃ — CH₂ — C..
Оксид магния: способы получения и химические свойства
Оксид магния MgO — бинарное неорганическое вещество . Белый, тугоплавкий, термически устойчивый, не реагирует с водой. Проявляет основные свойства.
Относительная молекулярная масса Mr = 40,3; относительная плотность для тв. и ж. состояния d = 3,62; tпл ≈ 2825º C; tкип = 3600º C.
Способ получения
1. Оксид магния получается при разложении карбоната магния при температуре 350 — 650º C. В результате разложения образуется оксид магния и углекислый газ:
2. В результате разложения нитрата магния при температуре выше 300º С образуется оксид магния, оксид азота (IV) и кислород:
3. Гидроксид магния разлагается при 350-480º С с образованием оксида магния и воды:
4. Оксид магния можно получить путем разложения сульфата магния при температуре выше 1200º C, образуется оксид магния, кислород и оксид серы (IV):
5. Оксид магния можно получить сжиганием магния в в кислороде при 600 — 650º С:
2Mg + O2 = 2MgO
Химические свойства
1. Оксид магния реагирует с простыми веществами :
1.1. В результате реакции между оксидом магния и кальцием при температуре выше 400º С образуется магний и оксид кальция:
MgO + Ca = CaO + Mg
1.2. Оксид магния реагирует с углеродом при температуре выше 2000º С и образует магний и угарный газ:
MgO + C = Mg + CO
2. Оксид магния взаимодействует со сложными веществами:
2.1. Оксид магния взаимодействует с кислотами . При этом образуются соль и вода.
2.1.1. О ксид магния с разбавленной соляной кислотой образует хлорид магния и воду:
MgO + 2HCl = MgCl2 + H2O
2.3. Оксид магния взаимодействует с водой при 100 — 125º С, образуя гидроксид магния:
Фторид магния
| Фторид магния | ||
|---|---|---|
| ||
| Систематическое наименование | Фторид магния | |
| Традиционные названия | Фтористый магний | |
| Хим. формула | MgF2 | |
| Состояние | Бесцветные кристаллы | |
| Молярная масса | 62,31 г/моль | |
| Плотность | 2,9-3,2; 3,148; 3,13 г/см³ | |
| Температура | ||
| • плавления | 1263; 1396 °C | |
| • кипения | 2239; 2250 °C | |
| Мол. теплоёмк. | 61,6 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | -1124,2 кДж/моль | |
| Растворимость | ||
| • в воде | 0,0076 18 г/100 мл | |
| Рег. номер CAS | 7783-40-6 | |
| PubChem | 24546 | |
| Рег. номер EINECS | 231-995-1 | |
| SMILES | ||
| RTECS | OM3325000 | |
| ChemSpider | 22952 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
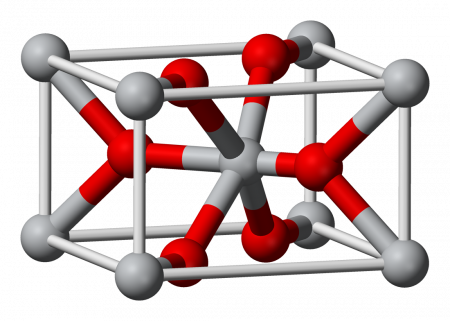
Фторид магния — бинарное неорганическое соединение магния и фтора с формулой MgF2. Бесцветные диамагнитные тетраэдрические кристаллы.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
Получение
- Непосредственно из элементов, сжигая магний в атмосфере фтора:
Mg + F2 → MgF2
- Действуя плавиковой кислотой оксид магния, его гидроксид, карбонат или галогенид:
MgO + 2 HF → MgF2 + H2O Mg(OH)2 + 2 HF → MgF2 + 2 H2O MgCO3 + 2 HF → MgF2 + CO2 ↑ + H2O MgCl2 + 2 HF → τoC MgF2 + HCl ↑
- Обменными реакциями, используя плохую растворимость фторида магния:
MgCl2 + 2 NH4F → MgF2 ↓ + 2 NH4Cl
Физические свойства
Фторид магния образует бесцветные диамагнитные кристаллы тетрагональной сингонии, пространственная группа P 4/mnm, параметры ячейки a = 0,4625 нм, c = 0,3052 нм, Z = 2. При температуре 857°С переходит в другую тетрагональную фазу.
Флуоресцирует фиолетовым цветом, плохо растворяется в воде и ацетоне.
http://chemege.ru/oksid-magniya/
http://chem.ru/ftorid-magnija.html