Диффузия
Вследствие молекулярно-кинетического движения частицы испытывают случайные смещения, при которых перемещаются вверх или вниз.
Диффузия – самопроизвольно протекающий в системе процесс выравнивания концентраций молекул, ионов или коллоидных частиц под влиянием их хаотического теплового движения.
В термодинамическом отношении процесс диффузии идёт с увеличением энтропии и является самопроизвольным. Явление диффузии необратимо и протекает до полного выравнивания концентраций.
Скорость диффузии при постоянных температуре и вязкости среды (t=const и η=const) зависит только от величины и формы частиц.
Медленность диффузии является признаком, отличающим коллоидные системы от истинных растворов низкомолекулярных веществ.
Перенос массы в результате диффузии формально сходен с законом переноса тепла и электричества. Воспользовавшись этой аналогией, Фик сформулировал (1855г.) первый закон диффузии:
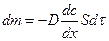
где m — количество продиффундировавшего вещества (моль);
D – коэффициент диффузии, зависит от свойств диффундирующих частиц и среды (м 2 /с);
dc/dx — градиент концентрации (моль/л);
S – площадь, через которую идет диффузия;
τ – продолжительность диффузии;
«-» так как диффузионный поток проходит в направлении меньших концентраций.
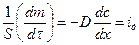
где iд –диффузионный поток, характеризует количество вещества, переносимое в результате диффузии за единицу времени через сечение, равное единице площади.
Принимая dс/dx =1, и S=1, τ=1, тогда получим
т.е. коэффициент диффузии (D) численно равен количеству вещества продиффундировавшего через единицу площади за единицу времени, при градиенте концентрации равном единице.
А. Эйнштейн, изучая броуновское движение, установил связь коэффициента диффузии D со средним сдвигом 

что дает возможность экспериментально установить коэффициент диффузии по методу сдвига.
Рассматривая силы трения, действующую со стороны растворителя на диффузию молекул растворенного вещества, Эйнштейн предложил:
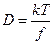
где f – коэффициент трения для растворённых молекул (Нс/м); k – постоянная Больцмана.
С другой стороны, частица со стороны растворителя испытывает силу трения или сопротивление, равное
f= 6 πηr – закон Стокса,
где η – вязкость растворителя, r – радиус частицы.
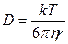
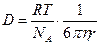
для сферических частиц.
Это уравнение – одно из уравнений коллоидной химии, позволяет определить размер частиц:
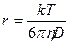
отсюда молекулярный вес: 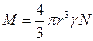
Уравнение Эйнштейна-Стокса выражает физический смысл коэффициента диффузии. Величина kT – мера тепловой или кинетической энергии молекулы, η – мера вязкого сопротивления диффузии. Отношение kT и η определяет насколько легко частица диффундирует. Из уравнения Эйнштейна-Стокса следует, что D обратно пропорционально радиусу,

Рис. 26. Схема, поясняющая понятие осмотического давления.
Перегородка – непроницаемая мембрана для коллоидных частиц (рис. 26). Наличие мембраны ограничивает свободное движение коллоидных частиц в сторону чистой жидкости. Различие в концентрации раствора по обе стороны мембраны не может выровняться путём свободной диффузии. Растворитель переходит в раствор до тех пор, пока этот переход не компенсируется встречно направленным гидростатическим давлением со стороны раствора, это и есть осмотическое давление раствора π.
Осмотическое давление увеличивается из-за перехода части растворителя в сравнении с первоначальным.
Осмотическое давление для разбавленных коллоидных растворов находиться из уравнения:
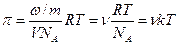
где ω – количество растворенного вещества;
m – масса частицы;
V – объем системы;
ν — частичная концентрация.
Это уравнение аналогично уравнению Вант-Гоффа для осмотического давления истинных растворов:
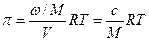
где М – молекулярный вес; с – весовая концентрация.
Осмотическое давление для лиозолей очень маленькая величина и непостоянная, т.к. большие количественные различия в значениях концентрации приводят к слабому проявлению осмоса.
Определим количественную зависимость осмотического давления π от числа частиц n среднего радиуса r и степенью дисперсности z в единице объёма: имеем две дисперсные системы с одинаковым растворителем, при одинаковой температуре масса диспергированного вещества в этих системах выражается:
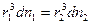
т.е. осмотическое давление обратно пропорционально кубу радиуса частиц и, следовательно, прямо пропорционально кубу степени дисперсности.
Значит небольшое изменение в размере частиц приведёт к значительному изменению осмотического давления.
Лекция 5, 6. Биофизика транспортных процессов
Лекция 5, 6. Биофизика транспортных процессов
Перейдем теперь к рассмотрению некоторых направлений клеточной биофизики и начнем с биофизики транспортных процессов.
Прежде всего, определим некоторые понятия – под транспортом на клеточном ровне понимаются прежде процессы переноса нейтральных веществ и ионов через биологические мембраны, и именно эти процессы изучаются в первую очередь в биофизике транспортных процессов. Надо отметить, что транспорт на клеточном уровне этими процессами не исчерпывается. Так существует латеральный транспорт – т. е. транспорт веществ ВДОЛЬ мембраны. Можно говорить также о транспорте веществ внутри клетки, который не связан с мембранными структурами, а осуществляется, например, за счет взаимодействия транспортируемых молекул с белками цитоскелета или водных потоков внутри клетки.
Однако именно трансмембранный транспорт, т. е. транспорт ЧЕРЕЗ биологические мембраны играет одну из ключевых ролей. Поему так? Чтобы понять это, необходимо вспомнить роль биологических мембран в существовании живых систем.
Как вы, наверно, знаете мембраны представляют собой клеточные структуры состоящие из бислоя (если нужно – напомнить структуру бислоя, РИС) и взаимодействующих с ним белков. У прокариот основной мембранной структурой является клеточная мембрана, выполняющая широкий спектр функций. У эукариот имеется широкий спектр мембранных структур – плазматическая мембрана, ядерная мембрана, сопрягающие мембраны – у митохондриальная и тилакоидная, и другие. Наиболее общей функцией биомембран является барьерная – т. к. за счет центрального гидрофобного участка в бислое, они обладают очень низкой проницаемостью для полярных, водорастворимых соединений. Именно благодаря этой функции мембраны и стали играть столь значительную роль в функционировании живых систем – без них само существование живых систем как отдельных объектов стало бы невозможным.
Однако, как мы уже говорили, живые системы – это открытые системы, т. е. системы, которые не могут существовать без обмена с внешней средой веществом и энергией. Отсюда существование биомембран, являющееся само по себе необходимым условиям для существования живых организмов в том виде в каком они есть, с необходимостью требует существования транспортных процессов через эти мембраны и обуславливает большую биологическую значимость этих процессов.
Рассмотрим процессы транспорта через биомембраны подробнее.
Простая диффузия представляет собой движение молекул незаряженного вещества по градиенту концентрации, т. е. от участков с более высоким содержанием данного вещества к участкам с более низким содержанием его. Такой процесс является пассивным, т. е. его непосредственное протекание не требует затрат энергии. Его существование было изначально показано эмпирически, однако этот закон может быть выведен, например, из более общего второго принципа термодинамики (равновесие – как отсутствие градиентов, если нужно объяснить). Впрочем, к явлению диффузии легко прийти и на основе молекулярной картины строения вещества и броуновского движения, которое, в общем-то, тоже вытекает из этой картины. Так, если у нас имеется два отсека, заполненных, например, разной концентрацией газа, то если мы откроем перегородку между этими отсеками, то получим, что количество молекул, движущихся из 1 в 2, будет пропорционально концентрации газа в 1, а из 2 в 1 – концентрации газа в 2 (РИС). Т. е. можно записать, что 




Отметим, что D – коэффициент диффузии, размерность которого обычно см2*с-1, j – поток вещества, с размерностью М*см-2*с-1. D – можно найти, учитывая, что 
В том случае, когда речь идет о перемещении вещества через тонкий барьер, например, через биомембрану, толщиной h, можно принять внутри этого барьера связь между С и х имеет линейный характер, т. е. dC/dx = const. Справедливость этого легко доказать, проанализировав зависимость ΔС от x, на участке от 0 до h:

 | Дорожное хозяйство России строительство и содержание дорог — это очень важно |
| |
 Транспорт
Транспорт
Методы изучения динамического поведения мембранных систем
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
МЕТОДЫ ИЗУЧЕНИЯ ДИНАМИЧЕСКОГО ПОВЕДЕНИЯ МЕМБРАННЫХ СИСТЕМ И ЛИПИД-БЕЛКОВЫХ ВЗАИМОДЕЙСТВИЙ
- Микровязкость мембран и применимость мембранных зондов
- Электронный парамагнитный резонанс (ЭПР)
- Деполяризация флуоресценции
- Ядерно-магнитный резонанс (ЯМР)
- Метод кругового дихроизма
- Метод сканирующей калориметрии
- Флуоресцентная спектроскопия
Все биологические структуры по своей природе динамичны, и при рассмотрении их функций необходимо учитывать подвижность компонентов, из которых эти структуры состоят. Это относится к ферментам, полинуклеотидам и конечно, к мембранам. В жидкостно-мозаичной модели, в центре которой находится представление о подвижности мембранных компонентов, мембрана рассматривается как некое липидное море, в котором свободно плавают глобулярные белки, окруженные аннулярными липидами.
Динамическая подвижность мембранных компонентов связана с их биологическим функциями и является залогом их нормального функционирования. Необходимым условием протекания ферментативных процессов является свободная диффузия мембраносвязанных компонентов. Между шероховатым и гладким ЭР, аппаратом Гольджи и плазматической мембраной происходит быстрый обмен различными веществами, тем не менее, их состав и функции различаются. Чтобы понять суть этих и многих других биологических феноменов, необходимо прежде всего выяснить механизмы, управляющие динамической подвижностью мембран.
Что кроется за понятием «динамические свойства мембран»? Поперечная асимметрия в распределении липидов, а, возможно, и пассивная диффузия через бислой очевидным образом связаны со скоростью трансмембранного флип-флоп перехода липидов. Биогенез мембран зависит от скорости обмена липидов между различными мембранами. Скорость ферментативных реакций, протекающих с участием мембраносвязанных компонентов, зависит от скорости латеральной диффузии компонентов мембран. И, наконец, липидно-белковые взаимодействия зависят от скорости, с которой происходит обмен липидами между ближайшим окружением белков и остальным объемом мембраны.
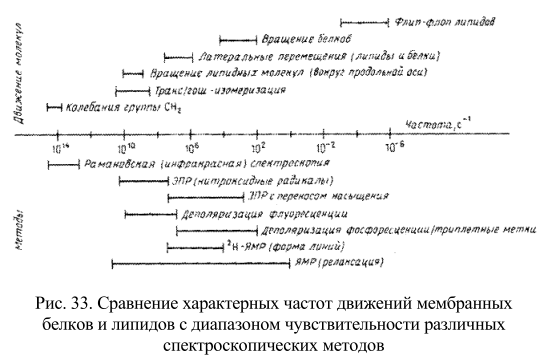
Изучая процессы, протекающие в мембранных структурах, необходимо представлять их временные характеристики и одновременно временное разрешение методов, используемых для анализа. Для примера на рис. 33 приведено сопоставление некоторых химических и физических реакций в биологических мембранах с диапазоном скоростей, доступных для измерения с помощью распространенных методов.
Характерные времена равны величинам, обратным указанным частотам. Диапазон чувствительности методов указан приблизительно. Временной диапазон разных форм подвижности, зафиксированных в мембране, весьма широк: от молекулярных колебаний с частотой порядка 10 – 14 сек -1 до трансмембранного флип-флоп перехода липидов, характерное время которого может достигать нескольких часов. На рисунке в общем виде представлены некоторые из этих процессов, а также указаны временные пределы чувствительности различных биофизических методов. Видно, что одни методы позволяют получить статическую картину мембраны, поскольку характерное время соответствующих движений больше, чем время измерения, а другие методы дают усредненную по времени картину, поскольку время перемещения молекул гораздо меньше, чем время измерения. Рассмотрим два основных типа экспериментов.
Первые основаны на использовании внутримембранных зондов для изучения микровязкости мембраны. Индикаторами физического состояния мембраны, а также характера липидно-белковых взаимодействий могут служить низкомолекулярные ЭПР-метки и флуоресцентные зонды. Второй тип экспериментов направлен на прямое измерение латеральной диффузии мембранных белков или липидов и вращательной подвижности белков внутри бислоя. Исследовались также молекулярные взаимодействия в бислое, поскольку они влияют на динамику изучаемых молекул.
МИКРОВЯЗКОСТЬ МЕМБРАН И ПРИМЕНИМОСТЬ МЕМБРАННЫХ ЗОНДОВ
Для обычной жидкости, какой является, например, вода, текучесть определяется как величина, обратная вязкости – понятному и легко измеряемому физическому параметру. Вязкость характеризует трение, возникающее между соседними слоями жидкости, которые движутся с разными скоростями. Вязкость жидкости можно оценить, измерив скорость, с которой падает мраморный шарик в жидкой среде. В случае мембран термин «текучесть» обычно носит качественный характер: имеется в виду сопротивление, которое оказывает мембрана различным типам перемещений в ней.
Почему так важно определить микровязкость мембран? Как уже отмечалось, она играет важную физиологическую роль при адаптации различных организмов к внешним воздействиям. Подобные явления наблюдаются чаще всего при изучении термического стресса, когда микроорганизмы, растения, пойкилотермные или зимующие животные подвергаются воздействию низких температур. Адаптация заключается в изменении липидного состава мембран, а именно в увеличении содержания ненасыщенных липидов или уменьшении средней длины ацильной цепи. Подобные изменения ведут к уменьшению плотности упаковки липидов в мембране и таким образом поддерживают микровязкость мембран на необходимом уровне. Так почему же все-таки так важна микровязкость мембран?
Обычно мембраны находятся в жидкокристаллическом состоянии, и, по-видимому, его поддержание очень важно для их функционирования. При переходе мембраны из жидкокристаллической фазы в фазу геля (более твердое состояние) микровязкость увеличивается. Структурные и функциональные свойства бислоя, находящегося в фазе геля, не совместимы с организацией и успешным функционированием белковых компонентов в мембране. При переходе мембраны из жидкокристаллической фазы в фазу геля микровязкость увеличивается примерно на два порядка. Как правило, для измерения текучести измеряют молекулярную подвижность спиновых или флуоресцентных зондов, включенных в мембрану. Зондами обычно являются небольшие молекулы, сравнимые по размерам с мембранными фосфолипидами. Некоторые из них представлены в таблице 8. Следует указать моменты, существенные для интерпретации данных по движению зондов внутри мембраны.
Липидный бислой не является просто вязкой трехмерной жидкокристаллической структурой, а представляет собой жидкую среду с низкой вязкостью, у которой состав и динамические свойства в центральной области сильно отличаются от состава и свойств периферических полярных участков. Вращательная подвижность молекулы зонда в мембране не изотропна, как это имеет место в случае сферических частиц, не обладающих выделенной осью вращения, а до определенной степени ограничено. Часто зонды внутри мембраны имеют предпочтительную ориентацию и их движения ограничены определенными рамками. Локализация разных зондов в мембране зависит от их природы, так что подбирая зонды различной структуры, можно получать информацию от различных участков мембран. Например, зонд может быть связан с белковой молекулой или белковыми агрегатами, или располагаться внутри липидных кластеров, которые могут находиться в различных физических состояниях.
Таблица 8. Некоторые метки, используемые для изучения динамики мембран
В таблице 8 приведены структурные формулы некоторых зондов, используемых при измерении динамических свойств мембран. Для оценки микровязкости мембран определяют специфические параметры ЭПР спектров.
К таким параметрам относятся:
- – время вращательной корреляции спиновых меток, τ (аналогичную величину можно рассчитать и для флуоресцентных зондов);
- – параметр упорядоченности (S);
- – стационарная анизотропия флуоресцентных зондов;
- – коэффициент распределения молекул зонда между гидрофобной и гидрофильной фазами.
Ясно, что микровязкость мембраны, оцененная только по одному параметру, не может служить достаточно полной характеристикой физического состояния мембраны. И все же измерение отдельных параметров весьма полезно, особенно для характеристик изменений физического состояния мембраны, обусловленных, например, изменениями температуры, давления, внедрением в бислой холестерола, изменения фосфолипидного состава бислоя или ионного состава среды. Воздействия, приводящие к уменьшению площади, приходящейся на одну липидную молекулу (увеличение гидростатического давления, понижение температуры или добавление холестерола к фосфолипидам в жидкокристаллическом состоянии), вызывают увеличение микровязкости. Это согласуется с теорией свободного объема, согласно которой микровязкость и плотность связаны между собой. Действительно, чем более плотная упаковка характерна для мембраны, тем в большей степени ограничивается подвижность зонда.
Рассмотрим 3 метода: электронный парамагнитный резонанс (ЭПР), метод деполяризации флуоресценции, которые позволяют измерять как скорость движения зонда, так и сопротивление этому движению, и метод ядерного магнитного резонанса (ЯМР).
Необходимо иметь представление о том, что именно измеряется с помощью мембранных зондов. Рассмотрим общий случай, который применим к ЭПР, измерению флуоресценции или 2 Н-ЯМР. Все три спектроскопических метода чувствительны к ориентации молекул зондов. Спектр 2 Н-ЯМР чувствителен к ориентации связи С-D (углерод – дейтерий) относительно приложенного поля. Градиент локального поля, векторно суммируясь с внешним полем, дает результирующую, которая и улавливается дейтерием. Аналогичная ситуация характерна и для ЭПР. Спектр ЭПР зависит от ориентации нитроксильной связи N-О, которую содержат большинство обычно используемых зондов (табл. 8), относительно приложенного магнитного поля. В случае флуоресцентной спектроскопии измеряемая поляризация испускаемого света зависит от ориентации дипольного момента перехода относительно направления, определяемого используемым поляризатором.
ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС (ЭПР)
Принцип парамагнитного резонанса был открыт в 1944 г. профессором Е.К. Завойским. Как метод исследования подвижности (упорядоченности) макроструктур он стал применяться лишь 88 после разработки способа создания стабильных парамагнитных соединений, содержащих нитроксидный радикал, впервые синтезированных Э.Г. Розанцевым.
Неспаренный электрон атома азота стабильного парамагнитного соединения (спинового зонда или спиновой метки – разница между ними в том, что молекулы первого типа свободно плавают в мембране, а второго – ковалентно связаны с ее компонентами; разграничения между ними часто игнорируются в американской научной литературе, хотя выдерживаются в русской и английской научной периодике) при наложении сильного магнитного поля переходит с одного энергетического уровня на другой под действием микроволнового излучения (около 10 10 Гц). Метод довольно чувствителен: спектр зонда может быть зарегистрирован при концентрации спиновых меток около 10 -6 М. Спектр ЭПР представляют в виде первой производной от спектра поглощения (рис. 34).
В спектре нитроксильного радикала имеются три пика, отвечающие спин-спиновым взаимодействиям неспаренного электрона и ядра атома азота. Как уже было отмечено, спектр ЭПР зависит от ориентации молекулы – спиновой метки или спинового зонда, содержащих нитроксильный радикал, относительно приложенного магнитного поля. Введение такого радикала позволяет использовать ЭПР-спектроскопию для характеристики упорядоченности вращательной или поступательной подвижности спиновой метки или спин-меченых молекул в разных условиях.
Подвижность, описываемая этим методом, характеризуется так называемым временем вращательной корреляции, которое находится в пределах 10 -8 –10 -10 сек (от нескольких нсек до 0,1 нсек) для свободного вращения метки. Примеры ЭПР спектров приведены на рис. 34. Характер спектра зависит от характера вращения молекулы. На рисунке приведены спектры для разных случаев – от свободного вращения до полной заторможенности. Уже упоминалось, что характеристикой спиновых меток является время корреляции (τ). Время корреляции рассчитывают в предположении, что вращательное движение молекулы изотропно, используя параметр высоты пиков. Если спиновые метки – производные жирных кислот или фосфолипидов, – то они, конечно, не вращаются изотропно, и в этом случае параметр упорядоченности S рассчитывается исходя из величины расщепления между линиями спектра. Предположив, что такие молекулы имеют форму жесткого стержня, можно из величины параметра S оценить максимальное отклонение зонда от нормали к поверхности мембраны. И время корреляции, и параметр упорядоченности позволяют получить полуколичественное представление о свойствах мембраны. Спиновая метка может быть введена в разнообразные соединения, локализацию которых в мембране легко предсказать, поэтому этим методом можно оценивать подвижность и взаимодействие разных компонентов мембраны.
ЭПР-спектроскопия позволяет измерять плотность упаковки бислоя. Спин-меченые жирные кислоты, содержащие нитроксильную группировку на разном расстоянии от полярной СООН-группы, встраиваясь в бислой, ориентируются в поперечном направлении. Вид ЭПР спектра этих меток зависит от глубины погружения спиновой метки внутрь бислоя. С помощью спиновых меток можно оценить скорость вращательной корреляции и, соответственно, подвижность жирнокислотных цепей на разной глубине бислоя. Результаты измерения степени упорядоченности спиновых меток, фиксированных в мембране на разной глубине, свидетельствуют о росте неупорядоченности в направлении от поверхности мембраны к ее центральной части.
Рис. 34. Зависимость ЭПР-спектров нитроксидной спиновой метки от скорости молекулярного вращения. Спектры, представляющие собой первую производную сигнала, получены при разных температурах и, следовательно, при разной вязкости среды.
Во многих исследованиях проводилось сравнение микровязкости мембран, которую определяли по данным о величинах τ и S при различных возмущающих воздействиях. Метод ЭПР-спектроскопии требует специального оборудования, хотя сами измерения высоко автоматизированы. Использование этого подхода широко и разнообразно. В то же время, этот метод имеет определенные ограничения. Высокие концентрации спиновых зондов модифицируют бислой, а ковалентные метки, связываясь с белками, могут инактивировать их. В результате исследователь изучает мембрану не в нативном состоянии, а в том виде, который она принимает после модификации, хотя надо сказать, что это артефакт не только данного метода. Кроме того, надо иметь в виду, что скорости процессов, описываемых с помощью метода ЭПР, много больше тех, которые лежат в основе функционирования мембранных ферментов.
ДЕПОЛЯРИЗАЦИЯ ФЛУОРЕСЦЕНЦИИ
Для измерения вращательной диффузии молекул давно используется метод деполяризации флуоресценции. Вращение некоторых зондов в мембранах часто сравнивают с их вращением в маслах с известной вязкостью, при этом пользуются понятием «микровязкость». Суть метода состоит в том, что образец облучают поляризованным светом, который будет предпочтительно возбуждать молекулы, имеющих такую же ориентацию дипольного момента. Испускаемый свет анализируют с помощью поляризаторов. Микровязкость бислоя весьма высока (соответствует величинам 1–10 пуаз), поэтому время вращательной корреляции небольших флуоресцентных (ДФГ) и ЭПР-зондов составляет 10 -8 –10 -9 сек. В воде, имеющей вязкость 0,01 пуаз, молекулы такого размера вращались бы по крайней мере в 100 раз быстрее. Методы ЭПР и деполяризации флуоресценции регистрируют быстрые процессы, совершающиеся за времена порядка 10 -8 сек, а информация о более медленных движениях ускользает от наблюдения.
Мембранные белки имеют значительно большие размеры, чем упомянутые метки, и поэтому вращаются гораздо медленнее. Чтобы метки, пришитые к этим белкам, были чувствительны к их вращению, их время жизни в возбужденном состоянии должно составлять порядка 10 -3 сек. Следовательно, методы, применимые для изучения вращения белков в бислое, должны быть способны регистрировать времена корреляции от 10 -5 до 10 -3 сек. Метод деполяризации флуоресценции, как мы отмечали, в этом случае непригоден, поскольку время жизни молекул в возбужденном состоянии составляет около 10 -8 сек, и в таком временном масштабе молекулы белков представляются неподвижными. Для получения такой информации могут успешно использоваться следующие 3 метода.
1) К исследуемому белку присоединяют зонд, время жизни которого в возбужденном триплетном состоянии достаточно велико. Если метка жестко связана с белком, то для регистрации вращения белка можно использовать измерение анизотропии фосфоресценции. Для таких измерений оказались пригодными производные эозина, поскольку время жизни эозина в триплетном состоянии составляет примерно 2 мсек. Эксперимент состоит в определении характерного времени затухания анизотропии фосфоресценции.
2) В том случае, когда сами молекулы белка содержат группы, переходящие при флэш-фотолизе в долгоживущее возбужденное состояние, параметры можно оценить с помощью дихроизма поглощения. В качестве примера можно привести родопсин и бактериородопсин, где используются возбужденное состояние связанного ретиналя и возбужденные состояния, наблюдающиеся при фотолизе комплексов цитохром-СО с использованием цитохром с оксидазы и цитохрома Р 450 . Измерения можно проводить in situ (например, в составе митохондриальных мембран) или с очищенным белком, встроенным в фосфолипидные везикулы.
3) С помощью обычной ЭПР-спектроскопии не удается регистрировать вращения, характерная частота которых равна частоте вращения мембранных белков. Для этих целей разработан специальный метод – ЭПР с переносом насыщения, диапазон чувствительности которого очень широк – от 10 -7 до 10 -3 сек. Этот метод применялся 92 при изучении вращения нескольких мембранных белков с ковалентно пришитыми к ним спиновыми метками.
Недавно предложен модифицированный метод деполяризации флуоресценции. В его основе лежат те же принципы, что и в основе метода деполяризации флуоресценции, но используется другая молекулярная модель движения, вызывающего деполяризацию. К исследуемому белку присоединяют зонд с достаточно большим временем жизни в возбужденном состоянии. Если система гетерогенна, могут возникнуть определенные трудности с количественным расчетом. Аналогичные ограничения возникают и в тех случаях, если метка может свободно вращаться на поверхности белка или если у белковой молекулы имеются гибкие сегменты.
Интегральные мембранные белки характеризуются широким спектром времен вращательной релаксации. На одном конце временной шкалы находится родопсин, который, по-видимому, свободно вращается в мембране наружного сегмента палочки сетчатки, а на другом – бактериородопсин, который образует в пурпурной мембране упорядоченную кристаллическую решетку и неподвижен. Мембранные белки способны к заметному вращению в плоскости мембраны, и скорость этого вращения согласуется с величиной, ожидаемой исходя из простой гидродинамической модели.
ЯДЕРНО-МАГНИТНЫЙ РЕЗОНАНС (ЯМР)
В основе ЯМР-спектроскопии лежит поглощение электромагнитных волн в радиочастотном диапазоне ядрами, обладающими магнитным моментом. Наиболее часто в исследованиях используются ядра 13 С, 2 Н, 31 Р. Детальную картину строения гидрофобной области липидного бислоя удалось получить с помощью метода 2 Н-ЯМР. Атомы водорода в определенных местах липидной молекулы можно избирательно заменить дейтерием. Это мягкий способ зондирования мембран. Считается, что он, как правило, не вносит возмущений в их структуру. Спектры некоторых дейтерированных димиристоилфосфатидилхолинов представлены на рис. 36.
Структура ЯМР спектров определяется временем жизни различных спиновых состояний, величиной дипольдипольного взаимодействия между данным ядром и соседними ядрами, неоднородностью магнитного поля и т. д. Характерным параметром ЯМР-спектров является величина химического сдвига δ. Иногда для анализа используют время релаксации τ, которые связаны соотношением: δ = 10 – τ. Пики ЯМР лежат в радиочастотном диапазоне, а различия в частотах сигналов для разных изотопов намного превышают ширину сигнала поглощения. Спектры ЯМР малых молекул хорошо разрешимы. Так, спектр ЯМР молекулы холестерола позволяет идентифицировать резонанс каждого атома в отдельности и получить информацию о подвижности различных участков молекулы в зависимости от ее окружения. Кроме параметра химического сдвига – δ рассчитывается параметр Т 1 , характеризующий процесс продольной (спин-решеточной) релаксации, который прямо пропорционален увеличению подвижности отдельных атомов.
Рис. 35. Спектры 2 Н-ЯМР димиристоилфофатидилхолина, дейтерированного по разным положениям ацильной цепи. Числа слева обозначают положение двух (или трех) атомов дейтерия в каждой цепи. Спектр образца с дейтерированной концевой метильной группой гораздо уже всех остальных приведенных спектров, что указывает на значительную неупорядоченность центральной области бислоя.
Метод ЯМР позволяет с высокой избирательностью получить сведения о поведении разных частей молекулы. Например, на рис. 36 указаны значения Т 1 для отдельных атомов углерода в молекуле фосфатидилхолина. Увеличение Т 1 соответствует возрастанию подвижности С-С-связей от поверхности мембраны к атомам, приближенным к середине бислоя.
В литературе часто используется параметр упорядоченности S, который отражает усредненную ориентацию вектора C-D-связи. Колебательные и вращательные движения молекулы, которые влияют на ориентацию C-D-связи в бислое в целом, происходят с достаточно большой скоростью (>10 6 c -1 ), так что любой атом дейтерия воспринимает единое усредненное магнитное окружение. Это окружение зависит от соседних атомов, а также от ограничений движения по типу и амплитуде. Например, определены параметры упорядоченности для нескольких селективно дейтерированных фосфолипидов, в которых атом дейтерия включен в определенные метиленовые группы sn-1-пальмитоильного остатка.
Рис. 36. Величины подвижности Т 1 для различных атомов углерода в молекуле фосфатидилхолина в составе мембраны при температуре выше критической (рассчитаны по данным ЯМР-спектроскопии)
Исследовались как липидные бислои, так и природные мембраны, находящиеся в жидкокристаллическом состоянии, поскольку в случае фазы геля спектры сильно уширяются из-за плотной упаковки липидов и поэтому с трудом поддаются анализу.
Сопоставление результатов различных опытов позволяют сделать два вывода: метиленовые группы в средней части бислоя значительно более разупорядоченны, чем группы вблизи его на поверхности; и для синтетических липидов разных типов, включая фосфатидилхолин, фосфатидилсерин и сфингомиелин, а также для биологических мембран, содержащих дейтерированные зонды профили параметра упорядоченности идентичны. Таким образом, характер упорядоченности бислоя мало зависит от химического строения липида и от состава мембраны, если бислой находится в жидкокристаллическом состоянии. При переходе к более крупным молекулам спектры ЯМР сильно усложняются и зачастую становятся неразрешимыми. Так, ЯМРспектроскопия белков в лучшем случае может позволить охарактеризовать состояние (лабильность) отдельных групп молекулы, например, окружение фосфолипидного радикала в активной группе трансфераз. Другим недостатком ЯМР-спектроскопии является довольно низкая чувствительность – концентрация образца должна быть не менее 10 -3 М (что довольно много), в то время как оптические методы позволяют получить информацию о молекулах, концентрация которых составляет 10 -6 –10 -7 М.
Сопоставление подвижности жирнокислотных цепей в бислое, рассчитанное разными способами, вскрывает различия между методами ЭПР- и ЯМР-спектроскопии (рис. 37). Судя по результатам измерений спектров ЭПР можно заключить, что упорядоченность возрастает, а подвижность соответственно падает монотонно в направлении от эфирной связи к метильному концу молекулы. ЯМР-спектроскопия показывает, что область, примыкающая к сложноэфирной связи, характеризуется определенной жесткостью, и снижение упорядоченности наступает при движении по жирнокислотной цепи к метильному концу, начиная с С 6 -атома. Причина различий в оценке подвижности фосфолипидов в мембране, выявляемых при сравнении этих двух методов, 96 вероятно, заключается в том возмущающем влиянии, которое спиновые зонды оказывают на упаковку бислоя. Кроме того, временные характеристики подвижности, измеряемые методами ЭПР- и ЯМР-спектроскопии, также различаются.
Несмотря на то, что для изучения мембранных белков ЯМР-спектроскопия оказалась не столь эффективна, этот подход часто используют как немодифицирующий метод изучения мембранных структур. Столь же перспективны и другие немодифицирующие методы: кругового дихроизма и сканирующей калориметрии.
МЕТОД КРУГОВОГО ДИХРОИЗМА
Метод кругового дихроизма позволяет выяснить, какой тип вторичной структуры преобладает в мембранных белках. Величина кругового дихроизма, характеризуемая обычно эллиптичностью, представляет собой разницу в поглощении образцом право- и лево-поляризованного света. Она объясняется различиями в коэффициентах молярной экстинкции право- и лево-поляризованного по кругу света. При интерпретации спектров кругового дихроизма возникают некоторые трудности, которые связаны, в основном, с негомогенностью мембранных суспензий, обуславливающей сглаживание спектральных кривых.
Рис. 37. Зависимость параметра упорядоченности S от положения метки в ацильном хвосте спинмеченой декановой кислоты 1 – по результатам ЭПР, 2 – по данным ЯМР-спектроскопии (n – положение метки у атома углерода, начиная от карбоксильной группы).
На первый взгляд представляется, что доля спиральных участков в молекуле белка – не самый информативный параметр. Но с помощью этого метода можно выяснить, осуществляется ли прямое влияние на мембранные структуры внешних факторов, если это влияние изменяет спирализацию белковых молекул. Это изменение часто имеет место в тех случаях, когда наблюдается собственный конформационный сдвиг в молекуле белка или есть взаимодействие молекул белка друг с другом, которое изменяет их конформацию.
МЕТОД СКАНИРУЮЩЕЙ КАЛОРИМЕТРИИ
Принцип метода дифференциальной сканирующей калориметрии состоит в измерении тепла, необходимого для увеличения температуры объекта на очень малую величину при непрерывном повышении температуры объекта. При работе с липидами мембран изменение их фазового состояния также может сопровождаться поглощением или выделением тепла. Чем выше значение поглощенного тепла, тем более значительная молекулярная реорганизация происходит в образце при этих условиях. Таким образом, изменения конформации макромолекул можно измерять, регистрируя тепло, выделяемое или поглощаемое при конформационных переходах.
Почему метод называется дифференциальным? Потому что для нахождения теплоты фазового состояния вещества необходимо из регистрируемого поглощения (или выделения) системой тепла вычесть тепло, поглощаемое (или выделяемое) ею в отсутствии фазовых переходов, – собственную теплоемкость. Современные чувствительные калориметры позволяют измерять фазовые переходы в водно-липидных дисперсиях. Применение этого метода для исследования простых искусственных систем (мицеллы, везикулы, бислои которых организованы из фосфолипидов заданного вида) дало ценную информацию о принципах организации бислоя. Было обнаружено, что в бислоях индивидуальных фосфолипидов критическая температура (Т кр ) для фазового перехода занимает доли градуса.
В смеси различных фосфолипидов область фазового перехода занимает 1–2 градуса. Некоторые фосфолипиды плохо смешиваются друг с другом, например, если их жирнокислотные цепи отличаются по длине более, чем на 4 атома углерода. Не смешиваются также глицерофосфолипиды и сфингофосфолипиды: пики, характеризующие их фазовые переходы, регистрируются на термограммах отдельно. Добавление к таким образцам холестерола способствует образованию фазы со смешанными свойствами, при этом фазовый переход уже не выявляется. В фосфолипидах смешанного состава, образующих одну фазу, величина Т кр представляет собой характеристику этой смеси. На величину Т кр влияют длина жирнокислотных цепей в молекуле (чем больше атомов углерода в жирнокислотном радикале, тем выше температура перехода) и степень ее гидратации. Обводнение бислоя снижает температуру фазового перехода. Анализ термограмм некоторых фосфолипидов выявляет перед наступлением области фазового перехода так называемый предпереход (рис. 38). В настоящее время считают, что предпереход вызван образованием складок бислоя, выявляющихся при изменении объема, занимаемого каждой молекулой, толщины бислоя и связывания молекул воды с его компонентами. При охлаждении образца состояния, соответствующие предпереходу, не обнаруживаются (рис. 38).
Рис. 38. Схематическое изображение гелеобразного (I), переходного (II) и жидкокристаллического (III) состояния бислоя в ходе изменения температуры Термограммы характеризуют переход между этими состояниями при увеличении (1) и уменьшении (2) температуры.
Термограмма нагревания мембранных образцов отличается от термограммы их охлаждения. Это явление носит название гистерезиса липидных систем и объясняется «памятью» липидов. Одна из причин такой памяти заключается в неодинаковой энергии гидратации и дегидратации липидного бислоя. Для нативных мембран ценность метода дифференциальной сканирующей калориметрии ниже, чем для искусственных систем. Высокое содержание холестерола в плазматических мембранах не позволяет выявить отчетливых изменений теплопродукции в области фазовых переходов. В случае внутриклеточных мембран фазовые переходы не обнаруживаются по другой причине – эти мембраны оказываются достаточно «жидкими» в приемлемом интервале температур (5–60ºС).
ФЛУОРЕСЦЕНТНАЯ СПЕКТРОСКОПИЯ
Световая волна, сталкиваясь с молекулой какого-либо вещества, либо рассеивается (изменяет направление движения), либо поглощается (передает свою энергию молекуле). При этом молекула переходит в возбужденное состояние. Энергия, поглощенная молекулой, может рассеяться в виде тепла (в результате столкновения с другими молекулами) или излучиться в виде света. Какое именно событие из указанных здесь будет иметь место, – определяется состоянием молекулы в момент столкновения. Возбужденные электроны возвращаются на основной уровень двумя путями: либо испуская свет, либо с помощью безизлучательного перехода. В первом случае испускаемый свет обладает меньшей энергией и большей длиной волны (так называемый Стоксов сдвиг), так как часть энергии теряется.
Эффективность флуоресценции (вероятность излучательного перехода) характеризуется квантовым выходом 8, равным отношению числа излученных фотонов к числу поглощенных. Величину 0, как и Стоксов сдвиг, определяют и внутренние, и внешние факторы. Например, в случае транс-изомеров в несколько раз выше, чем в случае цис-изомеров флуоресцирующих молекул. К числу внешних факторов относится столкновение с молекулой тушителя 100 (динамическое тушение) или образование комплекса флуоресцентной молекулы с тушителем (статическое тушение). Первый процесс (излучательный переход) зависит от вязкости среды и может быть использован для ее измерения. Тушителями флуоресценции являются тяжелые анионы или катионы (J – , Br – , Cs + , Cu 2+ ), парамагнетики (Мn 2+ , нитроксильные радикалы). Кроме того, наблюдается тушение флуоресценции в полярных растворителях, например, в воде. Второй случай – безызлучательный переход в основное состояние – происходит, если наиболее высокий колебательный подуровень основного состояния имеет приблизительно ту же энергию, что и низкий колебательный уровень возбужденного состояния. Такой переход характерен для «гибких» молекул. У «жестких» молекул, содержащих ароматические кольца, чаще всего наблюдается излучение части поглощенной энергии. Переход молекулы в возбужденное состояние сопровождается изменением дипольного момента молекулы. Это в свою очередь поляризует электронные оболочки окружающих молекул, что приводит к смещению атомов и переориентации молекул. Затрата энергии на эти процессы и приводит к сдвигу в длинноволновую область спектра.
Стоксов сдвиг будет тем больше, чем больше:
- изменение дипольного момента молекулы при возбуждении,
- время жизни молекулы в возбужденном состоянии,
- поляризуемость окружающих молекул.
В некоторых случаях возбужденная молекула, сталкиваясь с идентичной невозбужденной молекулой, образует комплекс – эксимер. При этом из плоских молекул возникают структуры типа сэндвича, которые стабилизированы переносом заряда от одной молекулы к другой. На перенос заряда тратится часть энергии поглощенного кванта, поэтому эксимер флуоресцирует в более длинноволновой области. Степень эксимеризации зависит от концентрации хромофора, температуры и вязкости окружающей среды. Распространенным флуоресцентным зондом, используемым для измерения микровязкости мембран по легкости его эксимеризации, является пирен (рис. 39). Пирен концентрируется в гидрофобных компартментах мембраны, располагаясь между жирнокислотными цепями липидов. Его эксимеризация пропорциональна подвижности молекул в бислое, поэтому при прочих равных условиях и неизменной концентрации пирена величина эксимеризации может служить характеристикой микровязкости мембраны. Понижение температуры увеличивает микровязкость бислоя, ограничивает подвижность молекул пирена и снижает уровень его эксимеризации. При возрастании температуры подвижность жирнокислотных цепей в сердцевине бислоя возрастает, увеличивается и вероятность встречи молекул пирена. Изучение зависимости эксимеризации пирена в мембранах от температуры (или других факторов) позволяет выяснить относительную микровязкость мембранных структур и выявить область критических температур, при которых наблюдается фазовый переход в мембранах.
Рис. 39. Спектры флуоресценции пирена в мембранах микросом почек при разных температурах с указанием максимума флуоресценции мономерной (I 392) и эксимерной (I 465) форм (А) и график Аррениуса для эксимеризации пирена в исследуемом образце (Б) Область перегиба на графике соответствует температуре фазового перехода.
Тушение флуоресценции иногда представляет собой результат дальней безызлучательной передачи (так называемого резонансного переноса) энергии. В этом случае система содержит два флуоресцирующих хромофора, причем спектр испускания одного из них (донора) должен перекрываться со спектром поглощения другого (акцептора). При наличии переноса энергии интенсивность флуоресценции донора снижается, а акцептора – увеличивается. Эффективность переноса зависит от дистанции между донором и акцептором, и это явление может быть использовано для определения расстояния между определенными группами в мембране с помощью своеобразной «спектроскопической линейки». Такой «линейкой» может являться пирен. С его помощью можно измерить упорядоченность анулярного слоя липидов и оценить характер межбелковых взаимодействий в мембране.
Область возбуждения пирена перекрывается с областью испускания триптофанильных радикалов белка (330–335 нм). Если мембранные белки содержат триптофанильные радикалы и обладают собственной флуоресценцией, частично она будет тушиться теми молекулами пирена, которые могут подойти к белковым хромофорам на расстояние радиуса Ферстера (15–20 Å). Следовательно, освещая пробу в области возбуждения триптофанильных остатков (280 нм) и исследуя тушение белковой флуоресценции и возгорание флуоресценции пирена, можно оценить доступность белку той порции пирена, которая локализуется в аннулярном слое. Образование белковых ассоциатов, сопровождающееся снижением доли аннулярных липидов вследствие их вытеснения из области межбелковых контактов, будет защищать собственную флуоресценцию триптофанильных радикалов белка от тушения пиреном и также может быть выявлено и количественно выражено с помощью этого метода.
http://pandia.ru/text/78/219/15048.php
http://farmf.ru/lekcii/metody-izucheniya-dinamicheskogo-povedeniya-membrannyh-sistem/

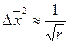
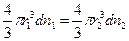
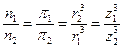

 Транспорт
Транспорт