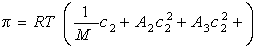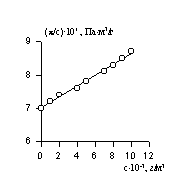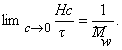Определение молекулярной массы полимера по характеристической вязкости. Уравнение Марка-Куна-Хаувинка.
Ограниченное, неограниченное набухание ВМС (полимеров)
Растворению предшествует набухание ВМС – еще одно уникальное свойство, присущее только им. При контакте ВМС и
растворителя начинается абсорбция. Молекулы растворителя диффундируют внутрь полимера, поглощаются его объемом. Они располагаются между макромолекулами, раздвигают их, что увеличивает подвижность цепей. Усиливается мелкомасштабное движение. Набухание будет продолжаться до тех пор, пока макромолекулы не получат возможность для крупномасштабного движения и тогда произойдет растворение.
При набухании ВМС увеличивается объем и масса образца.
Количественной мерой набухания служит степень набухания a
где m и m 0 – массы набухшего и исходного образца ВМС.
В зависимости от структуры ВМС, свойств растворителя и температуры набухание может быть ограниченным или неограниченным. При ограниченном набухании величина a сначала растет во времени, затем достигает предельного значения и дальше от времени не зависит. Так набухает желатин в холодной воде или резина в бензине.
Неограниченное набухание — это набухание, заканчивающееся растворением: полимер сначала поглощает жидкость, а затем при той же температуре переходит в раствор, образуя однофазную гомогенную систему. Так набухают натуральный и синтетический каучук в углеводородах, нитроцеллюлоза – в ацетоне.
6. По характеру вязкого течения жидкостные дисперсные системы делятся на две группы:
1) бесструктурные системы, частицы которых более или менее свободны и почти не взаимодействуют друг с другом (растворы низкомолекулярных веществ, разбавленные эмульсии, суспензии и золи);
2) структурированные системы — содержат частицы, взаимодействующие друг с другом и с дисперсионной средой (растворы ВМС, концентрированные эмульсии и суспензии). Системы первой группы подчиняются законам Пуазейля и Ньютона: количество жидкости, протекающей через капилляр в единицу времени, изменяется прямо пропорционально давлению, а коэффициент вязкости является величиной постоянной и не зависит от градиента скорости или давления, приложенного к капиллярному вискозиметру.
Вязкость– это внутреннее трение между слоями жидкости или газа, которое возникает когда слои движутся с разными скоростями. Вязкость (η) является результатом межмолекулярного взаимодействия, и она тем выше, чем больше силы молекулярного притяжения. Поэтому вязкость полярных веществ всегда больше, чем неполярных.
Вязкость (η) является результатом межмолекулярного взаимодействия, и она тем выше, чем больше силы молекулярного притяжения. Поэтому вязкость полярных веществ всегда больше, чем неполярных. Зависимость реологических свойств от различных факторов выражают графически в виде реологических кривых (кривых течения): η = f (P) или v = f(P), где v – скорость сдвигового течения жидкости; P — напряжение сдвига (аналог – давление).Для жидкостей характерны два основных типа течения: ламинарное и турбулентное. Ламинарным называют течение жидкости в виде параллельных слоев, не перемешивающихся между собой. Примером ламинарно текущей жидкости может служить спокойная равнинная река. Турбулентное течение – это бурное течение, сопровождающееся образованием завихрений, воронок и взаимным перемешиванием слоев жидкости.
Уравнение Пуазейля и его применение для каппилярной вискозиметрии.
Закон Пуазейля связывает объем протекающей через капилляр жидкости V за время t с вязкостью
где К – константа, зависящая от геометрии капилляра, а Р здесь –давление на конце капилляра. Закон Пуазейля позволяет характеризовать вязкость по времени истечения определенного объема жидкости через капилляр. Это – принцип действия капиллярных вискозиметров.
Определение молекулярной массы полимера по характеристической вязкости. Уравнение Марка-Куна-Хаувинка.
Характерной особенностью растворов полимеров является их высокая вязкость даже при очень больших разбавлениях.
Для вычисления молекулярной массы используют более точное уравнение Марка–Куна–Хаувинка которое учитывает изменение гибкости макромолекул с изменением молекулярной массы. Величина a характеризует форму молекулы полимера в растворе, которая связана с гибкостью цепей, а константа К, как и ранее, постоянна для данного
гомологического ряда. Таким образом, для каждой пары полимер – растворитель характерны свои значения К и a. При увеличении жесткости макромолекул величина a приближается к единице и уравнение Марка–Куна–Хаувинка переходит в уравнение Штаудингера и дальше – в уравнение Эйнштейна.
Практикум по коллоидной химии (стр. 7 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 |
Изучив данную тему и выполнив относящиеся к ней лабораторные работы, студент должен знать:
— способы получения, классификацию, строение макромолекул ВМВ;
— физические состояния аморфных ВМВ и особенности поведения и эксплуатации их в каждом состоянии;
— поведение твердых ВМВ при контакте с растворителями (набухание, степень набухания, контракция, давление набухания);
— свойства растворов ВМВ;
— особенности вязкого течения растворов ВМВ;
— механизм установления мембранного равновесия;
— причины и механизм застудневания и коацервации растворов ВМВ;
— свойства студней и гелей.
Студент должен уметь:
— определять степень набухания полимерных образцов (в том числе растительного сырья);
— выяснять влияние различных факторов на процессы набухания и застудневания;
— рассчитывать среднюю молярную массу ВМВ по осмометрическим и вискозиметрическим данным;
— определять изоэлектрическую точку белков вискозиметрическим методом.
Студент должен получить или закрепить навыки:
— работы с вискозиметром Оствальда;
— работы с прибором для определения степени набухания;
— пользования мерной посудой и другим лабораторным оборудованием;
— расчётов по различным уравнениям;
— построения графиков и интерпретации экспериментальных и расчетных данных.
Высокомолекулярные вещества (ВМВ) характеризуются большой молекулярной массой от нескольких тысяч до многих миллионов.
Они способны к набуханию. Их растворы обладают повышенной вязкостью, способны к застудневанию, высаливанию, синерезису.
Увеличение объема ВМВ в результате поглощения низкомолекулярной жидкости называется набуханием.
Количественной характеристикой набухания служит степень набухания (α).
Степень набухания можно определить по приращению объема или массы вещества.
Различают ограниченное набухание, которое характеризуется переходом ВМВ в студень. При неограниченном набухании ВМВ переходит в раствор.
Процесс набухания сопровождается контракцией – уменьшением общего объема системы.
Это связано с ориентацией и уплотнением молекул растворителя в гидратной оболочке.
На набухание влияют анионы

Переход раствора ВМВ в студень (эластичную систему, обладающую рядом свойств твердого тела) называется застудневанием. При этом раствор ВМВ теряет свою текучесть.
К факторам, влияющим на застудневание можно отнести изменение температуры, концентрации раствора, pH среды, добавление электролита, форма молекул ВМВ, время застудневания.
Низкомолекулярные электролиты влияют на застудневание растворов белков противоположно влиянию на набухание. Ионы, увеличивающие набухание замедляют застудневание и наоборот.
При стоянии свежеприготовленные студни ВМВ часто претерпевают синерезис – уменьшение объема путем самопроизвольного выпресовывания среды из эластичного студня.
Вязкость – это свойство текучих тел оказывать сопротивление перемещению одной их части относительно другой.
Растворы ВМВ не подчиняются законам Ньютона, Пуазейля, Эйнштейна, которым подчиняются растворы низкомолекулярных веществ. Отличие объясняется наличием вытянутых и гибких макромолекул, наличием ассоциатов. Измеряя вязкость растворов ВМВ можно вычислить приведенную вязкость (ηуд./с), найти характеристическую вязкость [η] – значение приведенной вязкости в бесконечно разбавленных растворах.
Зависимость [η] от молекулярной массы описывается уравнением Марка-Куна-Хаувинка.
[η]=КМα, где К и α – константы.
α – выражает степень свертывания молекул и гибкость цепи.
Молекулы некоторых ВМВ содержат ионогенные группы и в растворах способны распадаться на ионы. Такие ВМВ называются полиэлектролитами.
Полиэлектролиты, содержащие одновременно как кислотные так и основные группы, называются полиамфолитами. К ним относятся белки, содержащие группы –COOH и –NH2 или в ионизированной форме –COO– им NH3+. Схематически белковую молекулу можно изобразить так:

В нейтральной среде заряд белковой молекулы определяется состоянием групп –COOH и –NH2 и степенью их диссоциации.
В кислой среде молекула белка приобретает положительный заряд:
NH2 – R – COOH + H+ àNH3+ — R – COOH (при электрофорезе перемещается к катоду)
В щелочной среде – отрицательный заряд:
NH2 – R – COOH + OH — àNH2 — R – COO-+Н2О (при электрофорезе перемещается к аноду).
В водном растворе при определенной концентрации водородных ионов молекула белка может находиться в изоэлектрическом состоянии, когда число ионизированных групп основных равно числу ионизированных групп кислотных. Значение pH, при котором белок находится в изоэлектрическом состоянии и заряд молекулы белка равен нулю, называется изоэлектрической точкой (ИЭТ).
Существует ряд методов определения изоэлектрической точки:
1. по электрофоретической подвижности;
2. по скорости желатинирования;
3. по величине степени набухания;
4. по минимуму вязкости;
5. по степени коагуляции белков («схема Кройта»).
ВОПРОСЫ ТЕОРЕТИЧЕСКОГО МИНИМУМА ДЛЯ САМОПОДГОТОВКИ
1. Высокомолекулярные вещества (ВМВ). Методы получения, классификация. Использование ВМВ в фармации. Конформация макромолекул. Структура ВМВ (линейная, разветвлённая, пространственная).
2. Физические состояния ВМВ (стеклообразное, высокоэластичное, вязко-текучее). Температуры перехода между ними. Сходство растворов ВМВ с золями и истинными растворами низкомолекулярных веществ и отличие от них.
3. Набухание ВМВ и его значение в фармации и медицине. Термодинамика набухания и растворения ВМВ. Лиотропные ряды набухания. Давление набухания. Уравнение Позняка.
4. Вязкость растворов ВМВ. Виды вязкости (динамическая, относительная, кинематическая). Уравнения Ньютона, Пуазейля, Стокса. Вискозиметрия. Вискозиметры.
5. Удельная, приведенная и характеристическая вязкость растворов ВМВ. Уравнения Штаудингера и Марка — Хаувинка — Куна. Вискозиметрическое определение молярной массы ВМВ.
6. Полиэлектролиты. Полиамфолиты. Изоэлектрическая точка полиамфолитов и белков. Методы её определения.
7. Выделение ВМВ из растворов. Высаливание. Коацервация. Выделение под действием органических растворителей.
8. Застудневание растворов ВМВ и факторы, влияющие на него. Тиксотропия. Лиотропный ряд застудневания.
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
Задача 1. Рассчитать относительную, удельную и приведенную вязкость 1,5%-ного раствора поливинилового спирта, если время истечения его, измеренное с помощью вискозиметра Оствальда, равно 80 с, а время истечения такого же объёма воды – 60 с.
РЕШЕНИЕ. Принимая плотность данного раствора из-за его малой концентрации приблизительно равной плотности воды, рассчитаем относительную вязкость по соотношению:
Приведенная вязкость представляет собой отношение удельной вязкости раствора к массовой концентрации полимера С:
Выражая массовую концентрацию поливинилового спирта в кг/м3 (С = 15 кг/м3), получим:
Задача 2. Рассчитать диаметр капилляра d, если по отрезку его длиной 5 см под давлением 19800 Па 15 мл дистиллированной воды протекают за 4 минуты 40 секунд. Динамическая вязкость воды 0,001 Па×с при Т = 25оС.
РЕШЕНИЕ. Воспользуемся уравнением Пуазейля:
где Q – объёмная скорость течения жидкости, равная отношению объёма жидкости V ко времени течения его по капилляру длиной 
Преобразуем уравнение для нахождения радиуса капилляра и решим его, подставляя данные в системе СИ:
Задача 3. Рассчитать среднюю молярную массу М полистирола по величине характеристической вязкости его толуольного раствора: [
РЕШЕНИЕ. Из уравнения [ 
Это уравнение удобнее решать с помощью логарифмирования:
ИЗУЧЕНИЕ КИНЕТИКИ НАБУХАНИЯ РАСТИТЕЛЬНОГО СЫРЬЯ
Цель работы: Построение изотермы набухания образцов растительного сырья; расчёт степени набухания.
Целевые задачи: Выяснение связи набухания с ориентацией растительных волокон; овладение методикой работы с прибором для изучения кинетики набухания.
УСТРОЙСТВО ПРИБОРА ДЛЯ ИЗУЧЕНИЯ КИНЕТИКИ НАБУХАНИЯ И МЕТОДИКА ИЗМЕРЕНИЙ
Прибор (рис. 4.1) состоит из цилиндрической измерительной ячейки 1 с перфорированными дном и крышкой и микрометра 3. В ячейке свободно перемещается поршень 2. Шток поршня упирается в шток микрометра. Исследуемый образец 4 помещается между поршнем и дном измерительной ячейки, которая устанавливается в штативе 5. К штативу прикреплен также и микрометр. После того, как прибор будет собран, измерительная ячейка с исследуемым образцом помещается в сосуд 6 с водой (или с другим растворителем). Пластина 8 штатива удерживает прибор в вертикальном положении на необходимой глубине. Перед погружением прибора с исследуемым образцом в растворитель необходимо поворотом рифленого кольца, окружающего микрометр по периметру, подвести ноль шкалы к стрелке. В момент погружения прибора в растворитель начинается отсчёт времени.
Измерения заключаются в отсчёте через определенные промежутки времени делений, на которые смещается стрелка, передвигаемая набухающим образцом. Отсчёт ведётся по чёрной шкале, градуированной на расширение. Цена деления соответствует 0,01 мм. Маленький циферблат микрометра служит для подсчёта числа полных оборотов стрелки.
ОСНАЩЕНИЕ РАБОЧЕГО МЕСТА
Приборы для изучения кинетики набухания Штангенциркуль
Образцы растительного сырья Секундомер
Обрезки фильтровальной бумаги Дистиллированная
1. Проверить оснащение рабочего места.
2. Получить у преподавателя 2 образца растительного сырья.
3. Измерить штангенциркулем длину, ширину и высоту обоих образцов и занести результаты измерений в таблицу 1.
5.2.2. Методы определения молекулярной массы полимеров по свойствам растворов
Свойства растворов
Наиболее часто среднечисленную молекулярную массу 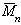
Молекулярная масса определяется как коэффициент, связывающий весовую и частичную концентрации
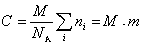
где С – весовая концентрация, г/см 3 ; 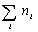
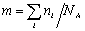
Таким образом, задача сводится к определению мольной концентрации раствора известной весовой концентрации.
Стремление молекул растворителя к самопроизвольному проникновению через мембрану определяется разностью химических потенциалов растворителя в частях системы, разделенных перегородкой, причем 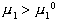
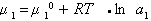
где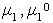
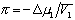
где 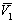
Связь между осмотическим давлением и весовой концентрацией растворов описывается следующими уравнениями:
(уравнение Вант-Гоффа) для растворов низкомолекулярных веществ
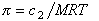
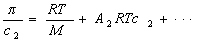
где А2 – второй вириальный коэффициент, характеризующий взаимодействие полимера с растворителем и форму макромолекул в растворе, обычно А3®0.
Величина p /c2 носит название приведенного осмотического давления. На рис. 2.50 показан пример зависимости приведенного осмотического давления для растворов полимера в различных растворителях. Чем больше наклон прямых, тем сильнее проявляется взаимодействие между компонентами раствора и тем больше величина
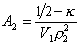
где k- параметр взаимодействия, r2 – плотность полимера в растворе, V1 – мольный объём растворителя.
При k = 0,5 А2 =0 и раствор ведет себя как идеальный. Таким образом, определяя наклон зависимости p /c2 = fc2 , можно охарактеризовать сродство компонентов раствора. Величина молекулярной массы определяется как
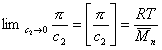
Найденная из измерений осмотического давления молекулярная масса характеризует 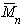
Метод светорассеяния. Среднемассовая молекулярная масса
Явление светорассеяния в растворах полимеров наблюдается в том случае, если размер макромолекул менее l/2 — половины длины волны проходящего света. Существуют различные теории рассеяния света, положенные в основу расчетных уравнений экспериментальных методов определения молекулярной массы. При условии, что размер молекул полимера меньше l/2, для растворов полимеров справедлива теория рассеяния света Эйнштейна.
Если рассеяние света происходит на сферических частицах, то интенсивность рассеяния будет одинаковой во всех направлениях. Обозначим угол, под которым по отношению к падающему лучу определяется интенсивность рассеянного света, Q. Рассеивающая способность характеризуется коэффициентом рассеяния R:
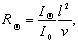
где IQ, I0— интенсивность рассеянного и падающего света; l– расстояние, на котором наблюдается рассеянный свет от рассеивающего объёма; v – рассеивающий объём.
В практике определения интенсивности рассеянного света наиболее часто определяется R90, т.е. рассеяние света под углом 90 o , хотя с помощью современных приборов, особенно использующих в качестве источника света лазер, можно определять интенсивность рассеянного света от Q = 4 o .
Для расчета молекулярной массы полимеров используется уравнение Дебая:
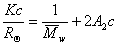
где с – весовая концентрация, г/см 3 ; K – оптическая постоянная, зависящая от коэффициента преломления среды (n0), концентрационного инкремента коэффициента преломления раствора (dn/dc) и длины волны света l,
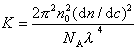
Таким образом для определения молекулярной массы следует измерять угловое рассеяние света, коэффициент преломления среды. Особенно тщательно следует определять (dn/dc), так как эта величина обычно чрезвычайно мала. Следует привлекать приборы, позволяющие определить коэффициент преломления с точностью до 6-го знака.
По аналогии с поглощением света можем записать для интенсивности рассеяния
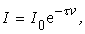
гдеt – мутность 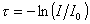
Мутность связана с коэффициентом рассеяния соотношением
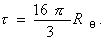
Поэтому, с учетом уравнения (2.5.19), можно проводить расчет молекулярной массы по уравнению
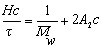
где Н – оптическая постоянная, Н = 16p K/3.
Для расчета молекулярной массы определяется величина
По углу наклона можно определить значение А2 и охарактеризовать взаимодействие компонентов раствора. Изменение температуры, замена растворителя могут вызвать изменение межмолекулярного взаимодействия компонентов раствора и формы макромолекул в растворе.
Молекулы могут приобретать и асимметрическую форму. В этом случае рассеяние света под разными углами к падающему лучу будет неравномерным и найденное значение молекулярной массы содержит погрешность. Поэтому необходимо вводить поправку на внутреннюю интерференцию света, появляющуюся в результате рассеяния света с некоторой разностью фаз от различных участков молекул. Для введения поправок существуют два основных метода: метод Дебая и метод Зимма.
Метод Дебая основан на измерении интенсивности рассеянного света при значении углов рассеяния, равных 135 и 45 o , соответственно R45 и R135. Отношение интенсивности равно отношению поправок Р и называется коэффициентом асимметрии
Величина z зависит от концентрации раствора, так как форма макромолекул в растворе может изменяться с увеличением концентрации. Для определения истинного значения z строят зависимость 1/(z-1)=fс и определяют 1/([z]-1) = limс®0 1/(z-1).
Зная z,по существующим таблицам находят величину Р, которую вводят в расчетное уравнение
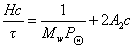
Метод Зимма основан на построении специальной диаграммы, на которой по оси абсцисс откладывается и концентрация, и угол рассеяния света. Линии на диаграмме образуют два семейства параллельных (практически прямых) линий. Более крутые линии представляют собой зависимость рассеяния света от концентрации растворов. Более пологие – зависимость рассеяния света от угла определения. Нижняя линия соответствует рассеянию света при с = 0, крайняя левая — дает совокупность точек при sin Q/2 =0. Обе прямые пересекаются с осью ординат в точке, характеризующей 
Для определения молекулярной массы полимеров можно измерять коэффициент диффузии растворенного вещества. Если представить, что макромолекулы имеют узкое распределение по молекулярной массе и каждая молекула не взаимодействует с другими молекулами полимера, то для молекулы, перемещающейся вдали от стенки сосуда, сила трения со средой может быть описана выражением
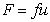
где F- сила трения; u – скорость перемещения молекулы; f =6ph0r- коэффициент трения сферических частиц; h0 – вязкость растворителя; r – радиус макромолекулы в растворе.
Уравнение (2.5.26) справедливо при скорости перемещения макромолекул 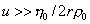
Предполагая применимость уравнения Эйнштейна для диффузии полимерных молекул в растворе, запишем
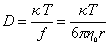
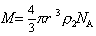
Сочетание (2.5.27) и (2.5.28) дает
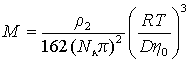
Cущественную ошибку может внести в расчет использование в качестве r2 значения плотности полимера, так как в растворе плотность макромолекул может значительно отличаться от плотности “сухого” полимера. Поэтому следует использовать значение 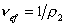
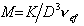
где vef— это тот удельный объём, который занимают макромолекулы в растворе, см 3 /г, учитывающий взаимодействие макромолекул в растворителе.
Вискозиметрический метод определенияvef и 
Существуют несколько уравнений, связывающих вязкость растворов полимеров с их концентрацией. Уравнение Симха для сферических частиц связывает удельную вязкость с объёмной концентрацией полимера:
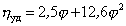
где j – объёмная доля, занимаемая полимером, 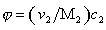
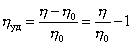
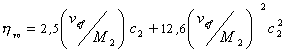
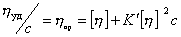
где 
Уравнение (2.5.33) носит название уравнения Хаггинса, K’ – постоянная Хаггинса, характеризующая форму макромолекул в растворе. Для сферических макромолекул K’ = 2, для эллипсоид-
ных K’ = 2¸10; для игольчатых форм K’ 2 x – ускорение центробежного поля, w – угловая скорость вращения; x – расстояние от молекулы до центра вращения; mh – масса одной сольватированной молекулы; vh – объем одной молекулы, r0 — плотность растворителя, vhr0 – поправка на выталкивающую силу.
Масса одной сольватированной молекулы, в соответствии с концепцией сольватированной частицы Онслея, определяется как
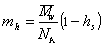
Объем одной сольватированной макромолекулы
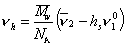
где v2— парциальный удельный объем макромолекул, см 3 /г; hsv1 0 — поправка на объем связанного растворителя; v1 0 = 1/r0 – — удельный объем растворителя, см 3 /г.
С учетом (2.5.36) и (2.5.37) запишем уравнение (2.5.35) в виде
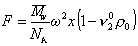
Можно видеть, что величина сольватации hs исключается из расчетного уравнения. Сила трения, уравновешивающая центробежную силу в стационарном режиме,
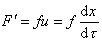
Из условия стационарности F= F’, следовательно,
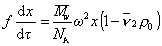
Для перехода от дифференциальной формы уравнения к интегральной Сведберг предложил использовать понятие постоянной седиментации
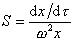
характеризующей скорость осаждения макромолекул под действием единицы центробежного поля. Эта постоянная зависит только от свойств макромолекул.
Коэффициент трения может быть определен из измерения коэффициента диффузии по уравнению Эйнштейна
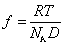

Уравнение (2.5.42) носит название уравнения Сведберга. Коэффициент диффузии D и коэффициент седиментации s определяются независимо. Для исключения эффекта взаимодействия макромолекул значение s экстраполируют к бесконечно малой концентрации и в расчетах используют значение s0.
Метод седиментации позволяет наиболее точно определить значение молекулярной массы полимера, так как здесь не надо определять или предполагать форму макромолекул, а величина сольватации исключается из расчетного уравнения. Экспериментально установлено, что
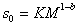
гдеK и b – постоянные, для многих полимеров приведенные в таблицах. Поэтому после калибровки постоянных уравнение (2.5.43) можно использовать для определения молекулярной массы без привлечения диффузионных измерений.
Определение средней молекулярной массы методом
По этому методу не проводят осаждения полимера, а ведут процесс только до установления равновесия между седиментацией и диффузией.
Для седиментационного потока
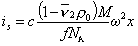
Для диффузионного потока
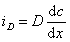
При седиментационно-диффузионном равновесии iD= is, следовательно,
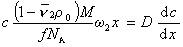
После преобразования с учетом D = kT/f и kNА=R получаем
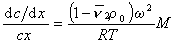
Откуда после интегрирования
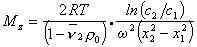
Таким образом достаточно определить значения концентрации раствора в двух точках кюветы чтобы рассчитать значение Mz . Этот метод носит название метода Арчибальда. Можно проводить расчет и по неустановившемуся равновесию, что значительно сокращает время эксперимента, но усложняет расчет.
Кроме определения молекулярной массы метод седиментационного ультрацентрифугирования в сочетании с вискозиметрией позволяет охарактеризовать форму макромолекул в растворе, определяя фактор Шераги — Манделькерна b, который для сферических частиц равен b = 2,12×10 6 .
Расчет проводится по формуле
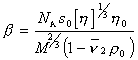
где s0 – коэффициент седиментации, экстраполированный к бесконечному разбавлению; [h] – характеристическая вязкость;h0 – вязкость растворителя.
http://pandia.ru/text/78/330/1691-7.php
http://xumuk.ru/colloidchem/154.html