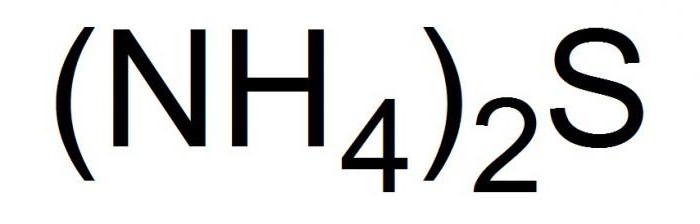Вычислить константу гидролиза и степень гидролиза соли NH4HS (гидросульфид аммония) (t=25°C).
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,203
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Гидролиз тиоцианата аммония
NH4SCN — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Молекулярное уравнение
NH4SCN + HOH ⇄ NH4OH + HSCN
Полное ионное уравнение
NH4 + + SCN — + HOH ⇄ NH4OH + H + + SCN —
Сокращенное (краткое) ионное уравнение
NH4 + + HOH ⇄ NH4OH + H +
Среда и pH раствора тиоцианата аммония
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Сульфид аммония: получение, гидролиз, применение
Азот — один из важнейших элементов органической химии. В виде сложных соединений элемент N является важной частью белков, из которых состоят все живые организмы на нашей планете. Этот достаточно активный химический элемент образует множество соединений, одним из которых является соединение аммония.
Что это такое
В молекуле аммиака азот охватывает своими ковалентными связями три атома водорода, причем последняя электронная связь остается свободной. Таким образом, аммоний может выступать донором различных химических реакций, образовывая четвертую – незатраченную ковалентную связь с другими веществами и соединениями. Если такое соединение происходит с атомом водорода, образуется молекула NH4. Полученный элемент может реагировать с различными кислотами, которые находятся в растворенном или концентрированном виде. При взаимодействии аммиак их нейтрализует. В итоге реакции получаются соли аммония — термически неустойчивые соединения. Если соль аммония нагревать, она быстро разлагается на составляющие вещества. При повышении температуры образуется аммиак с кислотой. Возможен и обратный процесс. Например, при взаимодействии с сероводородной кислотой можно получить сульфид аммония.
Формула
Это соединение записывается в химических уравнениях в видеследующей формулы.
Распространенные химические реакции
Гидролиз сульфида аммония отличается от других реакций подобных солей тем, что в ней принимают участие и катионы, и анионы одного и того же вещества. Процесс реакции зависит от температуры. Гидролиз сульфида аммония может быть записан следующим образом:
- ионное уравнение гидролиза по катиону:
NH4 + +H2O = NH3*H2O + H+; - уравнение гидролиза по аниону проходит в два этапа:
Итоговое ионное уравнение реакции выглядит следующим образом:
- NH4 + +S2- + 2H2O = NH3*H2O + HS- + H+ + OH-.
Стандартная запись этой химической реакции выглядит так:
Без нагревания реакция может быть обратима и происходит по первой ступени. Но если вещество подогреть, реакция станет необратимой – конечные вещества аммиак и сероводород просто покидают поле взаимодействия и улетучиваются.
Получение сульфида аммония
Сульфид аммония чаще всего получают при взаимодействии сероводорода с избытком аммиака:
Одной из наиболее характерных особенностей этого соединения является полное разложение соединения в воде. Цепь химической реакции выгладит следующим образом:
Сульфид аммиака в воде распадается на аммиак и сероводород.
Дальнейшее разложение сопровождается выделением водорода и появлением растворенного в воде аммиака и слабого аниона HS — . Поэтому в таблицах, поясняющих раствормость химических элементов, сульфид аммония помечен пропуском.
Практическое применение
В промышленности практическое применение разработано для паров сульфида аммония. Жидкая форма этого соединения используется при транспортировке. Хранят его в закрытых, химически инертных емкостях.
Это вещество хорошо знакомо фотографам и текстильщикам. В фотографии это соединение используется для обработки пленки. При взаимодействии с сильными основаниями происходит химическая реакция, сопровождающаяся выделением вредных веществ. В текстильной промышленности сульфид аммония используется как компонент отбеливающих смесей. Металлурги и реставраторы успешно пользуются им для превращения патины в бронзу. Сульфид аммония непременно используется при производстве мочевины, как важного удобрения, а также при производстве соды.
Возможно, применение этого вещества в хозяйственной деятельности было бы более распространенным. Но из-за чрезвычайной летучести этого соединения оно довольно быстро вступает в химическую реакцию с водяным паром, содержащимся в воздухе. Конечным продуктом этого взаимодействия является сероводород, который славится своим резким и очень неприятным запахом. Именно эта особенность сульфида аммония стала причиной его использования в производстве продукции для розыгрышей, включая «вонючие бомбы» и прочее.
http://chemer.ru/services/hydrolysis/salts/NH4SCN
http://www.syl.ru/article/225108/new_sulfid-ammoniya-poluchenie-gidroliz-primenenie