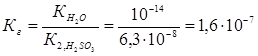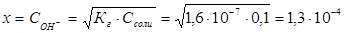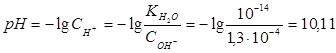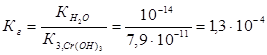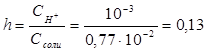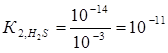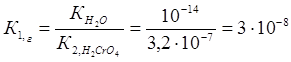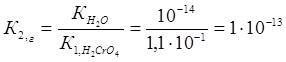Хлорид калия: способы получения и химические свойства
Хлорид калия KCl — соль щелочного металла калия и хлороводородной кислоты. Белое вещество, плавится и кипит без разложения. Умеренно растворяется в воде.
Относительная молекулярная масса Mr = 74,55; относительная плотность для тв. и ж. состояния d = 1, 984; tпл = 770º C; tкип = 1430º C;
Способ получения
1. Хлорид калия можно получить путем взаимодействия калия и разбавленной хлороводородной кислоты, образуются хлорид калия и газ водород:
2K + 2HCl = 2KCl + H2↑.
2. При комнатной температуре, в результате взаимодействия калия и хлора, образуется хлорид калия:
2K + Cl2 = 2KCl
3. Концентрированный раствор гидроксида калия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид калия, газ аммиак и вода:
4. Разбавленная хлороводородная кислота реагирует с гидроксидом калия . Взаимодействие хлороводородной кислоты с гидроксидом калия приводит к образованию хлорида калия и воды:
KOH + HCl = KCl + H2O
5. В результате взаимодействия сульфата калия и хлорида бария образуется сульфат бария и хлорид калия:
6. Карбонат калия взаимодействует с разбавленной соляной кислотой , образуя хлорид калия, углекислый газ и воду:
Качественная реакция
Качественная реакция на хлорид калия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид калия образует нитрат калия и осадок хлорид серебра:
KCl + AgNO3 = KNO3 + AgCl↓
Химические свойства
1. Хлорид калия вступает в реакцию со многими сложными веществами :
1.1. Хлорид калия взаимодействует с кислотами :
Хлорид калия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата калия и газа хлороводорода:
1.2. Хлорид калия способен вступать в реакцию с многими солями :
1.2.1. Твердый хлорид калия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида калия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, сульфата калия, газа хлора и воды:
1.2.2. Хлорид калия взаимодействует с гидросульфатом калия при температуре 450–700º C . При этом образуются сульфат калия и хлороводородная кислота:
1.2.3. При взаимодействии концентрированного раствора хлорида калия и насыщенного перхлората натрия выделяются перхлорат калия и хлорид натрия:
KCl + NaClO4 = KClO4↓ + NaCl
Как распознать растворы хлорида калия и нитрата калия? Запишите молекулярное, полное и сокращенное ионные уравнения
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Решение. 1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl .Такие соли гидролизу не подвергаются
1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl .Такие соли гидролизу не подвергаются, рН водного раствора =7.
2. Карбонат натрия Na2CO3 — соль, образованная сильным основанием NaOH и слабой кислотой H2CO3. Такие соли подвергаются гидролизу по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Поскольку при гидролизе в свободном виде образуются ионы гидроксила, водный раствор данной соли имеет щелочную среду (рН>7).
Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы Na + , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
В результате гидролиза образуется кислая соль NaНСО3.
3. Нитрат марганца Mn(NO3)2 — соль, образованная слабым основанием Mn(OH)2 и сильной кислотой HNO3. Такие соли подвергаются гидролизу по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Поскольку при гидролизе в свободном виде образуются ионы водорода, водный раствор данной соли имеет кислую среду (рН — , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
В результате гидролиза образуется основная соль MnOHNО3.
4. Ацетат аммония CH3COONH4 — соль, образованная слабым основанием NН4OH и слабой уксусной кислотой CH3COOH. Такие соли подвергаются гидролизу одновременно по катиону и по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Поскольку при гидролизе в свободном виде не образуются ни ионы водорода, ни ионы гидроксила водный раствор данной соли имеет близкую к нейтральной среду (рН≈7).
Уравнение гидролиза в молекулярной форме имеет вид:
Пример 2. Чему равна степень гидролиза h и значение рН сульфита натрия в растворе концентрации 0,1 моль/л?
Решение. Na2SО3 — соль, образованная сильным основанием NaOH и слабой кислотой H2SО3. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле:
В соответствии с уравнением реакции 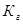
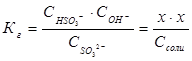
Степень гидролиза h показывает долю прогидролизовавшихся молекул и рассчитывается по формуле: 
Пример 3.Вычислите константу гидролиза и степeнь гидролиза раствора сульфата хрома Cr2(SO4)3, рН которого равен 3.
Решение. Cr2(SO4)3 — соль, образованная слабым основанием Cr(OH)3 и сильной кислотой H2SО4. Гидролиз протекает по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле:
Вычислим концентрацию ионов водорода, исходя из значения рН = -lg 


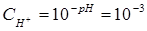
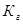
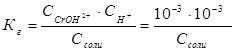

Пример 4.Вычислите константу диссоциации селенистоводородной кислоты Н2Se, если рН 0,05 М раствора Na2Se, равен 11,85.
Решение.Na2Sе — соль, образованная сильным основанием NaOH и слабой кислотой H2Sе. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Вычислим концентрацию ионов водорода, исходя из значения рН = -lg 


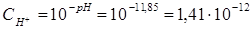
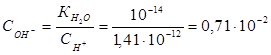
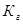
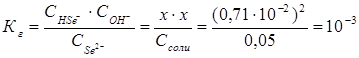
Константа гидролиза Кг рассчитывается по формуле: 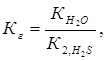
Пример 5.Вычислите константы гидролиза раствора хромата калия К2CrO4 и напишите уравнения гидролиза. По какой ступени гидролиз протекает в большей степени?
Решение.К2CrO4— соль, образованная сильным основанием КOH и слабой кислотой H2CrO4. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Константа гидролиза К1,г рассчитывается по формуле:
Константа гидролиза К2,г рассчитывается по формуле:
Так как К1,г˃ К2,г, то гидролиз по второй ступени практически не протекает.
12. ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции (ОВР) имеют большое значение в теории и практике. С ними связаны процессы: дыхание, обмен веществ, фотосинтез, гниение, горение, электролиз, коррозия металлов и др.
ОВР называются реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Степень окисления (зарядность, окислительное число) – это условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях.
Окислитель принимает электроны. Процесс приема электронов называется восстановлением, например:
Mn 6+ + 2e — ® Mn 4+ ,
Мn 6+ — окислитель, в процессе реакции восстанавливается до Mn 4+ .
Восстановитель отдает электроны. Процесс отдачи электронов называется окислением, например:
Zn 0 – 2e — ® Zn 2+ ,
Zn 0 – восстановитель, в процессе реакции окисляется до Zn 2+ .
Степень окисления может иметь нулевое, отрицательное, положительное значения.
При определении степени окисления следует знать несколько основных положений:
(-2) — степень окисления атома кислорода в соединениях:
H2 + O -2 , Cu +2 O -2 (исключение: пероксиды: H2 + O2 -1 , Na2O2 -1 , CaO2 -1 ; супероксиды (надперекиси): KO2 -1/2 , CsO2 -1/2 ; фторид кислорода O +2 F2 — ).
(-1) — степень окисления фтора в соединениях: H + F — , Са +2 F2 — .
( 0) — нулевую степень окисления имеют атомы в молекулах простых веществ и свободные металлы: H2 0 , O2 0 , Cl2 0 , Zn 0 , Cu 0 и др.
(+1) — степень окисления щелочных металлов (I А погруппа): Na + Cl — , K + Br — и др.
(+2) — степень окисления щелочноземельных металлов (II А подгруппа): Сa +2 Cl2 — , Ba +2 O -2 и др.
Используя эти данные, можно вычислять степени окисления других атомов в соединениях, зная, что алгебраическая сумма степеней окисления всех атомов, входящих в молекулу, равна нулю.
http://www.soloby.ru/470899/%D1%80%D0%B0%D1%81%D0%BF%D0%BE%D0%B7%D0%BD%D0%B0%D1%82%D1%8C-%D1%80%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80%D1%8B-%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%8F%D1%80%D0%BD%D0%BE%D0%B5-%D1%81%D0%BE%D0%BA%D1%80%D0%B0%D1%89%D0%B5%D0%BD%D0%BD%D0%BE%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F
http://lektsii.org/2-1073.html