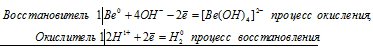Свойства s-элементов на примере бериллия, кальция и магния
Задание 329
Гидроксид какого из s-элементов проявляет амфотерные свойства? Составьте молекулярные и ионно-молекулярные уравнения реакций этого гидроксида: а) с кислотой; б) со щелочью.
Решение:
Гидроксид бериллия Ве(ОН)2 проявляет амфотерные свойства в кислой и щелочной средах он образует комплексы:
а) реакция с кислотами:
б) реакция со щёлочью:
Be(OH)2 + 2NaOH = Na2[Be(OH)4] (молекулярная форма);
Be(OH)2 + 2OH- = [Be(OH)4] 2- (ионно-молекулярная форма)
Задание 330
При пропускании диоксида углерода через известковую воду [раствор Са(ОН)2] образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснение этому явлению. Составьте уравнения реакций.
Решение:
При пропускании диоксида углерода через известковую воду [раствор Са(ОН)2] образуется осадок CaCO3:
При дальнейшем пропускании СО2 осадок карбоната кальция растворяется, так как образуется растворимый гидрокарбонат кальция:
Гидрокарбонат кальция существует только в водном растворе в виде ионов Са 2+ и НСО3 — :
Задание 331
Составьте электронные и молекулярные уравнения реакций: а) бериллия с раствором щелочи; б) магния с концентрированной серной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
Решение:
а) бериллий реагирует со щелочами с образованием комплексного иона [Be(OH)4] 2 -:
Be 0 + 2H + + 4OH — = [Be(OH)4] 2- + H2 0
После приведения уравнения получим:
б) Взаимодействие магния с концентрированной серной кислотой сопровождается образованием сульфата магния и сульфида магния:
4Mg 0 + 8H + + SO4 2- = 4Mg 2+ +S 2- + 4H2O
Задание 332
При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Напишите уравнения соответствующих реакций. О каких свойствах ВеО говорят эти реакции?
Решение:
При сплавлении оксид бериллия взаимодействует с оксидом кремния и оксидом натрия:
Эти реакции говорят о том, что оксид бериллия проявляет амфотерные свойства, реагируя с кислотным оксидом SiO2 и основным оксидом Na2O.
Гидролиз хлорида бериллия
BeCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
BeCl2 + HOH ⇄ BeOHCl + HCl
Полное ионное уравнение
Be 2+ + 2Cl — + HOH ⇄ BeOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Be 2+ + HOH ⇄ BeOH + + H +
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
BeOHCl + HOH ⇄ Be(OH)2 + HCl
Полное ионное уравнение
BeOH + + Cl — + HOH ⇄ Be(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
BeOH + + HOH ⇄ Be(OH)2 + H +
Среда и pH раствора хлорида бериллия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Ребят, составьте пожалуйста формулу гидроксида бериллия и запишите еще молекулярные и ионные уравнения с ней?
Химия | 5 — 9 классы
Ребят, составьте пожалуйста формулу гидроксида бериллия и запишите еще молекулярные и ионные уравнения с ней.
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be ^ 2 + + 2OH ^ — + 2H ^ + + 2Cl ^ — = Be ^ 2 + + 2Cl ^ — + 2H2O
2OH ^ — + 2H ^ + = 2H2O
Be(OH)2 + 2NaOH = Na2BeO2 + 2H2O
BeO2 ^ 2 — + 2H ^ + + 2Na ^ + + 2OH ^ — = 2Na ^ + + BeO2 ^ 2 — + 2H2O
2H ^ + + 2OH ^ — = 2H2O.
Составьте молекулярные и ионные уравнения реакций характеризующих свойства гидроксида алюминия как амфотерного гидроксида?
Составьте молекулярные и ионные уравнения реакций характеризующих свойства гидроксида алюминия как амфотерного гидроксида.
Составьте молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между : гидроксидом алюминия и серной кислотой?
Составьте молекулярные и ионно — молекулярные уравнения реакций взаимодействия в растворах между : гидроксидом алюминия и серной кислотой.
Составьте молекулярное, полное ионное и сокращенное ионное уравнение реакции между сульфатом аммония и гидроксидом калия?
Составьте молекулярное, полное ионное и сокращенное ионное уравнение реакции между сульфатом аммония и гидроксидом калия.
Составьте молекулярное и ионное уравнения реакции гидроксида бария и серной кислоты?
Составьте молекулярное и ионное уравнения реакции гидроксида бария и серной кислоты.
Составьте молекулярное и ионное уравнение реакций гидроксида калия и нитрата меди 2?
Составьте молекулярное и ионное уравнение реакций гидроксида калия и нитрата меди 2.
Составьте формулы двух солей аммония, и напишите молекулярно — ионные уравнения взаимодействия их с барий гидроксидом?
Составьте формулы двух солей аммония, и напишите молекулярно — ионные уравнения взаимодействия их с барий гидроксидом.
Составьте молекулярное и ионное уравнение реакции гидроксида бария серной кислоты?
Составьте молекулярное и ионное уравнение реакции гидроксида бария серной кислоты.
Блин ребят помогите срочно?
Блин ребят помогите срочно.
Составить молекулярные, полные ионные и короткие ионные уравнения реакций, протекающих между веществами : 1) Сульфат бериллия и гидроксида калия 2) Хлорид аммония и гидроксид бария помогите с решения очень срочно.
СРОЧНО?
Составьте уравнение химической реакции и запишите его в молекулярном, полном ионном и сокращённом ионном
Гидроксид натрия + хлорид железа (III) .
Запишите молекулярные и ионные уравнения реакций между гидроксидом кальция и азотной кислотой?
Запишите молекулярные и ионные уравнения реакций между гидроксидом кальция и азотной кислотой.
Вы зашли на страницу вопроса Ребят, составьте пожалуйста формулу гидроксида бериллия и запишите еще молекулярные и ионные уравнения с ней?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 5 — 9 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
2NO + O2 = 2NO2 Если принять объем оксида азота (II) за V’, а объем кислорода за V», то исходя из УХР, в котором коэффициенты показывают не только количество, но и объемы газообразных реагентов и продуктов реакции, V» = 0, 5V’ То есть, кислорода необ..
С + 2H2 — > CH4 2CH4 — > CH = — CH + 3H2 ( t = 1500) CH = — CH + H2 — > CH2 = CH2 (t, kat) CH2 = CH2 + H2O — > CH3 — CH2 — OH (kat) C6H6 + HONO2 — > C6H5NO2 + H2O ( t, H2SO4) C6H5NO2 + 3H2 — > C6H5NH2 + 2H2O.
Вот снизу должна быть указа формула на фото.
Mr(CH4) = 12 + 4 * 1 = 16 W(H) = 4 / 16 = 0. 25 = 25% Mr(C2H2) = 2 * 12 + 2 * 1 = 26 W(H) = 2 / 26 = 0. 08 = 8% Mr(C2H4) = 2 * 12 + 4 * 1 = 28 W(H) = 4 / 28 = 0. 14 = 14% Ответ : C2H2, C2H4, CH4.
Решение задачи находится на фото.
Марганец масса 54, 93 а валентность 2 ; 4 ; 7.
Дано : m(Cu) = 6. 4г Найти : V(SO2) — ? Решение : 6. 4г. Xл Cu + 2H2SO4 = SO2 + 2H2O + CuSO4 64г. 22. 4л X = 6. 4г×22. 4л : 64г = 2. 24л Ответ : выделился оксид серы (IV) массой 2. 24л.
Вода – слабый электролит, диссоциирующий на ионы H + и OH — — анионы. Этому процессу соответствует константа диссоциации воды : д * [H2O] = К H2O = [H + ] [OH — ] – ионное произведение воды, К H2O = 1 * 10 — 14 (при 25° С) К H2O – величина постоянна..
1. Литий — Li + 3 Li )2ē )1ē ē = 3, p = 3, n = 4 Находится в I группе, А подгруппе, II периоде. 2. Металл 3. Li Be 5. Высший оксид — Li2O — основный 6. Высший гидроксид — LiOH — щелочь 7. Летучего водородного соединения не образует..
Нет, там за каждый элемент ставится определенное кол — во баллов. На Решу ОГЭ вариант открой, после внизу страницы нажми «сохранить», далее будет написано, как оценивается каждое задание из 2 части.
http://chemer.ru/services/hydrolysis/salts/BeCl2
http://himia.my-dict.ru/q/308844_rebat-sostavte-pozalujsta-formulu-gidroksida-berillia/