Гидролиз нитрата кобальта (II)
Co(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
Co 2+ + 2NO3 — + HOH ⇄ CoOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Co 2+ + HOH ⇄ CoOH + + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
CoOH + + NO3 — + HOH ⇄ Co(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
CoOH + + HOH ⇄ Co(OH)2 + H +
Среда и pH раствора нитрата кобальта (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: нитрат свинца (II), карбонат калия. Какие значения pH имеют растворы их солей?
Решение:
Нитрат свинца (II) Pb(NO3)2– соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb 2 + связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Pb 2 + + H2O 
полное ионно-молекулярное уравнение:
Pb 2+ + 2NO3 — + H2O 
Pb(NO3)2+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HCO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
CO3 2– + H2O 
полное ионно-молекулярное уравнение:
2K + + CO3 2– + H2O 
K2CO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: хлорид цинка, сульфит натрия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид цинка ZnCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли ZnOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Zn 2+ + H2O 
полное ионно-молекулярное уравнение:
Zn 2+ + 2Cl — + H2O 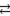
ZnCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HSO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
SO3 2– + H2O 
полное ионно-молекулярное уравнение:
2Na + + SO3 2– + H2O 
Na2SO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей хлорид кобальта (II), нитрат алюминия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид кобальта (II) CoCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Co 2+ + H2O 
полное ионно-молекулярное уравнение:
Co 2+ + 2Cl — + H2O 
CoCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 3+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Al 3+ + H2O 
полное ионно-молекулярное уравнение:
Al 3+ + 3NO3 — + H2O 
Al(NO3)3+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH
Нитрат кобальта II
| Нитрат кобальта II | |
|---|---|
| Систематическое наименование | Нитрат кобальта II |
| Традиционные названия | азотнокислый кобальт |
| Хим. формула | Co(NO3)2 |
| Состояние | розовые кристаллы |
| Молярная масса | 182,94 г/моль |
| Температура | |
| • плавления | разл. 200-300 °C |
| Энтальпия | |
| • образования | -421,5 кДж/моль |
| Растворимость | |
| • в воде | 83,94 0 ; 102,43 25 ; 184,82 70 г/100 мл |
| Рег. номер CAS | 10141-05-6 |
| PubChem | 25000 |
| Рег. номер EINECS | 233-402-1 |
| SMILES | |
| RTECS | GG1109000 |
| ChEBI | 86209 |
| ChemSpider | 23369 и 24834736 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат кобальта II — неорганическое соединение, соль металла кобальта и азотной кислоты с формулой Co(NO3)2, красные кристаллы, хорошо растворяется в воде, образует кристаллогидраты.
Содержание
Получение
- Растворение в разбавленной азотной кислоте кобальта, его оксида или карбоната:
Co + 4 HNO3 → Co(NO3)2 + 2 NO2 + 2 H2O CoO + 2 HNO3 → Co(NO3)2 + H2O CoCO3 + 2 HNO3 → Co(NO3)2 + CO2↑ + H2O
Кристаллы кобальта азотнокислого.
Физические свойства
Нитрат кобальта II образует розовые кристаллы кубической сингонии, параметры ячейки a = 0,741 нм.
Растворяется в воде, этаноле, ацетоне, диоксане, тетрагидрофуране.
Образует кристаллогидраты состава Co(NO3)2•n H2O, где n = 1, 2, 3, 4, 5, 6, 9.
С аммиаком образует аддукты вида Co(NO3)2•n NH3, где n = 2, 6 и 9.
Химические свойства
- Разлагается при нагревании:
2 Co(NO3)2 → 100oC 2 CoO + 4 NO2 + O2
http://poisk-ru.ru/s4411t5.html
http://chem.ru/nitrat-kobalta-ii.html




