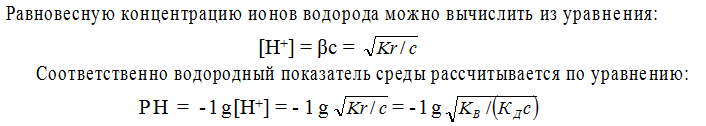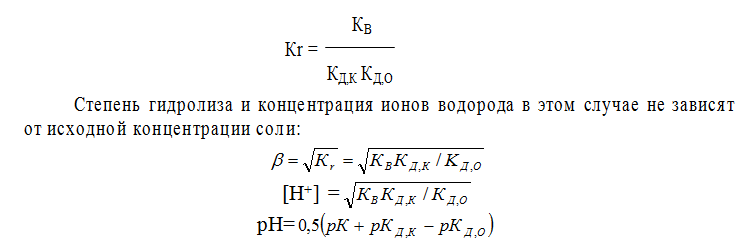Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
ИОННО-ОБМЕННЫЕ РЕАКЦИИ
Ионно-обменные реакции протекают в жидких растворах электролитов с участием ионов, на которые они диссоциируют. В ходе данных реакций степень окисления элементов не меняется.
Для усвоения данного раздела необходимо знать, что по способности к диссоциации на ионы электролиты (основания, кислоты, соли) делятся на сильные и слабые, при этом количественной характеристикой силы электролита является константа диссоциации Kд (Kд > 1 – сильные, Kд 7 (табл. 6) – сильный электролит, Н2О (Kд = 1,8 · 10 –16 ) – слабый электролит, СО2 и H2S – летучие соединения. Согласно выше изложенному, ионно-молекулярные уравнения записываем следующим образом:
а) 2Na + + (СО3) 2– + 2Н + + 2Сl – = 2Na + + 2Сl – + СО2 + Н2О;
б) 2K + + S 2– + 2H + + 2Cl – = H2S + 2K + + 2Cl – .
3. Исключаем одинаковые ионы из обеих частей в каждом равенстве и получаем сокращенные ионно-молекулярные уравнения, которые, собственно, и выражают суть процессов – взаимодействие ионов:
Пример 2. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Na2S и СuSО4; б) Na2SiO3 и HCI;
Решение. Действуем поэтапно, как в предыдущем примере.
1. Записываем уравнения в молекулярном виде:
2. Пользуясь данными табл. 7 приложения, находим, что CuS, H2SiO3,Fe(OH)3 нерастворимые соединения. Далее записываем соответствующие полные ионно-молекулярные уравнения:
а) 2Na + + S 2– + Cu 2+ + (SО4) 2– = CuS¯ + 2Na + + (SO4) 2– ;
б) 2Na + + (SiO3) 2– + 2H + + 2Cl – = H2SiO3¯ + 2Na + + 2Cl – ;
в) 2Fe 3+ + 3(SO4) 2– + 3Na + + 6OH – = 2Fe(OH)3¯ + 6Na + + 3(SO4) 2– .
3. После исключения одинаковых ионов из левой и правой частей в каждом равенстве получаем:
а) S 2– + Cu 2+ = CuS¯;
в) 2Fe 3+ + 6OH – = 2Fe(OH)3¯.
Пример 3. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) НСl и КОН; б) НNО3 и СН3СОONа;
1. Записываем уравнения в молекулярном виде:
а) НСl + KОН = KСl + H2O;
2. Используя значения констант диссоциации Kд (табл. 6 приложения), нaходим, что Н2О (Kд = 1,8 · 10 –16 ), СН3СООН (Kд = 1,85 · 10 –5 ), NH4OH (Kд = 1,79 · 10 –5 ) – слабые электролиты, остальные соединения – сильные электролиты (Kд > 1). В связи с этим, полные ионно-молекулярные уравнения будут иметь вид:
а) H + + Cl – + K + + OH – = K + + Cl – + H2O;
в) (NH4) + + Cl – + Na + + OH – = Na + + Cl – + NH4OH.
3. Исключив одинаковые ионы из обеих частей каждого равенства, получаем:
Пример 4. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
а) Ag + + Br – = AgBr¯;
а) Для получения AgBr необходимо взять два растворимых вещества, одно из которых содержит ион серебра, а другое – ион брома:
б) Для получения SO2 и Н2О необходимо взять в качестве исходных реагентов соль сернистой кислоты и кислоту более сильную, чем Н2SО3, т.е. способную вытеснить последнюю из её соли:
Пример 5. Составьте ионно-молекулярные уравнения и определите, в какую сторону смещено равновесие в следующих обратимых процессах, протекающих в растворах:
1. Составляем полные ионно-молекулярные уравнения для данных процессов:
а) FeS¯ + 2H + + 2Cl – « Fe 2+ + 2Cl – + H2S.
в) (СuOH) + + Cl – + H + + Cl – « Cu 2+ + 2Cl – + H2O.
2. После исключения одинаковых ионов из обеих частей каждого равенства
получаем следующие сокращённые ионно-молекулярные уравнения:
а) FeS¯ + 2H + + 2Cl – ® Fe 2+ + H2S.
в) (СuOH) + + H + ® Cu 2+ + H2O.
3. Определяем направление смещения химического равновесия. В обеих частях уравнений есть слабые электролиты. Необходимо оценить какое из каждой пары слабее и, следовательно, в сторону его образования и сдвинуто химическое равновесие.
а) Для оценки трудно растворимых веществ используют значения произведения растворимости (ПР): для FeS ПРFeS = 5,0 · 10 –18 (табл. 8 приложения). Для слабого электролита H2S, диссоциирующего в две ступени, находят суммарную константу диссоциации 

б) Произведение растворимости РbСl2 ( 

в) В данной реакции смещение химического равновесия происходит в сторону более слабого электролита – Н2О, так как ее константа диссоциации ( 


КОНТРОЛЬНЫЕ ЗАДАНИЯ
141. Составьте молекулярные, ионно-молекулярные и сокращенные ионно-молекулярные уравнения реакций, протекающих между веществами: a) FeS и НСl; б) ВаСl2 и H2SO4; в) NаНSО3 и NaOH. В обратимых реакциях укажите и объясните направление смещения химического равновесия.
142. Укажите, между какими веществами возможно взаимодействие:
Подтвердите ответ молекулярными и ионно-молекулярными уравнениями.
143. К каждому из веществ: а) Ва(NО3)2; б) FeCl2; в) Na2SO4 прибавили избыток раствора гидроксида натрия. В каком случае и почему произошла реакция? Составьте молекулярное и ионно-молекулярное уравнения протекающей реакции.
144. Определите, какой из сульфидов: а) HgS; б) SnS; в) MnS растворяется в соляной кислоте. Составьте молекулярное и ионно-молекулярное уравнения протекающей реакции.
145. Подберите три варианта молекулярных уравнений реакций, выражающихся одним приведённым ионно-молекулярным уравнением:
Дайте обоснование выбранным процессам.
146. К каждому из веществ КСl, Na3PО4 и Mg(NO3)2 прибавили раствор сульфата алюминия. В каком случае и почему произойдёт реакция? Составьте для неё молекулярное и сокращённое ионно-молекулярное уравнения.
147. К каждому из веществ K2SO4, CdOHCl и Zn(NO3)2 прибавили соляной кислоты НСl. В каком случае произойдёт реакция? Укажите соединение, образование которого вызывает смешение химического равновесия в сторону прямой реакции. Составьте молекулярные и ионно-молекулярные уравнения реакций.
148. К каждому из веществ: а) CuSO4, б) Сu(NO3)2, в) AlOHCl2 прибавили соляной кислоты. Определите, какая реакция протекает, составьте её молекулярное и ионно-молекулярное уравнения. Укажите направление смешения химического равновесия в выбранной реакции.
149. Укажите, какую пару веществ: а) СаSО3 и AlPO4; б) СаСО3 и К3РO4;
в) Са(NО3)2 и Nа3РО4 необходимо взять для осуществления реакции в соответствии со следующим сокращённым ионно-молекулярным уравнением:
150. Определите, какая соль: a) FeS; б) Ag2S; в) CdS растворяется в соляной кислоте. Составьте молекулярное и сокращённое ионно-молекулярное уравнения протекающей реакции.
151.Укажите, какая из нижеприведённых реакций является обратимой:
Определите, в какую сторону смещено равновесие реакции. Ответ мотивируйте.
152. Укажите, в каком случае возможно взаимодействие между веществами:
Составьте молекулярное и ионно-молекулярное уравнения реакции.
153. Мотивированно укажите, какая из нижеприведённых реакций является необратимой. Составьте для неё полное я сокращенное ионно-молекулярные уравнения.
154. Объясните, какой из гидроксидов: а) KОН; б) NН4ОН; в) Сr(ОН)3 необходимо взять для осуществления реакции в соответствии со следующим сокращённым ионно — молекулярным уравнением:
Составьте молекулярное и полное ионно-молекулярное уравнение взаимодействия хлорида железа (III) c выбранным гидрооксидом.
155. Определите, между какими веществами возможно взаимодействие:
a) NaOH и KСl; б) Сu(NO3)2 и Na2S; в) MgCl и K2SO4. Закончите молекулярное уравнение протекающей реакции. Составьте сокращённое ионно-молекулярное уравнение для неё.
156. Напишите для реакции (CuOH)2SO4 + H2SO4 « 2CuSO4 + 2H2О сокращённое ионно-молекулярное уравнение данной реакции. Определите, в какую сторону смещено равновесие данной реакции. Ответ мотивируйте.
157. Какие из приведённых ниже исходных веществ: а) Nа2СО3 и H2SO4;
б) МgCО3 и HNO3; в) K(НСО3) и НСl реагируют в соответствии со следующим сокращённым ионно-молекулярным уравнением:
Напишите молекулярное уравнение данной реакции.
158. Напишите сокращённое ионно-молекулярное уравнение реакции:
Определите и объясните, в какую сторону смещено равновесие реакции.
159. Укажите, какая из приведённых реакций и почему, протекает обратимо:
Составьте сокращённое ионно-молекулярное уравнение обратимой реакции.
160. Какую из кислот HCN, СН3СООН, НNО3 и почему нужно взять для реакции, которая выражается следующим ионно-молекулярным уравнением:
Напишите молекулярное уравнение реакции.
ГИДРОЛИЗ СОЛЕЙ
При усвоении данного раздела прежде всего необходимо вспомнить получение солей; такие понятия как сила электролитов, характеризующаяся константой диссоциации Kд, а также количественные показатели гидролиза – константу гидролиза KГ и степень гидролиза h [1…5, 10].
Обратите внимание на то, что соль – продукт взаимодействия кислоты с основанием (реакция нейтрализации). В результате, в зависимости от силы электролита[1] (кислоты и основания), получается четыре типа солей (таблица 3).
[1] Сила электролита, т. е. способность его диссоциировать на ионы, определяется константой диссоциации 


| Тип соли | Образующие соль | Гидролиз | Реакция раствора | Оценка гидролиза | ||
| основание | кислота | По константе гидролиза, Кг | По степени гидролиза, h | |||
| I | сильное | сильная | Не проис-ходит | Нейтр., рН=7 | – | – |
| КСl, KNO3, Na2SO4, KI, NaCl,… | ||||||
| II | слабое | сильная | Происхо-дит по катиону | Кислая рН 7 |  |  |
| K2SO4, CH3COONa, Na2SiO3, Na3PO4,… | ||||||
| IV | cлабое | cлабая | Происхо-дит по катиону и аниону | Близкая к нейтраль-ной рН»7 |  |  |
| CH3COONH4, Al2S3, (NH4)2S, Pb(CH3COO)2 |
KГ – константа гидролиза; h – степень гидролиза; 


Пример1. Гидролиз соли I типа
Докажите, что NaCl (1тип, таблица) гидролизу не подвергается.
Решение. Из четырех типов солей только три типа подвергаются гидролизу – II, III, IV. Причиной гидролиза соли является наличие в её молекуле иона слабого электролита (основания – II тип; кислоты – III тип; кислоты и основания – IV тип солей). Результат гидролиза – образование слабого электролита, малодиссоциирующего в растворе.
Соль NaCl образована сильной кислотой HCl, Kд, НCl = 10 7 > 1 и сильным основанием NaOH, 
Следовательно, соль NaCl относится к I типу (таблица 3) и не гидролизуется. В водном растворе соль диссоциирует по уравнению NaCl « Na + + Cl – , а вода – Н2О « Н + + (ОН) – .
При растворении NaCl в воде ионы Na + и Cl – c ионами H + и OH – не образуют молекулы NaOH и HCl, так как эти соединения являются сильными электролитами и существуют в растворе только в виде ионов. Поэтому в растворе соли NaCl гидролиза нет.
Пример 2. Гидролиз соли II типа.
По какому иону (катиону или аниону) гидролизуется соль Zn(NO3)2? Напишите молекулярное и ионно-молекулярное уравнения гидролиза соли. Докажите, что при обычных условиях гидролиз протекает только по первой ступени.
Решение. Соль Zn(NO3)2 образована слабым основанием Zn(OH)2, 
Катион Zn 2+ , по которому гидролизуется соль, двухзарядный. Поэтому гидролиз протекает по двум ступеням.
Первая ступень (молекулярное и ионно-молекулярное уравнения):
Zn 2+ + H2O « ZnOH + + H + ; рН + + H2O « Zn(OH)2 + H + ; рН 
Процесс гидролиза обратимый, поэтому, изменяя условия, при которых система находится в равновесии, возможно усилить или ослабить реакцию гидролиза соли (по принципу Ле-Шателье).
Усилить гидролиз можно разбавлением раствора или связыванием образующихся ионов OH – или H + . Поскольку реакция диссоциации воды – эндотермический процесс, т.е. протекает с поглощением тепла (DН 0):
Н2О « Н + + (ОН) – – 13 кДж,
то усилить гидролиз соли можно повышением температуры.
Пример 3. Гидролиз соли III типа.
Вычислите константу и степень гидролиза при t = 25 °C для 0,1 М и 0,001 М растворов Na2SO3. Пo какому иону (катиону или аниону) гидролизуется соль? Напишите молекулярное и ионно-молекулярное уравнения гидролиза. При каких условиях гидролиз этой соли протекает в большей степени?
Решение. Соль Na2SO3 образована сильным основанием NaOH, 

Анион (SO3) 2– , по которому гидролизуется соль, двухзарядный. Поэтому гидролиз протекает по двум ступеням.
Первая ступень (молекулярное и ионно-молекулярное уравнения):

Другой количественной характеристикой гидролиза соли является степень гидролиза h. Степень гидролиза – это отношение числа гидролизованных молекул к общему числу растворённых молекул. Степень гидролиза h связана с константой гидролиза KГ и концентрацией раствора соотношением KГ = h 2 · C. То есть, степень гидролиза возрастает с уменьшением концентрации соли.
Степень гидролиза для раствора с концентрацией соли С1 = 0,1 М:

а для С2 = 0,001 М степень гидролиза по первой ступени будет:

Вторая ступень (молекулярное и ионно-молекулярное уравнения):

Степень гидролиза по второй ступени для растворас С1 = 0,1 М будет:


При сравнении констант гидролиза ( 

Н2О « Н + + ОН – (ионно-молекулярное уравнение).
Смещение равновесия гидролиза Na2SO3 вправо при добавлении к раствору соли кислоты (например, HCl) соответствует реакции нейтрализации:



или (SO3) 2– + 2H + ® H2SO3 

В этой реакции роль основания играют ионы (SO3) 2– и (HSO3) – .
Пример 4. Гидролиз соли IV типа.
Каким образом гидролизуется соль CH3COONH4? Напишите молекулярное и ионно-молекулярное уравнения гидролиза соли. Определите рН этого раствора.
Решение. Соль CH3COONH4 образована слабым основанием (гидроксидом) NH4OH, 
Т.е. при гидролизе катиона NH4 + образуется ион H + , а при гидролизе аниона (CH3COO) – – ион (OH) – . Ионы Н + и (ОН) – при значительных концентрациях не могут сосуществовать. Они соединяются, образуя слабый электролит – воду (H2O), 



Образование молекул воды – более слабого электролита, чем NH4OH и СН3СООН, смещает равновесие вправо, что увеличивает гидролиз соли. Таким образом, гидролиз по катиону и гидролиз по аниону усиливают друг друга.
Молекулярное уравнение гидролиза:
Ионно-молекулярное уравнение гидролиза:
Реакция раствора таких солей зависит от соотношения констант диссоциации кислоты и основания, образующих соль. В данном случае


поэтому раствор имеет нейтральную реакцию, рН » 7.
Пример 5. Напишите продукты, получаемые при взаимодействии растворов хлорида железа (III) FeCl3 c карбонатом натрия Na2CO3.
Решение. Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимые вводе или неустойчивые к разложению с образованием летучих продуктов, то гидролиз соли протекает необратимо, т.е. сопровождается полным разложением её.
При взаимодействии водных растворов солей хлорида железа (III) FеС1з с карбонатом натрия Nа2СО3 образуется осадок Fе(OН)3 и выделяется СО2 – газ.
Происходящий процесс объясняется следующим образом. Соль FеС13, гидролизуясь по катиону, образует слабый малорастворимый электролит Fе(ОН)3. А соль Na2СО3, гидролизуясь по аниону, образует слабую кислоту Н2СО3, которая в свою очередь разлагается на воду (Н2О) и летучий продукт СО2 – газ. Процессы гидролиза по катиону и гидролиза по аниону усиливают друг друга, а образование малорастворимого соединения Fе(ОН)3 и СО2 – газа способствует необратимому процессу полного гидролиза солей.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
При решении задач в необходимых случаях следует пользоваться табл. 6 приложения.
161. Какая из предложенных солей ZnSO4, NaNO3, K3PO4 гидролизуется по катиону? Напишите молекулярное и ионно-молекулярное уравнения всех возможных ступеней гидролиза этой соли. По какой ступени, при обычных условиях, гидролиз этой соли больше? Ответ обоснуйте.
162. Какая из предложенных солей Na2SiO3 или А12(SO4)3 гидролизуется по аниону? Напишите молекулярное и ионно-молекулярное уравнения гидролиза этой соли. Докажите, что при обычных условиях протекает только первая ступень гидролиза. Определите рН полученного раствора.
163. При смешивании растворов АlCl3 и К2СО3 каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз молекулярным и ионно-молекулярным уравнениями. Объясните происходящий процесс.
164. Вычислите константу и степень гидролиза при t = 25 °С для 0,1 М и 0,001 М растворов СdС12. Напишите молекулярное и ионно-молекулярное уравнения гидролиза. Используя значения 
165. Какая из солей СНзСООNa, SnS или MgSO4 гидролизуется как по катиону, так и по аниону? Напишите молекулярное и ионно-молекулярное уравнения гидролиза этой соли. Каков рН раствора?
166. Вычислите степень гидролиза Аl2(SO4)3 по первой ступени 0,1 М раствора. Во сколько раз увеличится степень гидролиза соли при разбавлении раствора в 100 раз? Определите рН раствора гидролизуемой соли.
167. Какие из солей NaCl, SnSO4, Na2S подвергается гидролизу? Составьте молекулярные и ионно-молекулярные уравнения гидролиза этих солей. Используя значения 
168. Какие из солей NaNO3, А1С13, Na3PO4 подвергается гидролизу? Составьте молекулярное и ионно-молекулярное уравнения гидролиза этих солей. Вычислите 

169. Какая из предложенных солей СuSO4, Na2S гидролизуется по аниону. Напишите молекулярное и ионно-молекулярное уравнения всех возможных ступеней гидролиза этой соли. Докажите, что при обычных условиях протекает только первая ступень гидролиза. Каков рН раствора этой соли?
170. Напишите продукты, получаемые при взаимодействии растворов ZnCl2 с Na2S. Докажите, что каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз молекулярным и ионно-молекулярным уравнениями. Объясните происходящий процесс.
171. Определите, какие из предложенных солей (NH4)3PO4, NaCN, NaNO3 подвергаются гидролизу? Вычислите константы гидролиза 
172. Какие из предложенных солей (NH4)3PO4, K2CO3, СгСl3 гидролизуются только по катиону. Напишите молекулярное и ионно-молекулярное уравнения всех возможных ступеней гидролиза этой соли. По величинам 
173. По какому иону (катиону или аниону) гидролизуются соли Na2SiO3 и Fе2(SO4)3. Напишите молекулярные и ионно-молекулярные уравнения гидролиза этих солей. Докажите, что при обычных условиях протекает только первая ступень гидролиза. Определите рН полученных растворов.
174. При смешивании растворов Na2CO3 и CuCl2 каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз молекулярным и ионно-молекулярным уравнениями. Объясните происходящий процесс.
175. Вычислите константу и степень гидролиза при t = 25 °С для 0,1 М и 0,001 М растворов ZnCl2 и NaNO2. Напишите молекулярное и ионно-молекулярное уравнения гидролиза. Используя 
176. Какая из солей (NH4)2S и CuCl2 гидролизуется как по катиону, так и по аниону? Напишите молекулярное и ионно-молекулярное уравнения гидролиза этой соли. Каков рН её раствора?
177. Вычислите степень гидролиза Fe2(SO4)3 по первой ступени 0,1 М раствора. Во сколько раз увеличится степень гидролиза соли при разбавлении раствора в 10 раз? Определите рН раствора гидролизованной соли.
178. Какая из предложенных солей ZnSO4, Cr(NO3)3, Na2S гидролизуется по аниону? Напишите молекулярное и ионно-молекулярное уравнения всех возможных ступеней гидролиза этой соли. Докажите, чтo при обычных условиях протекает только первая ступень гидролиза. Каков рН раствора?
179. Вычислите степень гидролиза следующих солей NaCN и NaNO3 при концентрации каждой 0,1 М и 0,001 М. Как изменится гидролиз солей при разбавлении растворов в 100 раз?
180. При смешивании растворов Na2SiO3 и CrCl3 каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз молекулярным и ионно-молекулярным уравнениями. Объясните происходящий процесс.
Гидролиз солей, образованных кислотой и основанием
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Гидролиз солей.
Гидролиз – химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодисcоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например КСl.
Гидролиз соли, образованной слабой кислотой и сильным основанием, например CH3COONa. Соль в растворе полностью диссоциирует на ионы:
Вода, как уже указывалось, является слабым электролитом:
Ионы водорода воды взаимодействуют с ацетат-ионами с образованием слабой уксусной кислоты
Таким образом, гидролиз в ионной форме можно представит уравнением
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, а реакция среды стала основной, следовательно, при гидролизе соли, образованной сильным основанием и слабой кислотой, происходит увеличение рН системы, т. е. среда становится основной (происходит подщелачивание раствора).
Показателем глубины протекания гидролиза является степень гидролиза β, представляющая собой отношение концентрации гидролизованных молекул сгидр к исходной концентрации растворенных молекул электролита:
Принимая для упрощения, что в разбавленных растворах активность ионов мало отличается от их концентрации сиона = аиона, запишем константу равновесия реакции гидролиза:
Так как концентрация воды при гидролизе изменяется очень мало, то принимаем ее постоянной и, умножая на константу равновесия, получим константу гидролиза Кr:
Как указывалось ранее, [OH – ][ Н + ] ≈ КВ, а отношение – [Н + ][А – ] / [НА]
является константой диссоциации КД слабой кислоты НА. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
Если выразить концентрацию ионов и молекул при установлении равновесия
через степень гидролиза β и исходную концентрацию иона с, то получаем, что
Подставив эти значения в уравнение
Если гидролизу подвергается многоосновной анион, то гидролиз протекает по стадиям:
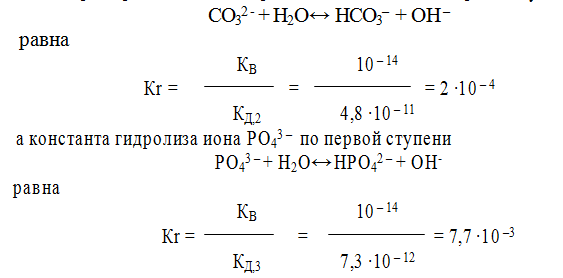
Константа гидролиза по первой ступени значительно выше, чем константа гидролиза по последней ступени. Например, для гидролиза СО3 2 – , при 298 К
Поэтому, при расчете концентраций ионов [ОН – ] или [Н + ], второй и третьей ступенью гидролиза обычно пренебрегают. Анализ уравнений гидролиза показывает, что в уравнении Кr = КВ / КД для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени. Например, константа гидролиза иона СО3 2- по первой ступени
Гидролиз солей, образованных сильной кислотой и слабым основанием, напримерNH4C1. В растворе соль NH4Cl диссоциирована
Гидролизу подвергается ион слабого основания NH4 +
Как видно, в результате гидролиза соли появляется некоторое избыточное количество ионов водорода, т. е. среда подкисляется. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основанием, приводит к подкислению раствора.
Степень гидролиза и константа гидролиза в данном случае описываются теми же уравнениями, но лишь с включением константы диссоциации слабого основания.
Гидролиз соли, образованной слабым основанием и слабой кислотой, напримерNH4F
Как видно, в результате гидролиза образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зависит от константы диссоциации как слабого основания КД,О, так и слабой кислоты КД,К
Как видно, в зависимости от соотношения рКД,К и рКД,О среда может иметь как кислую, так и основную реакцию.
Гидролиз играет важную роль в природных и технологических процессах. Например, расщепление пищи в желудочно-кишечном тракте идет по реакции гидролиза ее компонентов. Энергия в организмах в основном переносится с помощью аденозинтрифосфата (АТФ), гидролиз которого характеризуется отрицательным значением энергии Гиббса (-30,5 кДж/моль).
Гидролиз используется в технике при получении ценных продуктов из древесины, жиров и других веществ.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение, а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы K + и анионы CN. Катионы K + не могут связывать ионы ОН воды, так как КОН — сильный электролит. Анионы же CN связывают ионы H + воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CN – + H2O ↔ HCN + OH –
или в молекулярной форме
KCN + H2O↔ HCN + KOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН, поэтому раствор KCN имеет щелочную реакцию( рН > 7).
Таблица 19. Константы и степени диссоциации некоторых слабых электролитов
| Электролиты | Формула | Численные значения констант диссоциации | Степень диссоциации в 0,1 н. растворе, % |
| Азотистая кислота | HNO2 | K= 4,0 · 10 -4 | 6,4 |
| Аммиак (гидроксид) | NH4OH | K= 1,8 · 10 -5 | 1,3 |
| Муравьиная кислота | HCOOH | K= 1,76 · 10 -4 | 4,2 |
| Ортоборная кислота | H3BO3 | K1= 5,8 · 10 -10 | 0,007 |
| K2= 1,8 · 10 -13 | |||
| K3= 1,6 · 10 -14 | |||
| Ортофосфорная кислота | H3PO4 | K1= 7,7 · 10 -3 | 27 |
| K2= 6,2 · 10 -8 | |||
| K3= 2,2 · 10 -13 | |||
| Сернистая кислота | H2SO3 | K1= 1,7 · 10 -2 | 20,0 |
| K2= 6,2 · 10 -8 | |||
| Сероводородная кислота | H2S | K1= 5,7 · 10 -8 | 0,07 |
| K2= 1,2 · 10 -15 | |||
| Синильная кислота | HCN | K= 7,2 · 10 -10 | 0,009 |
| Угольная кислота | H2CO3 | K1= 4,3 · 10 -7 | 0,17 |
| K2= 5,6 · 10 -11 | |||
| Уксусная кислота | CH3COOH | K= 1,75 · 10 -5 | 1,3 |
| Фтороводородная кислота | HF | K= 7,2 · 10 -4 | 8,5 |
| Хлорноватистая кислота | HClO | K= 3,0 · 10 -8 | 0,05 |
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO3 2- , связывая водородные ионы воды, образуют анионы кислой соли НСО3, а не молекулы Н2СО3, так как ионы НСО3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
или в молекулярной форме
В растворе появляется избыток ионов ОН, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn 2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образования молекул Zn(OH)2 не происходит, так как ионы ZnOH + диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn 2+ + H2O ↔ ZnOH + + H +
или в молекулярной форме
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН 3+ + H2O ↔ AlOH 2+ + H +
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы H + и ОH образуют молекулу слабого электролита Н2O. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
http://megaobuchalka.ru/9/32697.html
http://farmf.ru/lekcii/gidroliz-solej-obrazovannyh-kislotoj-i-osnovaniem/