Молекулярное уравнение получения нитрата серебра из серебра
- Главная
- Список секций
- Химия
- ПОЛУЧЕНИЕ НИТРАТА СЕРЕБРА ИЗ ВТОРИЧНОГО СЫРЬЯ
ПОЛУЧЕНИЕ НИТРАТА СЕРЕБРА ИЗ ВТОРИЧНОГО СЫРЬЯ
Автор работы награжден дипломом победителя II степени
В настоящее время в современных школах (особенно в сельских и деревенских) существует проблема заказа и доставки химических реактивов. Одним из наиболее дорогостоящих и используемых в школьном химическом практикуме является нитрат серебра (I). Стоимость его за 1 г составляет от 25 до 45 рублей. Цена колеблется в зависимости от изготовителя и удалённости фирмы производителя от заказчиков.
Нитрат серебра (I) в школьном химическом практикуме используется при проведении ярких качественных реакций в неорганической и органической химии [1]. Поэтому отсутствие его в школьной лаборатории – это огромный минус «химической наглядности».
Таким образом, целью работы являлось получение нитрата серебра (I) в условиях школьной лаборатории.
Где же взять такой драгоценный металл как серебро?! Известно, что серебро содержится в рентгеновских снимках, проявленных фотоплёнках, в фотографиях [2]. Именно из них, в несколько стадий, был получен нитрат серебра (I).
1. Используя литературные источники, определить вторичное сырье для получения нитрата серебра
2. Получить нитрат серебра из различных объектов
3. Сравнить выход продуктов реакции
4. Провести качественные реакции с полученным в условиях школьной лаборатории нитратом серебра (I).
Глава I. Литературный обзор
1. 1 Серебро и его свойства
Серебро стало известно значительно позднее золота, хотя так же встречается в самородном состоянии. В Египте археологами найдены серебреные украшения, относящиеся ещё к додинастическому периоду (5000 – 3400 до н. э.). Однако долгое время серебро было большой редкостью и ценилось дороже золота.
Чистое серебро не темнеет на воздухе, а вот серебро с примесью может достаточно быстро потемнеть (рис. 1) [2].
Рис. 1. Серебреное изделие из ювелирного магазина (А) и после некоторого ношения человеком (Б).
Потемнение указывает на наличие серы в воздухе, например, при загрязнении воздуха или болезни обладателя серебреного предмета. После золота серебро является самым лёгким по обработке металлом. Из 30 граммов серебра можно вытянуть проволоку длиной более 50 км. Это также самый лучший из известных проводников тепла и электроэнергии [4].
Соединения серебра часто не устойчивы к нагреванию и действию света. Открытие светочувствительности солей серебра привело к появлению фотографии и быстрому увеличению спроса на серебро. Ещё в середине 20 века почти половина всего добытого серебра шла на изготовление кино- и фотоматериалов. Одним из соединений серебра является ляпис [5].
1.2 Применение нитрата серебра в медицине
Нитрат серебра, ляпис (AgNO3) − бесцветный (белый) порошок, хорошо растворимый в воде, на свету он чернеет с выделением металлического серебра (рис. 2) [3].
Рис. 2. Внешний вид нитрата серебра
Впервые ляпис был применён в XVII веке врачами-алхимиками: голландец Ян-Батист Ван Гельмонт и немец Франциск де ла Бое Сильвий. Они научились получать нитрат серебра взаимодействием металла с азотной кислотой. Учёные обнаружили, что прикосновение к кристаллам полученной серебряной соли приводит к появлению на коже чёрных пятен, а при длительном контакте – глубоких ожогов (рис. 3). Поэтому это вещество прозвали «адским камнем».
Рис. 3. Образование чёрных пятен при прикосновении к нитрату серебра.
Адский камень – не чистый нитрат серебра, а его сплав с нитратом калия, иногда отливается в виде палочек – ляписного карандаша. Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство.
Фармакологическое действие — антисептическое, вяжущее, противовоспалительное, прижигающее, противомикробное, бактерицидное. Связывает сульфгидрильные и карбоксильные группы, что может обусловливать изменение конформации белка, его структуры, или вызывать денатурацию. При диссоциации нитрата серебра ионы серебра вызывают преципитацию белков и обусловливают бактерицидное действие. Альбуминат серебра, образующийся при взаимодействии нитрата серебра с тканевыми белками, постепенно приобретает черную окраску (это связано с восстановлением из альбумината металлического серебра), что, в свою очередь, приводит к взаимодействию с активными группами ферментов. Блокирует некоторые ферментные системы, нарушая тем самым метаболические процессы в микробной клетке. В связи с этим нитрат серебра после кратковременного бактерицидного оказывает длительное бактериостатическое действие. Серебра нитрат при разведении 1:1000 уничтожает большинство микроорганизмов.
Ранее серебра нитрат применяли при хроническом гастрите и язвенной болезни желудка и двенадцатиперстной кишки (внутрь, в виде 0,05% раствора). Раствор (2%) может использоваться для профилактики гонококковой инфекции глаз у новорожденных [2].
1.3 Вторичное серебросодержащее сырьё
Основными поставщиками серебросодержащего сырья являются химическая, радио- и электротехническая промышленности; производства: ювелирное, часовое и зеркальное, а также рентгеновские кабинеты в медицинских поликлиниках.
Серебросодержащие отходы фото- и кинопромышленности образуются в процессе изготовления, обработки и порчи светочувствительных материалов или износа кинолент и фотоотпечатков.
Отходы химической промышленности поступают в виде отработанных контактных масс (20-80% Ag); отработанных катализаторов (более 80% Ag); шламов (от 60 до 80% Ag); лома серебряной аппаратуры (20-25% Ag).
Образование серебросодержащих отходов в зеркальной промышленности происходит в процессе серебрения зеркал, елочных украшений и так далее [3].
Часовое производство направляет на переработку следующие виды сырья, содержащего Ag, %: серебряные припои — от 15 до 99; серебряные контакты 20-80; опилки и стружку — от 10 до 70.
От лечебных учреждений на извлечение серебра поступают, %: зола рентгенопленки и фотоотпечатков — от 0,5 до 50; сернистое серебро 45-65.
Большое количество серебросодержащего сырья (до 30-40% Ag) перерабатывается в виде отходов электронной и электротехнической отраслей промышленности: вышедшие из строя серебряно-цинковые и серебряно-кадмиевые аккумуляторы (от 30 до 60%); сплавы-контакты, серебряные припои (от 5 до 99%); металлокерамические композиции 25-50.
Кроме перечисленных отходов на переработку поступают другие виды сырья, резко различающиеся химическими и физическими свойствами.
Глава II. Объекты и методы исследования
2.1 Объекты исследования
В качестве объектов исследования для получения реактива нитрата серебра были использованы рентгеновские снимки, фотоплёнка, ёлочная игрушка, зеркало (рис. 4).
Рис. 4. Вторичное серебросодержащее сырьё:
А. Рентгеновские снимки. Б. Фотоплёнка.
2.2 Методика получения нитрата серебра из рентгеновских снимков и фотоплёнок
Рентгеновские снимки и фотоплёнку резали на мелкие кусочки и отмеряли на весах по 17 граммов каждого. Далее подготовленный материал растворяли в азотной кислоте (концентрированной) (рис. 5).
Рис. 5. Растворение рентгеновских снимков в азотной кислоте.
После растворения объектов приливали раствор поваренной соли. Полученный осадок промывали водой и заливали раствором хлороводородной кислоты. После чего в осадок клали гранулы цинка для проведения реакции замещения. По завершении реакции, полученный порошок промывали и высушивали. Высушенное серебро растворяли в растворе азотной кислоты, затем выпаривали и растворяли в дистиллированной воде [1].
2.3 Методика получения нитрата серебра из серебросодержащих изделий
Ёлочную игрушку и зеркало очищали от различного рода загрязнений и заливали раствором азотной кислоты до растворения (рис. 6). Полученный раствор выпаривали и получали порошок, который прокаливали в фарфоровой чашке. К остуженному расплаву приливали воды, и полученный раствор нитрата серебра сливали.
Рис. 6. Растворение ёлочной игрушки в растворе азотной кислоты.
2.4 Методика проведения качественных реакций на галогенид-ионы
К растворам солей, содержащих хлорид-ионы, бромид-ионы, иодид-ионы приливали раствор полученного нитрата серебра. Наблюдали выпадение осадков.
2.5 Методика проведения реакции «серебряного зеркала»
К раствору аммиачного нитрата серебра добавляли примерно столько же глюкозы и нагревали содержимое пробирки до образования осадка на стенках.
Глава III. Результаты и их обсуждение
3.1 Результаты получения нитрата серебра из рентгеновских снимков и фотоплёнок
После добавления концентрированной азотной кислоты ионы серебра выделились в раствор. Далее при приливании к полученному раствору хлорида натрия происходило образование белого осадка (1) (рис. 7):
Ag + + NaCl → AgCl↓ + Na + (1).
Рис. 7. Образование белого осадка хлорида серебра.
После окончательного промывания и осаждения хлорида серебра к осадку с соляной кислотой добавляли гранулы цинка, что способствовало образованию серебра (2):
2AgCl↓ + Zn → ZnCl2 + 2Ag↓ (2)
После добавления к образовавшемуся серебру разбавленной азотной кислоты происходило образование нитрата серебра и выделение газа (3):
После выпаривания нитрата серебра, в случае с рентгеновской плёнкой его масса составила 1,2 грамма. В случае с фотоплёнкой масса нитрата серебра составила 0,8 граммов.
3.2 Результаты получения нитрата серебра из серебросодержащих изделий
Содержащееся на поверхности изделий серебро растворилось в растворе азотной кислоты полностью: от зеркала осталось прозрачное стекло. Теперь в растворе находятся соли серебра и меди. Чтобы избавиться от примеси солей меди, раствор выпарили и прокалили до образования оксида меди (II) (4) (рис. 8):
Рис. 11. Выпаривание раствора солей серебра и меди.
После приливали воду, нитрат серебра растворялся, а оксид меди оставался в виде осадка. Полученный раствор слили в склянку с надписью AgNO3.
3.3 Результаты проведения качественных реакций на галогенид-ионы с полученным нитратом серебра
После приливания нитрата серебра к растворам солей, содержащих хлорид-ионы, бромид-ионы, иодид-ионы происходило образование белого (5), светло-жёлтого (6) и жёлтого осадков (7) соответственно (рис. 9):
Рис. 9. Качественные реакции на галогенид-ионы. А. Хлорид-ионы. Б. Бромид-ионы. В. Иодид-ионы
3.4 Результаты проведения реакции «серебряного зеркала»
После добавления к аммиачному раствору серебра глюкозы и нагревании смеси, произошло выпадение осадка серебра на стенках пробирки (8):
Это свидетельствует о том, что в ходе исследования действительно был получен нитрат серебра.
ВЫВОДЫ
1. Исходя из литературных источников, сырьём для получения нитрата серебра являются рентгеновские снимки, фотоплёнки, ёлочные игрушки, зеркала.
2. Чистый нитрат серебра был получен из рентгеновских снимков и фотоплёнок.
3. Выход нитрата серебра, полученного из рентгеновских снимков оказался больше, чем при получении из фотоплёнок.
4. Были проведены качественные реакции с помощью полученного нитрата серебра.
5. При острой необходимости, нитрат серебра можно получить в школьной лаборатории.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Мосина Т. А. Нитрат серебра для ретро // Сделай сам. – 1990. — №4. С.141
2. Польза серебра для здоровья [Электронный ресурс]. – Лаборатория омоложения – Режим доступа: http://www.deus1.com/serebro.html
3. Серебряные лекарства [Электронный ресурс]. – Аптечные сторожилы. — Режим доступа: http://www.alhimik.ru/apteka/apt2N-Ag.html#4.31
4. Харитонов Ю. Я. Аналитическая химия. – М.: Высшая школа, 2001.
Нитрат серебра (азотнокислое серебро)
Нитрат серебра это бесцветные кристаллы которые очень быстро растворяются в воде и некоторых других растворителях, обладает токсичными свойствами.
Попадание на открытую кожу образует при длительном контакте химический ожог, при недолгом некоторое потемнение кожи от синевато фиолетового до черного цвета.
Именно поэтому получил название (адский камень), другое название : азотно-кислое серебро, ляпис (от слова камень).
Почти во всех реакциях проявляет окислительные свойства, признак реакции с нитратом серебра и хлоридом натрия, а также соляной кислотой это белый творожистый осадок хлорида серебра.
Который сереет на свету связи частичного восстановления серебра.
Что такое нитрат серебра AgNO3
Это неорганическое соединение, соль серебра, очень реакционно способное вещество (образует химические ожоги при попадания на кожу), как и все нитраты проявляет окислительные свойства.
Формула нитрата серебра AgNO3
( Ляпис ) основное получение реакцией серебра с азотной кислотой :
Получение нитрата серебра
Основное получение действием азотной кислоты на серебро содержащие материалы или шлам, основывается на окислении серебра сильной азотной кислотой, в результате чего получается нитрат серебра (азотно кислое серебро) оксид азота и вода.
В результате получается технический нитрат, для очищения реагируют с хлоридом натрия, почти чистый хлорид серебра (творожистый осадок) восстанавливают до металлического серебра, получается чистый нитрат серебра.
В производственных масштабах чистый нитрат серебра, получают из уже аффинированного серебра (не менее 99,8 %), реагируя его с азотной кислотой в присутствии кислорода (для доокисления высших в более высокие оксиды азота).
Нитрат серебра применение
Нитрат серебра раствор применяется в медицине как средство для прижигания свежих ранок и бородавок. Благодаря своим бактерицидным свойствами используется и в настоящее время как противовоспалительное средство.
Для лечения некоторых болезней язв, в акушерстве. Служит источником для получения других веществ в том числе и некоторых органических. В анализе серебра содержащих материалов, в производстве зеркал и зеркальных покрытий.
В недавнем прошлом применялся как компонент проявителя для фотографий, фотоэмульсий, а также для усилителей и других серебро содержащих растворов.
Ионы серебра применяются в косметических средствах, мазях для борьбы с угрями и прыщами.
Купить нитрат серебра можно в аптеке или специальных химических магазинах, цена нитрата серебра зависит от стоимости серебра на коммерческом рынке к примеру один килограмм нитрата серебра на 01.01.2020 составил 26100.00 грн или 70083.72 рубля, или 957,66 долларов.
Свойства нитрата серебра
Нитрат серебра белый порошок , который хорошо растворим в воде . Плотность 4,352 г/см³ . Молярная масса нитрата серебра 169,87 г/моль , Температура плавления 209,7 °C При нагревании до 300 °C плавиться , повышение нагревания приводит разложение нитрата серебра 1 на серебро , оксид азота и кислород .
Теплоёмкость 93,0 Дж/(моль·К). Энтальпия образования −124,5 кДж/моль. Энтропия 140,9 Дж/(моль·К) при 298 К.
Хорошо растворим в метаноле , пиридине , эфире , этаноле. Водный раствор нитрата серебра с альдегидом даёт реакцию серебряного зеркала.
Реакции нитрата серебра
Нитрат серебра нагревание свыше 350°C приводит к разложению его на свободный металл , оксид азота и кислород :
2AgNO3 → 2Ag + 2NO2 + O2 (нитрат серебра разложение)
Реакция с щелочами приводит к образованию оксида серебра ( I ) и нитрата щёлочи :
Реакция с солями галогенов приводит к образованию соответствующих ( хлоридов , бромидов , йодидов ) серебра и нитратов щелочей :
AgNO3 + NaCl → AgCl + NaNO3 (нитрат серебра + хлорид натрия)
AgNO3 + КCl → AgCl + КNO3 (нитрат серебра + хлорид калия)
Нитрат серебра и хлорид бария образуется нитрат бария и хлорид серебра
2AgNO3 + CuCl2 → 2AgCl + Cu(NO3)2 нитрат серебра + хлорид меди 2
Карбонат натрия приводит к образованию карбоната серебра и нитрата серебра :
Реакция с серной кислотой ( конц. ) приводит к образованию сульфата серебра и азотной кислоты :
Взаимодействие сульфата натрия даёт сульфат серебра и нитрат натрия :
Реакция с ортофосфатом натрия даёт ортофосфат серебра и нитрат натрия :
Реакция с соляной кислотой приводит к образованию хлорида серебра :
Реакция с хлором приводит к образованию оксида азота ( V ) кислорода и хлорида серебра реакция протекает в присутствии четырёх хлористого углерода ( катализатор ) при 0°C :
Реакция с сероводородом даёт сульфит серебра и азотную кислоту :
В зависимости от концентрации ( аммиачной воды , нашатырный спирт ) даёт разные реакции с концентрированным :
С разбавленной даёт оксид серебра ( I ) и аммиачную селитру :
Подобно себя ведёт тиосульфат натрия в концентрированном состоянии даёт комплексное соединение и нитрат натрия :
В разбавленном состоянии даёт тиосульфат серебра :
Реакция с концентрированными цианидами приводит к комплексному соединению дицианоаргентат( I ) натрия и нитрата натрия :
С разбавленным цианид серебра и нитрат натрия :
С концентрированным роданид (тиоцианат) калия даёт комплексное соединение дицианоаргентумат калия и нитрат калия :
С разбавленным нитрат калия и тиоцианат серебра :
Концентрированный нитрит калия даёт комплексное соединение и нитрат калия :
С разбавленным нитрат калия и нитрит серебра :
Реакция с концентрированным с сульфитом натрия даёт комплексное соединение битиосульфатоаргенат ( I ) натрия и нитрат натрия :
С разбавленным сульфит серебра и нитрат натрия :
Смесь нитрата серебра , аммиачной воды ( нашатырный спирт ) и формальдегида даёт реакцию серебряного зеркала :
Что мы узнали о нитрате серебра?
Для чего используется нитрат серебра?
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия, иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Как получить нитрат серебра?
Получают нитрат серебра высокой степени чистоты упариванием раствора нитрата серебра, нагреванием раствора и введением высаливателя — концентрированной азотной кислоты.
Чем смыть с кожи нитрат серебра?
Сначала — тщательно намазать черные пятна йодной настойкой и дать впитаться. Серебро перейдет в йодид. А потом — отмачивать руки в тиосульфате (он же — фиксаж нейтральный для фотографии). Если одного подхода окажется мало — процедуру повторить.
Что будет если нагреть нитрат серебра?
Нитрат серебра сначала будет плавиться, а нагревание свыше 350°C приводит к разложению его на свободный металл , оксид азота и кислород.
Как получить нитрат серебра в домашних условиях?
Для этого нужно поместить некоторое количество чистого серебра в лабораторную колбу и добавить азотной кислоты средней концентрации, поставить нагревать в вытяжной шкаф, после поставить на небольшой нагрев для удаления остатков азотной кислоты.
Статья на тему нитрат серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Нитрат серебра I
| Нитрат серебра | |
|---|---|
 | |
| Систематическое наименование | Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
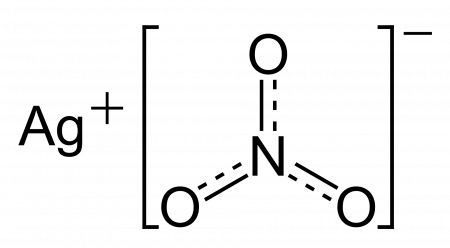
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Температура | |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4 кДж/моль |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Показатель преломления | 1,744 |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES | |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| ЛД50 | 20 мг/кг (собака, орально) 800 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС |     |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 4.1 Использование в медицине
- 5 Токсичность
- 6 Галерея
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
http://znaesh-kak.com/x/li/serebro/%D0%BD%D0%B8%D1%82%D1%80%D0%B0%D1%82-%D1%81%D0%B5%D1%80%D0%B5%D0%B1%D1%80%D0%B0
http://chem.ru/nitrat-serebra-i.html