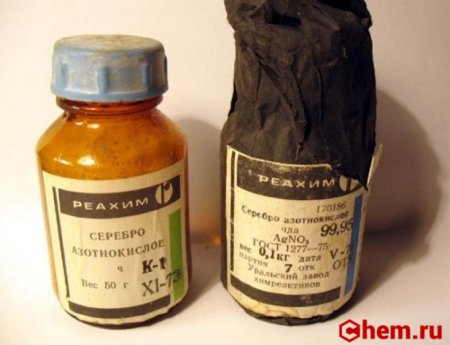
Молекулярное уравнение реакции получения нитрата серебра
Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства нитрата серебра, и укажите признаки их протекания.
Дан раствор нитрата серебра, а также набор следующих реактивов: водные растворы соляной кислоты, бромида калия, нитрата магния, ацетата свинца и уксусной кислоты.
Внимание: в случае ухудшения самочувствия перед началом опытов или во время их выполнения обязательно сообщите об этом организатору в аудитории.
1. Вы приступаете к выполнению эксперимента. Для этого получите лоток с лабораторным оборудованием и реактивами у специалиста по обеспечению лабораторных работ в аудитории.
2. Прочтите ещё раз перечень веществ, приведённый в тексте к заданиям 23 и 24, и убедитесь, что на выданном лотке находится пять перечисленных в перечне реактивов.
3. Перед началом выполнения эксперимента осмотрите ёмкости с реактивами и определите способ работы с ними. При этом обратите внимание на рекомендации, которым Вы должны следовать.
— В склянке находится пипетка. Это означает, что отбор жидкости и переливание её в пробирку для проведения реакции необходимо проводить только с помощью пипетки. Для проведения опытов отбирают 7–10 капель реактива.
— Пипетка в склянке с жидкостью отсутствует. В этом случае переливание раствора осуществляют через край склянки, которую располагают так, чтобы при её наклоне этикетка оказалась сверху («этикетку — в ладонь!»). Склянку медленно наклоняют над пробиркой, пока нужный объём раствора не перельётся в неё. Объём перелитого раствора должен составлять 1–2 мл (1–2 см).
— Для проведения опыта требуется порошкообразное (сыпучее) вещество. Отбор порошкообразного вещества из ёмкости осуществляют только с помощью ложечки или шпателя.
— При отборе исходного реактива взят его излишек. Возврат излишка реактива в исходную ёмкость категорически запрещён. Его помещают в отдельную, резервную пробирку.
— Сосуд с исходным реактивом (жидкостью или порошком) обязательно закрывается крышкой (пробкой) от этой же ёмкости.
— При растворении в воде порошкообразного вещества или при перемешивании реактивов следует слегка ударять пальцем по дну пробирки.
— Для определения запаха вещества взмахом руки над горлышком сосуда с веществом направляют пары этого вещества на себя.
— Для проведения нагревания пробирки с реактивами на пламени спиртовке необходимо:
1) снять колпачок спиртовки и поднести зажжённую спичку к её фитилю;
2) закрепить пробирку в пробиркодержателе на расстоянии 1–2 см от горлышка пробирки;
3) внести пробирку в пламя спиртовки и передвигать её в пламени вверх и вниз так, чтобы пробирка с жидкостью равномерно прогрелась;
4) далее следует нагревать только ту часть пробирки, где находятся вещества, при этом пробирку удерживать в слегка наклонном положении;
5) открытый конец пробирки следует отводить от себя и других лиц;
6) после нагревания жидкости пробиркодержатель с пробиркой поместить в штатив для пробирок;
7) фитиль спиртовки закрыть колпачком.
— Если реактивы попали на рабочий стол, их удаляют с поверхности стола с помощью салфетки.
— Если реактив попал на кожу или одежду, необходимо незамедлительно обратиться за помощью к специалисту по обеспечению лабораторных работ в аудитории.
4. Вы готовы к выполнению эксперимента. Поднимите руку и пригласите организатора в аудитории, который пригласит экспертов предметной комиссии для оценивания проводимого Вами эксперимента.
5. Начинайте выполнять опыт. Записывайте в черновике свои наблюдения за изменениями, происходящими с веществами в ходе реакций.
6. Вы завершили эксперимент. В бланке ответов № 2 подробно опишите наблюдаемые изменения, которые происходили с веществами в каждой из двух проведённых Вами реакций. Сделайте вывод о химических свойствах веществ (кислотно-оснόвных, окислительно-восстановительных), участвующих в реакции, и классификационных признаках реакций.
Подготовьте лабораторное оборудование, необходимое для проведения эксперимента. Проведите химические реакции между нитратом серебра и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Опишите изменения, происходящие с веществами в ходе проведённых реакций.
В результате реакции ионного обмена наблюдается выпадение белого творожистого осадка нерастворимой соли.
В результате реакции ионного обмена наблюдается выпадение жёлтого осадка нерастворимой соли.
Нитрат серебра I
| Нитрат серебра | |
|---|---|
 | |
| Систематическое наименование | Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
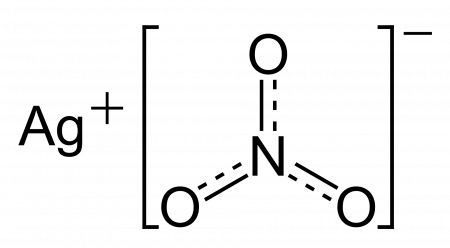
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Температура | |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4 кДж/моль |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Показатель преломления | 1,744 |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES | |
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| ЛД50 | 20 мг/кг (собака, орально) 800 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС | 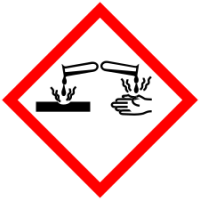    |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 4.1 Использование в медицине
- 5 Токсичность
- 6 Галерея
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Нитрат серебра (азотнокислое серебро)
Нитрат серебра это бесцветные кристаллы которые очень быстро растворяются в воде и некоторых других растворителях, обладает токсичными свойствами.
Попадание на открытую кожу образует при длительном контакте химический ожог, при недолгом некоторое потемнение кожи от синевато фиолетового до черного цвета.
Именно поэтому получил название (адский камень), другое название : азотно-кислое серебро, ляпис (от слова камень).
Почти во всех реакциях проявляет окислительные свойства, признак реакции с нитратом серебра и хлоридом натрия, а также соляной кислотой это белый творожистый осадок хлорида серебра.
Который сереет на свету связи частичного восстановления серебра.
Что такое нитрат серебра AgNO3
Это неорганическое соединение, соль серебра, очень реакционно способное вещество (образует химические ожоги при попадания на кожу), как и все нитраты проявляет окислительные свойства.
Формула нитрата серебра AgNO3
( Ляпис ) основное получение реакцией серебра с азотной кислотой :
Получение нитрата серебра
Основное получение действием азотной кислоты на серебро содержащие материалы или шлам, основывается на окислении серебра сильной азотной кислотой, в результате чего получается нитрат серебра (азотно кислое серебро) оксид азота и вода.
В результате получается технический нитрат, для очищения реагируют с хлоридом натрия, почти чистый хлорид серебра (творожистый осадок) восстанавливают до металлического серебра, получается чистый нитрат серебра.
В производственных масштабах чистый нитрат серебра, получают из уже аффинированного серебра (не менее 99,8 %), реагируя его с азотной кислотой в присутствии кислорода (для доокисления высших в более высокие оксиды азота).
Нитрат серебра применение
Нитрат серебра раствор применяется в медицине как средство для прижигания свежих ранок и бородавок. Благодаря своим бактерицидным свойствами используется и в настоящее время как противовоспалительное средство.
Для лечения некоторых болезней язв, в акушерстве. Служит источником для получения других веществ в том числе и некоторых органических. В анализе серебра содержащих материалов, в производстве зеркал и зеркальных покрытий.
В недавнем прошлом применялся как компонент проявителя для фотографий, фотоэмульсий, а также для усилителей и других серебро содержащих растворов.
Ионы серебра применяются в косметических средствах, мазях для борьбы с угрями и прыщами.
Купить нитрат серебра можно в аптеке или специальных химических магазинах, цена нитрата серебра зависит от стоимости серебра на коммерческом рынке к примеру один килограмм нитрата серебра на 01.01.2020 составил 26100.00 грн или 70083.72 рубля, или 957,66 долларов.
Свойства нитрата серебра
Нитрат серебра белый порошок , который хорошо растворим в воде . Плотность 4,352 г/см³ . Молярная масса нитрата серебра 169,87 г/моль , Температура плавления 209,7 °C При нагревании до 300 °C плавиться , повышение нагревания приводит разложение нитрата серебра 1 на серебро , оксид азота и кислород .
Теплоёмкость 93,0 Дж/(моль·К). Энтальпия образования −124,5 кДж/моль. Энтропия 140,9 Дж/(моль·К) при 298 К.
Хорошо растворим в метаноле , пиридине , эфире , этаноле. Водный раствор нитрата серебра с альдегидом даёт реакцию серебряного зеркала.
Реакции нитрата серебра
Нитрат серебра нагревание свыше 350°C приводит к разложению его на свободный металл , оксид азота и кислород :
2AgNO3 → 2Ag + 2NO2 + O2 (нитрат серебра разложение)
Реакция с щелочами приводит к образованию оксида серебра ( I ) и нитрата щёлочи :
Реакция с солями галогенов приводит к образованию соответствующих ( хлоридов , бромидов , йодидов ) серебра и нитратов щелочей :
AgNO3 + NaCl → AgCl + NaNO3 (нитрат серебра + хлорид натрия)
AgNO3 + КCl → AgCl + КNO3 (нитрат серебра + хлорид калия)
Нитрат серебра и хлорид бария образуется нитрат бария и хлорид серебра
2AgNO3 + CuCl2 → 2AgCl + Cu(NO3)2 нитрат серебра + хлорид меди 2
Карбонат натрия приводит к образованию карбоната серебра и нитрата серебра :
Реакция с серной кислотой ( конц. ) приводит к образованию сульфата серебра и азотной кислоты :
Взаимодействие сульфата натрия даёт сульфат серебра и нитрат натрия :
Реакция с ортофосфатом натрия даёт ортофосфат серебра и нитрат натрия :
Реакция с соляной кислотой приводит к образованию хлорида серебра :
Реакция с хлором приводит к образованию оксида азота ( V ) кислорода и хлорида серебра реакция протекает в присутствии четырёх хлористого углерода ( катализатор ) при 0°C :
Реакция с сероводородом даёт сульфит серебра и азотную кислоту :
В зависимости от концентрации ( аммиачной воды , нашатырный спирт ) даёт разные реакции с концентрированным :
С разбавленной даёт оксид серебра ( I ) и аммиачную селитру :
Подобно себя ведёт тиосульфат натрия в концентрированном состоянии даёт комплексное соединение и нитрат натрия :
В разбавленном состоянии даёт тиосульфат серебра :
Реакция с концентрированными цианидами приводит к комплексному соединению дицианоаргентат( I ) натрия и нитрата натрия :
С разбавленным цианид серебра и нитрат натрия :
С концентрированным роданид (тиоцианат) калия даёт комплексное соединение дицианоаргентумат калия и нитрат калия :
С разбавленным нитрат калия и тиоцианат серебра :
Концентрированный нитрит калия даёт комплексное соединение и нитрат калия :
С разбавленным нитрат калия и нитрит серебра :
Реакция с концентрированным с сульфитом натрия даёт комплексное соединение битиосульфатоаргенат ( I ) натрия и нитрат натрия :
С разбавленным сульфит серебра и нитрат натрия :
Смесь нитрата серебра , аммиачной воды ( нашатырный спирт ) и формальдегида даёт реакцию серебряного зеркала :
Что мы узнали о нитрате серебра?
Для чего используется нитрат серебра?
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия, иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Как получить нитрат серебра?
Получают нитрат серебра высокой степени чистоты упариванием раствора нитрата серебра, нагреванием раствора и введением высаливателя — концентрированной азотной кислоты.
Чем смыть с кожи нитрат серебра?
Сначала — тщательно намазать черные пятна йодной настойкой и дать впитаться. Серебро перейдет в йодид. А потом — отмачивать руки в тиосульфате (он же — фиксаж нейтральный для фотографии). Если одного подхода окажется мало — процедуру повторить.
Что будет если нагреть нитрат серебра?
Нитрат серебра сначала будет плавиться, а нагревание свыше 350°C приводит к разложению его на свободный металл , оксид азота и кислород.
Как получить нитрат серебра в домашних условиях?
Для этого нужно поместить некоторое количество чистого серебра в лабораторную колбу и добавить азотной кислоты средней концентрации, поставить нагревать в вытяжной шкаф, после поставить на небольшой нагрев для удаления остатков азотной кислоты.
Статья на тему нитрат серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
http://chem.ru/nitrat-serebra-i.html
http://znaesh-kak.com/x/li/serebro/%D0%BD%D0%B8%D1%82%D1%80%D0%B0%D1%82-%D1%81%D0%B5%D1%80%D0%B5%D0%B1%D1%80%D0%B0