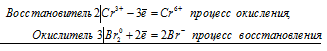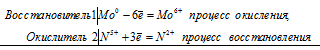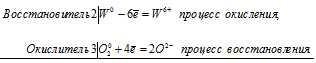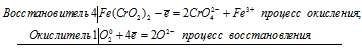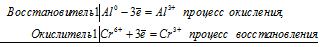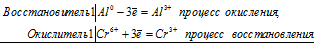Химические свойства хрома
Задание 411
Хромит калия окисляется бромом в щелочной среде. Зеленая окраска раствора переходит в желтую. Составьте электронные и молекулярные уравнения реакции. Какие ионы обусловливают начальную и конечную окраску раствора?
Решение:
Уравнение реакции окисления-восстановления хромата калия бромом
2Cr 3+ + 3Br2 0 = 2Cr 6+ + 6Br —
Начальная, зелёная окраска обусловливается хромит-ионами CrO2 — , а конечная, жёлтая – хромат-ионами CrO4 2- .
Задание 412
Составьте электронные и молекулярные уравнения реакций растворения: а) молибдена в азотной кислоте; б) вольфрама в щелочи в присутствии кислорода. Учтите, что молибден и вольфрам приобретают высшую степень окисления.
Решение:
Уравнения реакций растворения металлов в кислоте и щёлочи
а) Растворение молибдена в азотной кислоте
б) Растворение вольфрама в щелочи в присутствии кислорода
2W 0 + 3O2 0 = 2W 6+ + 6O 2-
Задание 413
При сплавлении хромита железа Fe(CrO2)2 с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают соответственно степени окисления +6 и +3. Составьте электронные и молекулярное уравнения реакции.
Решение:
Уравнение реакции сплавления хромита железа с карбонатом натрия
Задание 414
К подкисленному серной кислотой раствору дихромата калия прибавили порошок алюминия. Через некоторое время оранжевая окраска раствора перешла в зеленую. Составьте электронные и молекулярное уравнения реакции.
Решение:
Уравнение реакции серной кислоты с дихроматом калия
Al 0 + Cr 6+ = Al 3+ + Cr 3+
Задание 415
Хром получают методом алюминотермии из его оксида (III), а вольфрам — восстановлением оксида вольфрама (VI) водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
Решение:
Уравнениие реакции получения хрома методом алюминотермии
а) Получение хрома методом алюминотермии
Al 0 + Cr 6+ = Al 3+ + Cr 3+
б) Получение вольфрама методом алюминотермии
Гидролиз хромата калия
K2CrO4 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
K2CrO4 + HOH ⇄ KHCrO4 + KOH
Полное ионное уравнение
2K + + CrO4 2- + HOH ⇄ K + + HCrO4 — + K + + OH —
Сокращенное (краткое) ионное уравнение
CrO4 2- + HOH ⇄ HCrO4 — + OH —
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
KHCrO4 + HOH ⇄ H2CrO4 + KOH
Полное ионное уравнение
K + + HCrO4 — + HOH ⇄ H2CrO4 + K + + OH —
Сокращенное (краткое) ионное уравнение
HCrO4 — + HOH ⇄ H2CrO4 + OH —
Среда и pH раствора хромата калия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
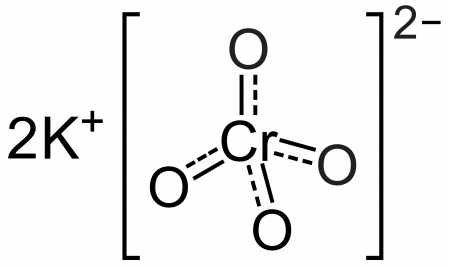
Хромат калия
| Хромат калия | |
|---|---|
 | |
| Систематическое наименование | Хромат калия |
| Традиционные названия | Хромовокислый калий |
| Хим. формула | K2CrO4 |
| Состояние | жёлтые кристаллы |
| Молярная масса | 194,19 г/моль |
| Плотность | 2,732 г/см³ |
| Температура | |
| • плавления | 968,3; 973 °C |
| • кипения | 1000 °C [1] |
| Растворимость | |
| • в воде | 63,0 20 ; 75,1 80 ; 79,2 100 г/100 мл |
| Показатель преломления | 1,74 |
| Рег. номер CAS | 7789-00-6 |
| PubChem | 24597 |
| Рег. номер EINECS | 232-140-5 |
| SMILES | |
| RTECS | GB2940000 |
| ChEBI | 75249 |
| ChemSpider | 22999 |
| Токсичность | яд и канцероген |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хромат калия — неорганическое соединение, соль металла калия и хромовой кислоты с формулой K2CrO4, жёлтые кристаллы, растворимые в воде, окрашивает раствор, как и многие другие хроматы, в желтый цвет.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Токсичность
Получение
- В природе встречается редкий минерал тарапакаит — хромат калия с примесями.
- Окисление оксида хрома III хлоратом калия:
Cr2O3 + KClO3 + 2K2CO3 → 500−700oC 2K2CrO4 + KCl + 2CO2
- Растворение оксида хрома VI в едком кали:
CrO3 + 2KOH → K2CrO4 + H2O
- Разложение бихромата калия при нагревании:
4K2Cr2O7 → 500−600oC 4 K2CrO4 + 2Cr2O3 + 3O2
- Действие концентрированного раствора едкого кали на дихромат калия:
K2Cr2O7 + 2KOH → 2 K2CrO4 + H2O
Калий хромат и дихромат калия.
Физические свойства
Хромат калия образует жёлтые кристаллы ромбической сингонии, пространственная группа P nam, параметры ячейки a = 0,761 нм, b = 1,040 нм, c = 0,592 нм, Z = 4.
При 668°С переходит в гексагональную красную фазу.
Хорошо растворяется в воде с гидролизом по аниону. Плохо растворим в этаноле.
Химические свойства
- В разбавленных кислотах переходит в дихромат калия:
2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + H2O
- С концентрированными кислотами реакция идёт иначе:
K2CrO4 + 2HCl → K[Cr(Cl)O3] + KCl + H2O
- С концентрированными горячими кислотами проявляются окислительные свойства:
2 K2CrO4 + 16HCl → 90oC 2CrCl3 + 3Cl2↑ + 4KCl + 8H2O
- Вступает в обменные реакции:
K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3 K2CrO4 + Hg2(NO3)2 → Hg2CrO4↓ + 2KNO3
Применение
- В качестве поглотителя УФ излучения лампы накачки в твердотельных лазерах для предотвращения деградации активной среды.
- Как протрава при крашении тканей.
- Окрашивание стекла в жёлтый цвет.
- Дубитель в кожевенной промышленности.
- Отбеливатель для масла и воска.
- Окислитель в органическом синтезе.
- Хромат калия используется как химический стандарт для калибровки калориметров по температуре и теплоемкости.
Токсичность
Хромат калия очень ядовит и канцерогенен, как и многие другие соединения шестивалентного хрома.
http://chemer.ru/services/hydrolysis/salts/K2CrO4
http://chem.ru/hromat-kalija.html