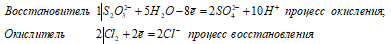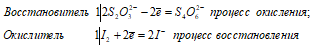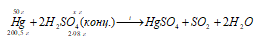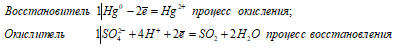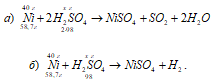Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Качественная реакция
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат натрия образует сульфат бария и хлорид натрия:
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
2.3. Сульфат натрия реагирует с оксидом серы (VI) . Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
2.4. Сульфат натрия взаимодействует с хлоридом бария . При этом образуются хлорид натрия и сульфат бария:
Сульфат натрия (Na2SO4): строение, свойства, применение, производство
Сульфат натрия (Na2SO4): строение, свойства, применение, производство — Наука
Содержание:
В сульфат натрия представляет собой неорганическую соль, химическая формула которой Na2ЮЗ4. Он состоит из белого твердого вещества, представленного в трех формах: безводный, гептагидрат (почти не доступен) и декагидрат (известный как соль Глаубера); последний — самая распространенная форма сульфата натрия.
Декагидрат сульфата натрия, Na2ЮЗ410H2Или он был обнаружен в 1625 году Глобером в родниковой воде, который назвал его sal mirabilis (чудодейственная соль) из-за ее лечебных свойств.
Сульфат натрия находит широкое применение в текстильной и бумажной промышленности, а также в производстве стекла. Его использование распространяется на тепловые приложения, которые включают подачу тепла окружающей среды и охлаждение ноутбуков.
Сульфат натрия — это соединение с низкой токсичностью, и его вредное действие в основном механическое, а не химическое. По кристаллографическим причинам эта соль, как и ее калиевый аналог K2ЮЗ4, представлены решетчатые и полиморфные структуры.
Состав
Безводная соль
Формула Na2ЮЗ4 сразу указывает на то, что в кристаллах соли ионы Na + Так что4 2- они находятся в соотношении 1: 2; то есть на каждые два катиона Na + есть анион SO4 2- взаимодействуя с ними посредством электростатического притяжения (верхнее изображение).
Конечно, это относится к Na2ЮЗ4 безводный, без молекул воды, скоординированных с натрием внутри кристаллов.
Несмотря на то, что соль является на вид простой, ее описание структурно сложное. Затем2ЮЗ4 Он представляет собой полиморфизм, содержащий до пяти кристаллических фаз: I, II, III, IV и V, температуры перехода которых составляют 180, 200, 228, 235 и 883 ºC соответственно.
Хотя нет никаких свидетельств, подтверждающих это, Na2ЮЗ4Я должен быть тот, у кого гексагональная кристаллическая структура, более плотная по сравнению с ромбической Na2ЮЗ4III, в кристаллах которого Na + образуют тетраэдры (NaO4) и октаэдры (NaO6) согласование; то есть он может быть окружен четырьмя или шестью анионами SO4 2- .
Обезвоженная соль
Между тем, моноклинная кристаллическая структура его важнейшего гидрата Na2ЮЗ410H2Или проще. В нем практически молекулы воды взаимодействуют или координируются с Na + в октаэдрах Na (H2ИЛИ)6 + , с SO4 2- просто обеспечивая достаточную стабильность кристалла, чтобы он существовал в твердой фазе.
Однако его температура плавления (32,38 ºC) намного ниже, чем у безводной соли (884 ºC), показывает, как молекулы воды и их водородные связи ослабляют более сильные ионные взаимодействия в Na2ЮЗ4.
Свойства
Имена
-Сульфат натрия (ИЮПАК)
-Глауберова соль (декагидрат)
-Чудесная соль (декагидрат)
Молярная масса
142,04 г / моль (безводный)
322,20 г / моль (декагидрат)
Внешность
Белое гигроскопичное кристаллическое твердое вещество
Запах
Вкус
Горький и соленый
Плотность
2664 г / см 3 (безводный)
1464 г / см 3 (декагидрат)
Обратите внимание, как молекулы воды внутри кристаллов заставляют их расширяться и, следовательно, уменьшать их плотность.
Температура плавления
884 ºC (безводный)
32,38 ºC (декагидрат)
Точка кипения
1,429 ºC (безводный)
Растворимость воды
4,76 г / 100 мл (0 ºC)
13,9 г / 100 мл (20 ° С)
42,7 г / 100 мл (100 ° C)
Все значения растворимости соответствуют безводной соли, которая хорошо растворяется в воде при всех температурах.
Растворимость резко возрастает между 0 ° C и 38,34 ° C, при этом в этом диапазоне температур растворимость увеличивается более чем в 10 раз. Однако начиная с 32,38ºC растворимость не зависит от температуры.
Бывает, что при температуре 32,8 ºC декагидрат сульфата натрия растворяется в собственной кристаллической воде. Таким образом достигается равновесие между декагидратной солью, безводной солью и насыщенным раствором сульфата натрия.
Пока поддерживается трехфазное состояние, температура остается постоянной, что позволяет калибровать температуру термометров.
С другой стороны, растворимость гептагидрированной соли:
19,5 г / 100 мл (0 ºC)
44,0 г / 100 мл (20 ° С)
Обратите внимание, что при 20 ° C гептагидратная соль в три раза более растворима, чем безводная.
Показатель преломления
Стабильность
Стабилен при соблюдении рекомендуемых условий хранения. Несовместим с сильными кислотами и основаниями, алюминием и магнием.
Разложение
При нагревании до разложения выделяет токсичный дым оксида серы и оксида натрия.
pH
5% водный раствор имеет pH 7.
Реактивность
Сульфат натрия диссоциирует в водном растворе на 2 Na + Так что4 2- , что позволяет сульфат-иону соединяться с Ba 2+ для осаждения сульфата бария. Это практически помогает вытеснить ионы бария из проб воды.
Сульфат натрия превращается в сульфид натрия в результате реакции с углем при повышенных температурах:
Глауберова соль, NaSO4.10H2Или он реагирует с карбонатом калия с образованием карбоната натрия.
Приложения
Бумажная промышленность
Сульфат натрия используется при производстве бумажной массы. Используется при производстве крафт-бумаги, которая не содержит лигнин или подвергается процессу отбеливания, что придает ей большую стойкость. Кроме того, его используют при изготовлении картона.
Моющие средства
Он используется в качестве наполнителя для синтетических бытовых моющих средств, добавляется к моющему средству для снижения поверхностного натяжения.
Очки
Он используется в производстве стекла для уменьшения или устранения мелких пузырьков воздуха в расплавленном стекле. Кроме того, он исключает образование шлака в процессе рафинирования стекломассы.
Текстильная промышленность
Сульфат натрия используется как протрава, так как он облегчает взаимодействие красителей с волокнами тканей. Декагидрат сульфата натрия используется в тесте на окрашивание.
Кроме того, сульфат натрия используется в качестве разбавителя красителя и вспомогательного агента для печати на красителях; такие как прямые красители, серные красители и другие вещества, способствующие окрашиванию хлопка. Он также используется в качестве замедлителя прямого окрашивания шелка.
Лекарство
Декагидрат сульфата натрия используется как слабительное, так как он плохо всасывается в кишечнике и поэтому остается в просвете кишечника, вызывая увеличение объема. Это стимулирует усиление перистальтических сокращений, которые вызывают изгнание кишечного содержимого.
Сульфат натрия — это противоядие от отравления солями бария и свинца. Соль Глобера эффективна для устранения некоторых чрезмерно проглатываемых лекарств; например, парацетамол (ацетоаминофен).
Кроме того, он используется для пополнения дефицита электролитов, присутствующих в изоосмотических растворах.
Осушитель
Сульфат натрия, являясь инертным реагентом, используется для удаления воды из растворов органических соединений.
Сырье
Сульфат натрия используется в качестве сырья для производства многих веществ, в том числе сульфида натрия, карбоната натрия и сульфата аммония.
Получение
Сульфат натрия получают добычей полезных ископаемых и химическими реакциями.
Горная добыча
Есть три руды или минерала, которые эксплуатируются с промышленным выходом: тенардит (Na2ЮЗ4), мирабилит (Na2ЮЗ410H2O) и глаубарит (Na2ЮЗ4·Случай4).
В Испании месторождения тенардита и мирабилита разрабатываются путем подземной разработки галерей и столбов. Между тем, глауберит добывается в открытом грунте с использованием больших плотов, устанавливаемых на месторождение полезных ископаемых.
Земля подготовлена с помощью взрывных работ малой интенсивности для получения пористости, которая позволяет выщелачивать сульфат натрия. Фаза производства происходит при орошении дождеванием пресной водой глауберита, выщелачивание которого распространяется вниз.
Солевой раствор сульфата натрия собирают, оставляя остаток сульфата кальция в качестве наполнителя.
Химическое производство
Сульфат натрия получают при производстве соляной кислоты двумя способами: процессом Мангейма и процессом Хардгривса.
Мангеймский процесс
Его проводят в больших сталеплавильных печах и на стальной реакционной платформе длиной 6 м. Реакция происходит между хлоридом натрия и серной кислотой:
Процесс Hardgreaves
Он включает реакцию хлорида натрия, оксида серы, кислорода и воды:
Другие
Сульфат натрия образуется в реакции нейтрализации гидроксида натрия и серной кислоты:
Сульфат натрия является побочным продуктом производства множества соединений. Его извлекают из жидких отходов, сбрасываемых при производстве вискозы и целлофана. Также в производстве дихромата натрия, фенолов, борной кислоты и карбамата лития.
Риски
Сульфат натрия считается соединением с низкой токсичностью. Однако это может причинить вред человеку, который использует его ненадлежащим образом.
Например, контакт может вызвать раздражение глаз, покраснение и боль. На коже у некоторых людей он может вызывать раздражение и аллергию. Проглатывание может вызвать раздражение пищеварительного тракта с тошнотой, рвотой и диареей. И, наконец, его вдыхание вызывает раздражение дыхательных путей.
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Википедия. (2019). Сульфат натрия. Получено с: en.wikipedia.org
- Национальный центр биотехнологической информации. (2019). Сульфат натрия. База данных PubChem. CID = 24436. Получено с: pubchem.ncbi.nlm.nih.gov
- Б. Н. Мехротра. (1978). Кристаллическая структура Na2ЮЗ4III. Получено с: rruff-2.geo.arizona.edu
- Глауберит-тенардит (сульфат натрия). [PDF]. Получено с: igme.es
Патологическое пристрастие к азартным играм: симптомы, причины, последствия и лечение
Характеристика окислительно-восстановительных свойств серной кислоты. Получение тиосульфата натрия
Реакции получения тиосульфата натрия
Задача 866.
Написать уравнение реакции получения тиосульфата натрия. Какова степень окисленности серы в этом соединении? Окислительные или восстановительные свойства проявляет тиосульфат-ион? Привести примеры реакций.
Решение:
Уравнения реакций получения тиосульфата натрия:
а) Водный раствор сульфита натрия кипятят в присутствии серы, а затем охлаждают, выделяется кристаллогидрат тиосульфата натрия:
Водный раствор сульфита натрия кипятят в присутствии серы, а затем охлаждают, выделяется кристаллогидрат тиосульфата натрия.
б) Окисление полисульфидов кислородом воздуха:
в) Получение тиосульфата натрия путём взаимодействия серы со щёлочью. Реакция протекает с одновременным окислением и восстановлением серы:
г) Непосредственное взаимодействие сернистого ангидрида с сероводородом в щелочной среде. Для этого смесь обеих газов пропускают при сильном размешивании в раствор едкого натра до его нейтрализации, то образуется тиосульфат натрия:
Атомы серы, входящие в состав тиосульфатов имеют различную степень окисленности; у одного атома степень окисленности равна +4, у другого 0.Тиосульфат-ион S2O3 2- проявляет свойства восстановителя. Хлор, бром и другие сильные окислители окисляют его до сульфат-иона SO4 2- , например:
Взаимодействие тиосульфата натрия с хлором (при его избытке):
S2O3 2- + 4Cl2 0 + 5H2O ↔ 2SO4 2- + 8Cl — + 10H +
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ 2H 2 SO 4 + 2NaCl + 6HCl l
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4. При нагревании свыше 200 0С тиосульфат натрия распадается по схеме:
4Na2S2O 
При этом протекает реакция самоокисления-восстановления.
Реакции серной кислоты
Задача 867.
Составить уравнения реакций: а) концентрированной Н2SO4 с магнием и с серебром; б) разбавленной Н2SO4 с железом.
Решение:
а) 4Mg + 5Н2SO4(конц.) → 4MgSO4 + H2S↑) + 4H2O;
б) 2Ag + 2Н2SO (конц.) → Ag2SO4 + SO2↑ + 2H2O;
в) Fe + Н2SO4(разб.) → FeSO4 + H2↑.
Задача 868.
Сколько граммов серной кислоты необходимо для растворения 50 г ртути? Сколько из них пойдет на окисление ртути? Можно ли для растворения ртути взять разбавленную серную кислоту?
Решение:
Уравнение реакции:
Из уравнений окисления-восстановления следует, что на окисление 1 моль Hg затрачивается 1 моль H2SO4, следовательно,
200,5 : 98 = 50 : х; х = (98 . 50)/200,5 = 24,44 г.
Находим массу H2SO4 из пропорции:
200,5 : (2 . 98) = 50 : х; х = (2 . 98 . 50)/200,5 = 48,88 г.
Ответ: 48,88 г; 24,44 г. Ртуть стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на ртуть. Следовательно, для растворения ртути нужно взять концентрированную серную кислоту.
Задача 869.
Одинаковое ли количество серной кислоты потребуется для растворения 40 г никеля, если в одном случае взять концентрированную кислоту, а в другом разбавленную? Какая масса серной кислоты пойдет на окисление никеля в каждом случае?
Решение:
Уравнения реакций:
Рассчитаем массу концентрированной серной кислоты идущую на окисление 40 г никеля из пропорции:
58,7 : (2 . 98) = 40 : х; х = (2 . 98 . 40)/58,7 = 133,56, г.
Теперь рассчитаем массу разбавленной серной кислоты идущую на окисление 40 г никеля из пропорции:
58,7 : 98 = 40 : х; х = (98 . 40)/58,7 = 66,78 г.
Ответ: 133,56 г; 66,78 г. На окисление никеля расходуется одинаковое количество серной кислоты.
http://ru1.warbletoncouncil.org/sulfato-de-sodio-11844
http://buzani.ru/zadachi/khimiya-glinka/1283-tiosulfat-natriya-sernaya-kislota-zadachi-866-869