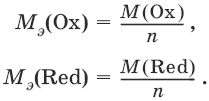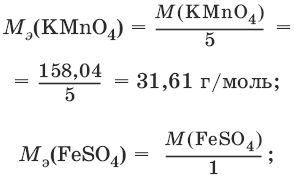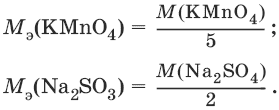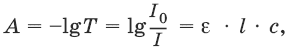Вычисление молярных масс эквивалентов окислителей и восстановителей
При вычисления молярных масс эквивалентов окислителей и восстановителей исходят из числа электронов, которые присоединяет или отдает в данной реакции молекула вещества. Для нахождения молярной массы эквивалента окислителя (восстановителя) нужно его молярную массу разделить на число принятых (отданных) электронов в данной полуреакции.
Например, в реакции окисления сульфата железа(II) перманганатом калия в кислой среде:
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
1 | MnO4¯ + 8Н+ + 5ē → Mn2+ + 4H2O
ион MnO4¯ как окислитель принимает пять электронов, а ион Fe2+ как восстановитель отдает один электрон. Поэтому для расчета молярных масс эквивалентов окислителя и восстановителя их молярные массы следует разделить на пять и на один соответственно.
M3(Fe2+) = M(Fe2+) = 55,85 г/моль.
В реакции окисления сульфита натрия перманганатом калия в нейтральной среде:
2KMnO4 + 3Na2SO3 + Н2O → 2MnO2 + 3Na2SO4 + 2KOH
2 | MnO4¯ + 2Н2O + Зē → MnO2 + 4OH¯
3 | SO32- + 2OH¯ + 2ē → SO42- + Н2O
ион MnO4¯ принимает только три электрона, а ион восстановителя SO32- отдает два электрона, следовательно:
Молярные массы эквивалентов окислителей и восстановителей зависят от условий проведения реакций и определяются, исходя из соответствующих полуреакций.
Фотоколориметрия
Фотоколориметрия – оптический метод анализа, который рассматривает взаимодействие вещества с электромагнитным излучением в видимой области: длина волны (λ) 380–750 нм; волновое число (v) 2,5 104 – 1,5 • 104 см-1; энергия излучения (Е) 1—10 эВ.
Поглощенное световое излучение количественно описывается законом Бугера–Ламберта-Бера:
где А – поглощение вещества, или его оптическая плотность; Т – пропускание образца, т. е. отношение интенсивности света, прошедшего через образец, к интенсивности падающего света, I/I0; с – концентрация вещества (обычно моль/л); l – толщина кюветы (см); ε – молярная поглощательная способность вещества или молярный коэффициент поглощения [л/(моль см)].
Расчет молярного коэффициента поглощения проводят по формуле:
Молярная масса окислителя в уравнении
РАСЧЕТ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССАХ
Ранее мы уже говорили о том, что в ОВР эквивалентное число z равно числу электронов, которое принимает одна формульная единица окислителя или отдает одна формульная единица восстановителя:
Пример 3: Укажите число электронов в окислительных и восстановительных процессах и рассчитайте молярную массу эквивалента окислителя и восстановителя:
Решение : а) Число электронов, участвующих в процессе, можно найти по разности зарядов левой и правой части уравнения. В нашем случае число электронов равно n ( ē ) = 5 – (–3) = 8, и уравнение восстановления азота имеет вид: N +5 + 8 ē = N –3 .
Окислителем является азот N , его молярная масса равна М( N ) = 14 г/моль. Эквивалентное число равно числу электронов z ( N ) = 8. Таким образом, молярная масса эквивалента азота в данном процессе составляет:
М(1/8 N ) = 

б) Число электронов, участвующих в процессе, равно n ( ē ) = 0 – 2 = –2 (полученный знак “–“ говорит о том, что в данном процессе идет отдача электронов):
H 2 S – 2 ē = S + 2 H + .
Восстановителем является соединение H 2 S . Его молярная масса равна М( H 2 S ) = 34 г/моль, эквивалентное число равно z ( H 2 S ) = 2. Таким образом, молярная масса эквивалента восстановителя H 2 S составляет:
М(1/2 H 2 S ) = 

Ответ : а) 8 электронов, 1.8 г/моль; б) 2 электрона, 17 г/моль.
Пример 4 : Рассчитайте молярные объемы (н.у.) эквивалента а) водорода Н2, участвующего в процесс 2Н + + 2 ē = Н2; б) кислорода О2, участвующего в процесс 2Н 2 О + О2 + 4 ē = 4ОН – .
Решение: а) В процессе 2Н + + 2 ē = Н2 водород является окислителем и принимает два электрона, следовательно, его эквивалентное число равно z ( H 2 )=2. По закону Авогадро, как указано выше, молярный объем газа при нормальных условиях равен 22.4 л/моль. Для расчета молярного объема эквивалента водорода используем формулу (2):
V (1/2Н2) =

б) В процессе 2Н2О + О2 + 4 ē = 4ОН – кислород является окислителем и принимает четыре электрона. Следовательно, его эквивалентное число равно z (О2)=4.
Молярный объем эквивалента кислорода равен:
V (1/4О2) =

Ответ : а) 11,2 л/моль; б) 5,6 л/моль.
Молярные объемы эквивалентов водорода и кислорода часто используются для решения задач по закону эквивалентов.
V (1/2Н2) = 
V (1/4О2) = 
Молярная масса окислителя в уравнении
Определение эквивалента и молярной массы эквивалента окислителей и восстановителей.
Эквивалент окислителя или восстановителя – реальная или условная частица вещества, соответствующая одному электрону в данной полуреакции окисления-восстановления. Фактор эквивалентности частиц (молекул, ионов, атомов), участвующих в окислительно-восстановительных реакциях FЭкв=1/n, где n – число принятых или отданных электронов. Молярная масса эквивалента окислителя или восстановителя (Мэ) равна молярной массе, умноженной на фактор эквивалентности:
Мэ = FЭкв · М = М/n
Пример 1. Определить Мэ окислителя и восстановителя в реакции:
5HAsO2 + 2MnO4- + 6H+ + 2H2O ® 5H3AsO4 + 2Mn2+
Полуреакция восстановления. MnO4- + 8H+ + 5e — ® Mn2+ + 4H2O
Мэ = М(


Полуреакция окисления. HAsO2 + 2H2O – 2 e- ® H3AsO4 + 2H+
Мэ = М(


Пример 2. Вычислить Мэ свинца при йодометрическом определении его по схеме:
Pb2+ + CrO42- ® PbCrO4¯ (1)
2PbCrO4 + 2H+ ® 2Pb2+ + Cr2O72- + H2O (2)
Cr2O72- + 6I — + 14H+ ® 3I2 + 2Cr3+ + 7H2O (3)
I2 + 2S2O32- ® 2I — + S4O62- (4)
Решение . Реакции (1) и (2) не окислительно-восстановительные, а (3) и (4) – окислительно-восстановительные. В реакции (2) одной молекуле хромата свинца (PbCrO4) эквивалентна условная частица 
Т. к. Cr2O72- + 14H+ + 6e- ® 2Cr3+ + 7H2O; ® Мэ = 
Следовательно, Мэ(Pb) = 

Пример 3. Определить Мэ алюминия при броматометрическом определении его по схеме:
Al3+ + 3C9H6NOH ® Al(C9H6NO)3¯ + 3H+ (1)
Al(C9H6NO)3 + 3H+ ® 3C9H6NOH + Al3+ (2)
BrO3- + 5Br — + 6H+ ® 3Br2 + 3H2O (3)
C9H6NOH + 3Br2 ® C9H4Br2NOH + 2H+ + 2Br — (4)
Решение. Из уравнения (4) следует, что с одной молекулой оксихинолина реагирует две молекулы брома, т. е. в реакции участвует 4 электрона (2Br2+4e- ® 4Br — ). На один катион алюминия (уравнение 1) приходится три молекулы оксихинолина, следовательно, на одну молекулу оксихинолята алюминия приходится 3·4 = 12 электронов, т. е. FЭкв (Al) = 
Мэ(Al) = 

Пример 4. Определить количество вещества эквивалентов (nэ) щавелевой кислоты (H2C2O4 · 2H2O), содержащегося в 1,8908 г этого вещества, используемого в перманганатометрии.
Решение. При взаимодействии щавелевой кислоты с перманганатом калия протекает реакция: C2O42— 2e- ® 2CO2.
® Мэ (H2C2O4 · 2H2O) = 

Nэ (H2C2O4 · 2H2O) = 
http://www.chem-astu.ru/chair/study/equivalent/5_Equiv-Mass-Redox.shtml
http://po-teme.com.ua/khimiya/okislitelno-vosstanovitelnoe-titrovanie/1138-opredelenie-ekvivalenta-i-molyarnoj-massy-ekvivalenta-okislitelej-i-vosstanovitelej.html