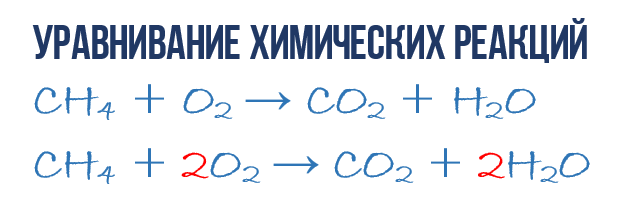Урок химии в 8-м классе по теме «Химические уравнения»
Разделы: Химия
Цель: научить учащихся составлять химические уравнения. Научить их уравнивать с помощью коэффициентов на основе знания закона сохранения массы вещества М.В. Ломоносова.
Задачи:
- Образовательные:
- продолжить изучение физических и химических явлений с введением понятия «химическая реакция»,
- ввести понятие «химическое уравнение»;
- научить учащихся составлять химические уравнения, уравнивать уравнения с помощью коэффициентов.
- Развивающие:
- продолжить развивать творческий потенциал личности учащихся через создание ситуации проблемного обучения, наблюдения, проведения опытов химических реакций.
- Воспитательная:
- воспитать умение работать в команде, группе.
Оборудование: табличный материал, справочники, алгоритмы, набор заданий.
Д/О: «Горение бенгальских огней»:, спички, сухое горючее, железный лист/ ТБ при работе с огнём.
I. Организационный момент
Определение цели урока.
II. Повторение
1) На доске набор физических и химических явлений: испарение воды; фильтрование; ржавление; горение дров; скисание молока; таяние льда; извержение вулкана; растворение сахара в воде.
Задание:
Дать пояснение каждому явлению, назвать практическое применение данного явления в жизни человека.
На доске нарисована капля воды. Создать полную схему превращения воды из одного агрегатного состояния в другое. Как называется данное явление в природе и каково его значение в жизни нашей планеты и всего живого?
III. Д/О «Горение бенгальских огней»
1. Что происходит с магнием, который составляет основу бенгальского огня ?
2. Что явилось основной причиной такого явления?
3. К какому типу относится данная химическая реакция?
4. Попробуйте схематично изобразить химическую реакцию, которую вы наблюдали в этом опыте.
– Предлагаю попробовать составить схему данной реакции:
– Как мы узнали, что получилось другое вещество? (По признакам химической реакции: изменение окраски, появление запаха.)
– Какой газ находится в воздухе, который поддерживает горение? (Кислород – О)
IV. Новый материал
Химическую реакцию можно записывать с помощью химического уравнения.
Можно вспомнить понятия «уравнение», которое дается в математике. В чем суть самого уравнения? Что-то уравнивают, какие-то части.
Попробуем дать определение «химического уравнения», можно смотреть на схему и попытаться дать определение:
Химическое уравнение – это условная запись химической реакции с помощь химических знаков, формул и коэффициентов.
Химические уравнения записываются на основе Закона сохранения массы вещества, открытого М.В.Ломоносовым в 1756 году, который гласит (учебник стр. 96): «Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате её».
– Надо научиться уравнивать химические уравнения с помощью коэффициентов.
– Для того чтобы хорошо научиться составлять химические уравнения, нам необходимо вспомнить:
– Что такое коэффициент?
– Что такое индекс?
Не забываем алгоритм «Составление химических формул».
Предлагаю пошаговый алгоритм составления химического уравнения:
V. Составления химического уравнения
1. Записываю в левой части уравнение вступающие в реакцию вещества: Al + O2
2. Ставлю знак «=» и записываю образующиеся вещества в правой части уравнения – продукты реакции: Al + O2 = Al2O3
3. Уравнивать начинаю с того химического элемента, которого больше или с кислорода, затем составляю конструкцию:
вступило кислорода «2», а получилось «3», их число не равно.
4. Ищу НОК (наименьшее общее кратное) двух цифр «2» и «3» – это «6»
5. Делю НОК «6» на число «2» и «3»и выставляю в качестве коэффициентов перед формулами.
6. Начинаю уравнивать следующие химические элементы – Al, рассуждаю так же. Вступило Al «1», а получилось «4», ищу НОК
Коэффициент «1» в уравнениях не пишется, но учитывается при составлении уравнения.
7. Читаю всю запись химического уравнения.
Такое долгое рассуждение позволяет быстро научиться уравнивать в химических уравнениях, учитывая, что правильное составление уравнений реакций для химии имеет большое значение: решение задач, написание химических реакций.
VI. Задание на закрепление
Фосфор + кислород = оксид фосфора (V)
Серная кислота + алюминий = сульфат алюминия + водород
Вода = водород + кислород
– Работает на доске один сильный ученик.
– Расставить коэффициенты в уравнениях химических реакций.
Химические уравнения отличаются по типам, но это мы рассмотрим на следующем уроке.
VII. Подведение итогов урока
Вывод. Выставление оценок.
VIII. Домашнее задание: § 27, упр. 2, с. 100.
Дополнительный материал: Р.т.с. 90-91, упражнение 2 – индивидуально.
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Электронный образовательный ресурс конспект урока по химии «Химические уравнения. Составление химических уравнений»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Тема: Химические уравнения. Составление химических уравнений
Цель урока: Изучить понятие химических реакций, и их классификацию.
Образовательные : познакомить с составлением химических уравнений и расставлением коэффициентов с законом сохранения массы веществ; сформировать у учащихся знание о химическом уравнении, о правиле подбора коэффициентов в уравнениях реакций, о законе сохранения массы веществ; начать формировать умения по составлению химических уравнений и раставлению коэффициентов.
Воспитательные : продолжить формирование естественнонаучного мировоззрения, представления о единичном и целом при знакомстве с химическими уравнениями.
Развивающие : продолжить формирования умения наблюдать, анализировать, объяснять, делать выводы.
Тип урока: урок изучения нового материала и закрепления полученных знаний.
Методы: словесные (объяснение и рассказ учителя ), словесно – наглядные(объяснение с использованием записей на классной доске).
Формы обучения: групповая.
Основные этапы и их содержание
Методы и приёмы
Приветствие, проверка рабочего места, проверка
Постановка задач урока
Актуализация знаний и умений
Тест по теме «Физические и химические явления. Закон сохранения массы веществ»
3. Изучение нового материала по плану:
Закон сохранения массы вещества;
Понятия «химическое уравнение», «индекс», «коэффициент»;
Правила составления уравнения;
Фро нтальная работа
Запись уравнений на доск
3. Закрепление изученного материала
Работа с учебником
Подведение итогов урока.
— Характеристика работы класса
§ 27, упр. 3 на стр. 145 (письменно).
Приветствие, проверка рабочего места.
Постановка задач урока.
Дежурный называет отсутствующих
Актуализация знаний и умений
Мы с вами познакомились с физическими и химическими явлениями, химическими реакциями и признаками их протекания. Изучили закон сохранения массы веществ.
Давайте проверим ваши знания. Откройте рабочие тетради и выполните задание 1. На выполнение задания вам дается 5 минут.
«Физические и химические явления. Закон сохранения массы веществ»
1 . Чем химические реакции отличаются от физических явлений?
Изменение формы, агрегатного состояния вещества
Образование новых веществ
2. Каковы признаки химической реакции?
Образование осадка, изменение цвета, выделение газа
Намагничивание, испарение, колебание
Рост и развитие, движение, размножение
3. В соответствии с каким законом составляются уравнения химических реакций?
Закон постоянства состава вещества
Закон сохранения массы вещества
Закон всемирного тяготения
4.Закон сохранения массы вещества открыл
5.Химическим уравнением называют
Условную запись химической реакции
Условную запись состава вещества
Запись условия химической задачи
Вы выполнили работу. Я предлагаю вам осуществить ее проверку. Поменяйтесь тетрадями и осуществите взаимопроверку. Внимание на экран. За каждый правильный ответ – 1 балл. Общее количество баллов занесите в рабочий лист.
Тема урока «Химические уравнения. Составление химических уравнений».
Вещества вступают в химические реакции, в результате которых образуется другие вещества. Происходят ли какие – либо изменения с массой вещества в результате реакции?
По этому вопросу ученые высказывали различные предположения. В 1756 г., М.В. Ломоносов открывает закон сохранения массы веществ.
Закон сохранения массы веществ: масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате ее.
Поскольку при химических реакциях атомы не образуются и не разрушаются, а происходит лишь их перегруппировка, то становится очевидным справедливость открытого закона М.В.Ломоносовым.
Откройте учебники на стр.139 – 141 (учитель просит учащихся почитать).
На основании этого закона пишут химические уравнения реакций с помощью химических формул.
Химическим уравнением называют условную запись химической реакции с помощью химических формул и математических знаков.
По химическому уравнению реакций можно судить о том, какие вещества вступают в реакцию и какие образуются. При составлении уравнений реакций поступают следующим образом:
В левой части уравнения пишут формулы веществ, вступающих в реакцию, а затем ставят стрелку. При этом нужно помнить, что молекулы простых газообразных веществ почти всегда состоят из двух атомов (O2, H2,Cl2 и т. д.):
2. В правой части (после стрелки) пишут формулы веществ, образующихся в результате реакции:
3. Уравнения реакции составляют на основе закона сохранения массы веществ, т. е. слева и справа должно быть одинаковое число атомов. Это достигается расстановкой коэффициентов перед формулами веществ.
Запишем уравнение химической реакции:
C2H6 + O2 → CO2 + H2O
Уравняем число атомов углерода и водорода:
C2H6 + O2 → 2CO2 + 3H2O
Теперь в правой части уравнения реакции 7 атомов кислорода, а в левой только 2. Уравняем число атомов кислорода, записав перед формулой O2 коэффициент 3,5 (7:2 = 3,5):
C2H6 + 3,5O2 = 2CO2 + 3H2O
И наконец, перепишем полученное уравнение реакции, удвоив коэффициенты перед формулами всех участников реакции:
2C2H6 + 7O2 = 4CO2 + 6H2O
Уравнение уравнено, теперь можно поставить замес-то стрелки знак равно.
Для раставления коэффициентов нужно помнить следующие правила:
Перед формулой простого вещества можно записывать дробный коэффициент, который показывает количество вещества реагирующих и образующихся веществ.
Если в схеме реакции есть формула соли, то вначале уравнивают число ионов, образующих соль.
Если участвующие в реакции вещества содержат водород и кислород, то атомы водорода уравнивают в предпоследнюю очередь, а атомы кислорода в последнюю.
Если в схеме реакции имеется несколько формул солей, то необходимо начинать уравнение с ионов, входящих в состав соли, содержащей большее их число.
Записывают в тетрадях. Число и тему урока «Химические уравнения. Составление химических уравнений».
http://himi4ka.ru/arhiv-urokov/urok-13-sostavlenie-himicheskih-uravnenij.html
http://infourok.ru/elektronniy-obrazovatelniy-resurs-konspekt-uroka-po-himii-himicheskie-uravneniya-sostavlenie-himicheskih-uravneniy-3446223.html