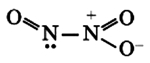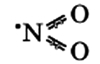Оксид азота II: получение и химические свойства
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (II)
Оксид азота (II) NO – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например , при действии 30 %-ной азотной кислоты на медь образуется NO:
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
FeCl2 + NaNO3 + 2HCl → FeCl3 + NaCl + NO + H2O
2HNO3 + 2HI → 2NO + I2 + 2H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака :
Химические свойства
1. Оксид азота (II) легко окисляется под действием окислителей .
Например , горит в атмосфере кислорода:
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
2. В присутствии более сильных восстановителей проявляет свойства окислителя . В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например , оксид азота (II) окисляет водород и сернистый газ:
3. Как несолеобразующий оксид, при обычных условиях с основаниями, основными оксидами, амфотерными оксидами, кислотными оксидами, кислотами и амфотерными гидроксидами оксид азота (II) не реагирует:
Составьте уравнения и укажите тип химических реакций, протекающих по схеме : N2 + O2 = N2O3, HgO = ?
Химия | 10 — 11 классы
Составьте уравнения и укажите тип химических реакций, протекающих по схеме : N2 + O2 = N2O3, HgO = .
, ZnO + H2 = Zn + H2O, CuS + O2 = SO2.
1) востановительно — окислительная (N2)
На основании приведенных схем составьте уравнения химических реакций и укажите их тип ?
На основании приведенных схем составьте уравнения химических реакций и укажите их тип :
Приведены схемы реакций?
Приведены схемы реакций.
Составьте уравнения химических реакций и укажите их тип : HCl →ZnCl2 → Zn(OH)2→ Zn(NO3)2.
Составьте уравнение окислительно — восстановительной реакции протекающей по схеме : C + NHO3 — CO2 + NO + H2O?
Составьте уравнение окислительно — восстановительной реакции протекающей по схеме : C + NHO3 — CO2 + NO + H2O.
Составить химическое уровнение и укозать тип химической реакции, протекающей по схеме : б) HgO — ?
Составить химическое уровнение и укозать тип химической реакции, протекающей по схеме : б) HgO — .
+ . ; в)ZnO + H2 — Zn + H2O : г)CuS + O2 — CuO + SO2.
Методом электронного баланса составьте уравнение реакции, протекающей по схеме : Sb2S3 + HNO3 + H2O → H3SbO4 + H2SO3 + NO?
Методом электронного баланса составьте уравнение реакции, протекающей по схеме : Sb2S3 + HNO3 + H2O → H3SbO4 + H2SO3 + NO.
2. Закончите уравнения реакции , укажите тип 3?
2. Закончите уравнения реакции , укажите тип 3.
Запишите уравнения реакции , протекающих согласно схеме 4.
Укажите тип какой реакции 5.
Укажите тип каждой реакции.
Составьте уравнения химических реакции и укажите их тип ?
Составьте уравнения химических реакции и укажите их тип :
Составьте уравнение и укажите тип химических реакций, протекающих по схеме :а)Al + O2 →t Al2O3 ;б)H2O2 →MnO2 ?
Составьте уравнение и укажите тип химических реакций, протекающих по схеме :
а)Al + O2 →t Al2O3 ;
в)ZnO + C →t Zn + CO ;
г)CH4 + O2 →t CO2 + H2O.
Составить уравнение и указать тип химической реакции под буквой а) над стрелочкой значок t ?
Составить уравнение и указать тип химической реакции под буквой а) над стрелочкой значок t .
Под буквой б) тоже значок t .
Под буквой в) тоже .
+ . в)ZnO + H2 — >Zn + H2O
г)CuS + O2 — >CuO + SO2.
1. запишите три уравнения реакций сочетания с участием кислорода?
1. запишите три уравнения реакций сочетания с участием кислорода!
2. составьте уравнения реакций по следующей схеме : HgO = = = > O2 = = = > Zno !
На этой странице сайта вы найдете ответы на вопрос Составьте уравнения и укажите тип химических реакций, протекающих по схеме : N2 + O2 = N2O3, HgO = ?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 10 — 11 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
Калий отдает электроны.
1) Mg + H2SO4 = MgSO4 + H2 2) MgSO4 + Ba(NO3)2 = BaSO4 + Mg(NO3)2 3) Mg(NO3)2 + Na2CO3 = MgCO3 + 2NaNO3.
Вкратце : 1 реакция : получение метана из простых веществ 2реакция : пиролиз т. Е. нагрев до высокой температуры, а именно до 1500° 3 реакция : тримеризация, для получения бензола. 4 реакция : восстановление бензола, получается циклогексен 5реакция..
S + O2 + t = >SO2 SO2 + O3 + t = >SO3 SO3 + H2O = >H2SO4 BaO + H2SO4 = >BaSO4 + H2O Уравнивать лень.
N2 — простое вещество 2N2 + 5O2 = 2N2O5 оксид 2N2O5 + H2O = 2HNO3 азотная кислота.
Первая реакция это окисление первичной гидроксогруппы в альдегид, а так как есть вода, то через промежуточный геминальный диол получаем карбоксильную группу. Обобщенная схема представлена на рисунке 1. Β — кетокислота, как и все β — кетокислоты, не..
Скорей всего был оксид углерода 2, ибо : 1. C + 4Na = Na₄C 2. C + 2H₂ = CH₄ 3. C + CO₂ = 2CO C + CO≠ 4. C + 2H₂SO₄ = 2SO₂ + CO₂ + 2H₂O.
Масса атома — это масса ядра + масса всех электронов. Её можно найти как отношение молярной массы к числу Авогадро. Относительной атомной массой (Аг) называется масса одного атома, выраженная в атомных единицах массы (а. Е. м. ) . Относительная а..
Оксиды азота
Азот образует несколько оксидов:
- солеобразующие оксиды:
- N2O3 — оксид азота (III)
- NO2 — оксид азота (IV)
- N2O4 — димер оксида азота (IV)
- N2O5 — оксид азота (V)
- несолеобразующие оксиды:
- N2O — оксид азота (I)
- NO — оксид азота (II)
Все оксиды азота, за исключением N2O, являются ядовитыми веществами.
Оксид азота N2O (I)
Строение молекулы линейное:
N2O (I) — бесцветный газ со слабым запахом и сладковатым вкусом.
- растворяется в воде, но не реагирует с ней;
- разлагается при слабом нагревании:
2N2O → 2N2+O2 - реагирует с водородом со взрывом:
N2O+H2 → N2+H2O - получают разложением нитрата аммония:
NH4NO3 → N2O+2H2O - применяют в смеси с кислородом в качестве «веселящего газа», как средство общего наркоза в медицине, а также для получения азидов:
N2O+NaNH2 → NaN3+H2O
Оксид азота NO(II)
Молекула имеет вид:
Оксид азота NO(II) димеризуется (образуется новое вещество путём соединения двух структурных элементов) только при низких температурах.
- Бесцветный газ, без запаха.
- Малорастворим в воде.
- Легко окисляется на воздухе с образованием диоксида азота:
2NO+O2=2NO2. - Взаимодействует с другими окислителями (CrO3,Cl2, KMnO4).
- Реагирует с активными металлами, водородом:
K+NO=KNO
2NO+2H2=N2+2H2O
NO(II) содержится в выхлопных газах автомобилей с двигателями внутреннего сгорания — проходя через каталитический конвертор, состоящий из нагретых до высокой температуры керамических ячеек, оксиды азота восстанавливаются, а СО окисляется:
2NO+2CO → N2+2CO2
В природе NO(II) образуется во время грозы в результате взаимодействия азота с кислородом при высокой температуре:
N2+O2=2NO.
В промышленных целях NO(II) получают каталитическим окислением аммиака (в роли катализатора используется платина):
4N -3 H3+5O2 0 → 4N +2 O -2 +6H2O
В лабораторных условиях NO(II)получают действием разбавленной азотной кислотой на медь:
3Cu 0 +8HN +5 O3 = 3Cu +2 (NO3)2+2N -2 O↑+4H2O
Монооксид азота используют для получения азотной кислоты.
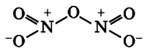
Оксид азота N2O3(III)
Связь N + -O — образована по донорно-акцепторному механизму.
Оксид азота N2O3(III) при н.у. является темно-синей жидкостью. При низких температурах (ниже -100°C) кристаллизуется.
Оксид азота N2O3(III) является кислотным оксидом, в значительной степени диссоциирует и реагирует со щелочами:
N2O3 ↔ NO2+NO
N2O3+2NaOH = 2NaNO2+H2O
Оксид азота N2O3(III) взаимодействует с водой с образованием азотистой кислоты:
N2O3+H2O = 2HNO2
Азотистая кислота является слабой кислотой, и существует только в водном растворе.
Соли азотистой кислоты — нитриты NaNO2, KNO2 являются устойчивыми соединениями, проявляя, как кислотные, так и восстановительные свойства, поскольку атом азота в них имеет «среднее» значение степени окисления (+3).
Оксид азота NO2(IV)
Связи N-O располагаются под углом друг к другу, при этом они носят промежуточный «полуторный» характер, при этом имеется еще и один неспаренный электрон, как и у NO (см. выше).
При н.у. оксид азота NO2(IV) является ядовитым газом (хорошо растворимым в воде) бурого цвета, с характерным запахом.
Оксид азота NO2(IV) — смешанный оксид, ему соответствуют две кислоты: азотистая и азотная, поэтому, реакция взаимодействия с водой имеет следующий вид:
2N +4 O2+H2O = HN +3 O2+HN +5 O3
При нагревании до 50°C неустойчивая азотистая кислота не образуется:
3NO2+H2O = 2HNO3+NO
На воздухе NO2 взаимодействует с водой с образованием только азотной кислоты:
4N +4 O2+O2 0 +2H2O ↔ 4HN +5 O3 -2
Оксид азота NO2(IV) взаимодействует с растворами щелочей с образованием воды и двух солей — нитрата и нитрита:
2N +4 O2+2NaOH = NaN +3 O2+NaN +5 O3+H2O
В избытке кислорода образуется только нитрат натрия:
4N +4 O2+4NaOH+O2 0 = 4NaN +5 O3 -2 +2H2O
При температуре ниже 22°C молекулы оксида азота NO2(IV) легко соединяются попарно (димеризуются), в результате чего образуется бесцветная жидкость, превращающаяся в кристаллы при дальнейшем охлаждении до температуры ниже -10,2°C.
В промышленных условиях оксид азота NO2(IV) получают путем окисления NO кислородом:
2NO+O2=2NO2
В лабораторных условиях оксид азота NO2(IV) получают окислением меди азотной кислотой (концентрированной), либо разложением нитрата свинца (меди):
Cu+4HNO3(конц) = Cu(NO3)2+2NO2↑+2H2O
2Pb(NO3)2 = 2PbO+4NO2↑+O2↑
Оксид азота NO2(IV) применяют в производстве азотной кислоты.
Оксид азота N2O5(V)
Связи N + -O — образуются по донорно-акцепторному механизму: атом азота отдает электрон, играя роль донора и приобретая положительный заряд, атом кислорода присоединяет электрон, выступая в роли акцептора и приобретая отрицательный заряд. Атомы азота проявляют степень окисления +5 (валентность 4).
Оксид азота N2O5(V) (азотный ангидрид, пентаоксид диазота) является кристаллическим веществом белого цвета, легко разлагающееся при нормальных условиях:
2N2O5 = 4NO2+O2
Оксид азота N2O5(V) является кислотным оксидом, который при растворении в воде образует азотную кислоту:
N2O5+H2O = 2HNO3
Оксиды азота N2O3 и N2O5 практического применения не имеют.
Другие соединения азота:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://himia.my-dict.ru/q/999223_sostavte-uravnenia-i-ukazite-tip-himiceskih/
http://prosto-o-slognom.ru/chimia/504_oksid_azota_NO.html