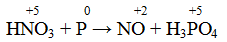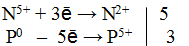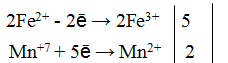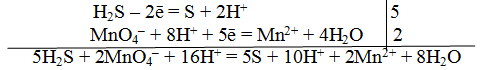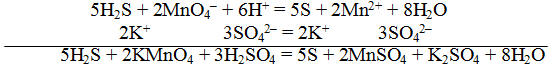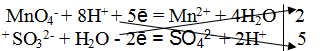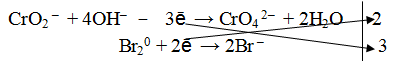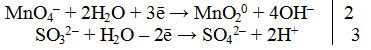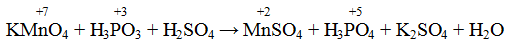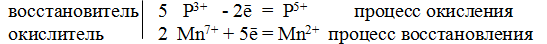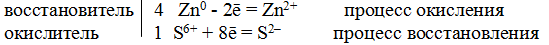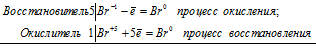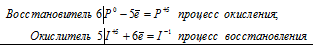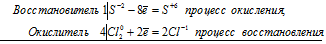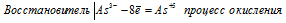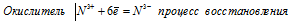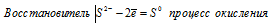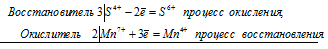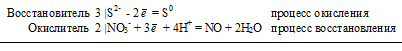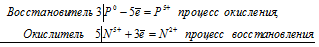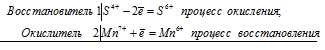Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6dfe3a19fbf40056 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составление уравнений окислительно-восстановительных реакций
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Составление уравнений окислительно-восстановительных реакций.
Для составления уравнений окислительно-восстановительных реакций и определения коэффициентов применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
Метод электронного баланса является более простым и учитывает изменение степени окисления элементов в реакциях. Ионно-электронный метод учитывает характер химической связи в молекуле и наличие тех ионов, которые в действительности существуют в растворе, например, MnO4 – , SO4 2- , Cr2O7 2- . При реакциях окисления-восстановления электроны не берутся откуда-то со стороны, а только переходят от одних атомов или ионов к другим, поэтому число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. При составлении уравнений окислительно-восстановительных реакций для того, чтобы правильно написать продукты реакции, необходимо знать свойства реагирующих веществ.
8.3.1.Метод электронного баланса.
Подбор коэффициентов в реакции методом электронного баланса осуществляется по следующей схеме:
1) Составить схему реакции
Разбавленная азотная кислота с а) неактивными металлами (Cu), б) неметаллами (P, As, S) и в) производными этих неметаллов (AsH3, PH3, As2S3) образует оксид азота (II), понижая свою степень окисления:
Атом элемента в своей высшей положительной степени окисления является окислителем, следовательно, окислитель
Атом фосфора проявляет восстановительные свойства в данной реакции, отдавая электроны с последнего энергетического уровня и повышая свою степень окисления до +5.
Следовательно, молекулярное уравнение реакции имеет следующий вид:
2) Определить величину и знак степени окисления элементов до реакции и после реакции.
3) Составить электронный баланс
4) Подставить найденные коэффициенты в уравнение реакции.
5) Подсчитать количество атомов водорода в правой и левой части равенства и уравнять их за счет добавления молекул воды в ту часть равенства, где их недостаточно.
6) Подсчитать количество атомов кислорода.
При правильно написанном и решенном уравнении количество атомов кислорода в правой и левой части равенства совпадает.
Пример 1. Написать уравнение окислительно-восстановительной реакции, подобрав коэффициенты к нему: FeSO4 + KMnO4 + H2SO4→ Fe2(SO4)3 + + MnSO4 + K2SO4 + H2O. Определяем степень окисления элементов до реакции и после реакции.
Составляем уравнения электронного баланса
Подставляем найденные коэффициенты в уравнение реакции. Подсчитываем количество групп в правой части уравнения (15+2+1=18), добавляем в левую часть равенства недостающие -группы в виде коэффициента при H2SO4. уравниваем число атомов водорода в правой и левой части равенства.
Правильность написанного уравнения проверяем по числу атомов кислорода в правой и левой части равенства.
8.3.2. Ионно-электронный метод.
При составлении электронно-ионных уравнений следует исходить не из изменения степени окисления элементов в реагирующих веществах, а нужно учитывать действительно существующие ионы в водном растворе с точки зрения теории электролитической диссоциации. Например, если реакция происходит с участием перманганата калия, то в реакции окислителем будут ионы MnO4 – , а не ионы Mn 7+ , так как перманганат калия в водном растворе диссоциирует KMnO4↔K + +MnO4 – . При этом вещества неионного характера и недиссоциирующие изображаются в электронных уравнениях в виде молекул: NH3, CO, NO2, SiO2, P.
В окислительно-восстановительных реакциях могут получаться различные продукты реакции в зависимости от характера среды – кислой, щелочной, нейтральной. Для таких реакций в молекулярной схеме необходимо указывать окислитель, восстановитель и вещество, характеризующее реакцию среды (кислоту, щелочь, воду). В этом случае в ионном уравнении необходимо руководствоваться правилами стяжения, указывать ионы, характеризующие реакцию среды: H + , OH – , H2O. Правила стяжения сводятся к следующему:
1. В кислой среде избыток ионов O +2 образует с ионами H + молекулы воды:
2. В нейтральной или щелочной среде избыток ионов O 2- образует с молекулами воды гидроксид – ионы:
3. В щелочной среде недостаток ионов O 2– компенсируется двумя ионами OH – , одновременно образуется одна молекула воды:
| Реакция среды | Избыток ионов О 2– | Недостаток ионов О 2– |
| окислитель | восстановитель | |
| Кислая | Н + Н2О | Н2O 2Н + |
| изб. O 2– + 2H + = Н2О | Н2О 2Н + + O 2– | |
| Нейтральная | H2O OH – | Н2O 2Н + |
| изб. О 2– + Н2О 2OН – | Н2О 2Н + + О 2– | |
| Щелочная | Н2O ОН – | 2OН – Н2О |
| изб. О 2– + Н2O 2OН – | 2OН – Н2О + О 2– |
Разберем на конкретных примерах.
Пример 1. Составить уравнение реакции, которая протекает при пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементарной серы из сероводорода:
В этой схеме число атомов одинаково в левой и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства:
Эта первая полуреакция — процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона МnО – 4 (он имеет малиновую окраску) в ион Mn 2+ (почти бесцветный и лишь при большой концентрации имеет розоватую окраску), что можно выразить схемой
Опыт показывает, что в кислом растворе кислород, входящий в состав ионов MnO – 4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные – два положительных (2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO – 4 + 8H + +5e – = Mn 2+ +4H2О
Это вторая полуреакция – процесс восстановления окислителя – иона MnO – 4.
Для составления общего (суммарного) уравнения реакции надо уравнение полуреакций почленно суммировать, предварительно уравнять число отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно запись проводится так:
Сократив на 10 Н + , окончательно получим
Проверяем правильность составленного ионного уравнения. В примере число атомов кислорода в левой части 8, в правой 8; число зарядов в левой части (2-) + (6+) == 4+, в правой 2(2+) = 4+. Уравнение составлено правильно.
Методом полуреакций составляется ионное уравнение реакции. Чтобы от ионного уравнения перейти к молекулярному, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону — анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы:
Пример 2. Реакция среды кислая
1. Составить схему реакции
Из опытных данных знаем, что окислителем является КМnO4. Ион MnO4 – восстанавливается в кислой среде до Мn 2+ (фиолетово-малиновая окраска иона MnO4 – становится бесцветной, переходя в Мn 2+ – ион), следовательно, ион SO3 2 – будет являться восстановителем, переходя в ион SO4 2- .
2. Составить электронно-ионные уравнения
а) для окислителя
Из ионной схемы видно, что, ион MnO4 – – превращается в ион Мn 2+ , при этом освобождаются ионы О 2- , которые по правилу стяжения в кислой среде связываются ионами Н + , образуя молекулы Н2O.
б) для восстановителя
Из ионной схемы видно, что ион SO3 2- превращается в ион SO4 2- . Для этого превращения необходимо добавить ион О 2- , который берется из молекулы H2O (реакция протекает в водной среде), при этом освобождаются два иона Н+.
3. Подсчитать число зарядов в правой и левой части равенства, добавляя или уменьшая необходимое число электронов. Алгебраическая сумма зарядов в обеих частях равенства должна быть одинакова.
MnO4 – + 8H + + 5ē = Mn 2+ + 4H2O
4. Найти основные коэффициенты, т. е. коэффициенты при окислителе и восстановителе:
5. Написать суммарное электронно-ионное уравнение, учитывая найденные коэффициенты:
6. Сократить в левой и правой части уравнения 10 Н + и 5Н2O. Получается ионное уравнение:
7. По ионному уравнению составить молекулярное уравнение реакции:
8. Число ионов и атомов каждого элемента в правой и левой части равенства, должно быть равно.
Пример 3. Реакция среды щелочная.
1. Составить схему реакции
Окислителем в данной реакции является молекула брома, следовательно, восстановителем будет являться метахромит калия, а именно ион СrO2 – .
2. Составить электронно-ионное уравнение
а) для окислителя
б) для восстановителя
Из ионной схемы видно, что ион CrO2 – превращается в ион СгО4 2– . Каждый недостающий ион О 2– берется по правилу стяжения из двух гидроксильных ионов (среда щелочная ОН – ), при этом одновременно образуется одна молекула воды.
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4. Написать суммарное уравнение, учитывая найденные коэффициенты:
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левой части уравнения должно быть равно.
Пример 4. Реакция среды нейтральная.
1. Составить схему реакции
Окислителем является КМnO4, так как ион элемента в своей высшей степени окисления не способен более отдавать электроны (Мn +7 ). Восстановителем является сульфит калия K2SO3.
2. Составить электронно-ионное уравнение
а) для окислителя
В нейтральной среде избыток ионов кислорода стягивается с молекулами воды, образуя гидроксид-ионы.
б) для восстановителя
Из ионной схемы видно, что ион SО3 2- превращается в ион SO4 2- , для этого необходимо добавить один ион О 2- , который берется из молекулы Н2O (реакция протекает в водной среде). При этом освобождаются два иона Н + .
3. Подсчитать число зарядов в правой и левой части равенства. Найти коэффициенты при окислителе и восстановителе.
4.Написать электронно-ионное уравнение, учитывая найденные коэффициенты:
Сокращаем левую и правую часть равенства на 6Н20. Получаем окончательное ионное уравнение.
5. По ионному уравнению составить молекулярное уравнение реакции.
6. Число атомов и ионов каждого элемента в правой и левей части уравнения должно быть равно.
Пример 5. Исходя из степени окисления (п) азота, серы и марганца в соединениях NН3, HNO2, HNO3, H2S, Н2SO3, Н2SО4, MnO2 и КМnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n(S), соответственно, равна: -2 (низшая), +4 (промежуточная), +6 (высшая); n(Мn), соответственно, равна: + 4 (промежуточная), +7 (высшая). Отсюда: NН3, H2S — только восстановители; HNO3, H2SO4, КMnО4 — только окислители; НNО2, Н2SО3, MnO2 — окислители и восстановители.
Пример 6. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) H2S и HI; б) H2S и Н2SО3; в) Н2SО3 и НС1O4?
а) Степень окисления в Н2S n(S) = -2; в HI n(I) = -1. Так как и сера и иод находятся в своей низшей степени окисления, то оба вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут;
б) в H2S n(S) = -2 (низшая), в H2SO3 n(S) = +4 (промежуточная).
Следовательно, взаимодействие этих веществ возможно, причем, Н2SО3 является окислителем;
в) в Н2SO3 n(s) = +4 (промежуточная); в НС1O4 n(Сl) = +7 (высшая). Взятые вещества могут взаимодействовать, Н2SО3 в этом случае будет проявлять восстановительные свойства.
Пример 7. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме:
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид:
Пример 8. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительная функция принадлежит сере (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p-элемента VIA-группы равна -2. Цинк как металл IIВ-группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
Составляем уравнение реакции:
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы H2SO4 идут на связывание четырех ионов Zn 2+ .
Составление уравнений окислительно-восстановительных реакций
Решение задач на определение коэффициентов в уравнениях химических реакций
Задание 221.
Исходя из степени окисления хлора в соединениях НСI, НСIО3, НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
КВг + КВгО3 + Н2SO4 → Вг2 + К2SO4 + Н2O
Решение:
Степень окисления хлора в указанных соединениях соответственно равна -1 (низшая), +5 (промежуточная), +7 (высшая). Отсюда следует, что HCl только восстановитель, HClO – окислитель и восстановитель, HClO4 – только окислитель. HCl – только восстановитель, потому что атом хлора в своей низшей степени окисления не может её понизить (принять электроны) и проявляет только восстановительные свойства. HClO может проявлять как восстановительные, так и окислительные свойства, потому что в своей промежуточной степени окисления может присоединять пять электронов и отдавать два электрона. HClO4 может быть только окислителем, потому что в своей высшей степени окисления не может её повысить (отдать электроны).
Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель с окислителем и отражаем это в электронных уравнениях:
5Br -1 + Br +5 = 6Br 0
Общее число электронов, отданных восстановителем должно быть равно числу электронов, которые присоединяет окислитель. Наименьшее кратное для принятых и отданных электронов в данном процессе равно 5. Тогда, разделив число 5 на 5, получим коэффициент 1 для восстановителя и продукта его окисления, а разделив 5 на 1 получаем коэффициент для окислителя и продуктов его восстановления. Коэффициент перед веществами, атомы которых не участвуют в процессе окисления-восстановления, т. е. не меняют свою степень окисления, находим методом подбора. Уравнение реакции будет иметь вид:
Задание 222.
Реакции выражаются схемами:
Р + НIО3 + Н2О → Н3РО4 + НI
Н2S + Сl2 +Н2O → Н2SO4 + НС1
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, отражаем это в электронных уравнениях. Далее учитываем: общее число электронов отданных восстановителем должно быть равно числу электронов, которые присоединяет окислитель. Коэффициенты для восстановителя и окислителя идентичны как для продуктов восстановления, так и для продуктов окисления реакции. Коэффициенты для веществ, атомы которых не меняют свою степень окисления, находят методом подбора.
6P 0 + 5I +5 = 6P +5 + I -1
В данной реакции: НIО3 – окислитель, который восстанавливается до НI, при этом степень окисления йода уменьшается от +5 до -1; Р – восстановитель, который окисляется до Н3РО4, при этом степень окисления фосфора увеличивается от 0 до +5.
уравнения электронного баланса
S -2 + 4Cl2 0 = S +6 + 8Cl -1
В данной реакции: Cl2 – окислитель, который восстанавливается до НCl, при этом степень окисления хлора уменьшается от 0 до -1; Н2S – восстановитель, который окисляется до Н2SO4, при этом степень окисления серы увеличивается от -2 до +6.
Задание 223.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях: As 3- → As5 + ; N 3+ → N 3- ; S 2- → S 0 .
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Na2SO3 + КМnO4 + Н2O → Na2SO4 + МnO2 + КОН
Решение:
а) Электронное уравнение:
При превращении As 3- → As5 + происходит процесс окисления (отдача электронов).
б) Электронное уравнение:
При превращении N 3+ → N 3- происходит процесс восстановления (присоединение электронов).
в) Электронное уравнение:
При превращении S 2- → S 0 происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
3S 4+ + 2Mn 7+ = 3S 6+ + 2Mn 4+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 224.
Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
РbS + HNO3 → S + Рb(NO3)2+ NО + Н2O
Решение:
а) Степень окисления фосфора в указанных соединениях соответственно равна: -3 (низшая), +5 (высшая), +3 (промежуточная). Отсюда: РН3 — только восстановитель; Н3РО4 -только окислитель; Н3РО3 — окислитель и восстановитель.
3S 2- + 2NO 3- + 8H + = 3S 0 + 2NO + 4H2O
Молекулярное уравнение реакции:
В данной реакции: РbS – восстановитель, HNO3 – окислитель; РbS окисляется до S, HNO3 – восстанавливается до NO.
Задание 225.
Реакции выражаются схемами:
Р + НNО3 + Н2О → Н3РО4 + NO;
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO3 + Н2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3Р 0 + 5N 5+ = 3P 5+ + 5N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов пятнадцать. Разделив это число на 3, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 15 на 5 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Р – восстановитель, НNО 3 – окислитель; Р окисляется до Н 3 РО 4, НNО 3 – восстанавливается до NO.
б) KMnO 4 + Na 2 SO 3 + KOH = K 2 MnO 4 + Na 2 SO 4 + Н 2 O
Уравнения электронного баланса:
S 0 + 2Mn 7+ = S 6+ + 2Mn 6+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов два. Разделив это число на 1, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 2 на 2 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KMnO4 – окислитель; Na2SO3 окисляется до Na2SO4, KMnO4 – восстанавливается до K2MnO4.
http://farmf.ru/lekcii/sostavlenie-uravnenij-okislitelno-vosstanovitelnyh-reaktsij/
http://buzani.ru/zadachi/khimiya-shimanovich/934-okislitelno-vosstanovitelnye-reaktsii-zadaniya-221-225