Сульфат натрия: способы получения и химические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Качественная реакция
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат натрия образует сульфат бария и хлорид натрия:
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами :
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
2. Сульфат натрия вступает в реакцию со многими сложными веществами :
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
2.3. Сульфат натрия реагирует с оксидом серы (VI) . Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
2.4. Сульфат натрия взаимодействует с хлоридом бария . При этом образуются хлорид натрия и сульфат бария:
Серная кислота
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Получение
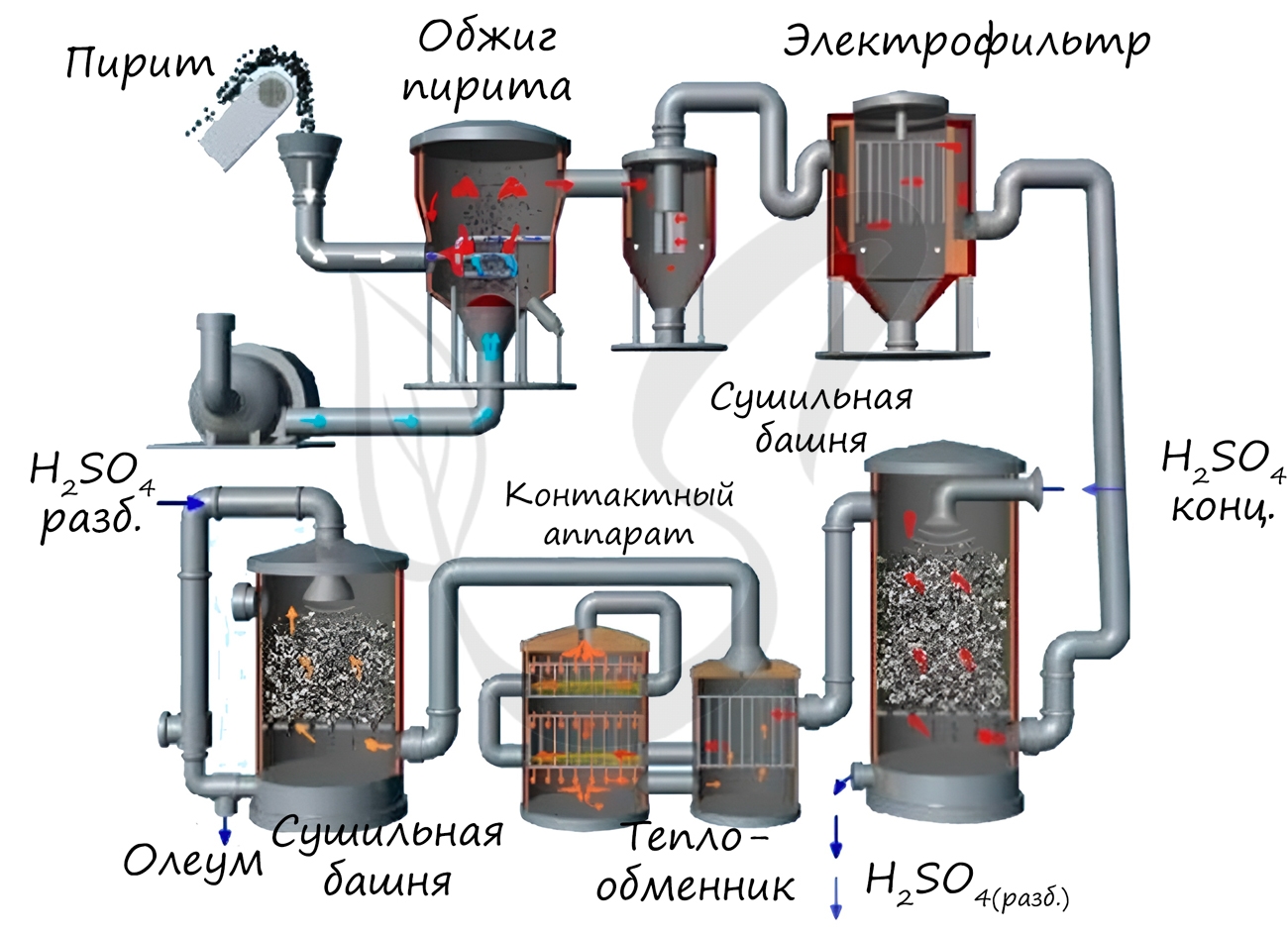
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
- Кислотные свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции с металлами
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Серная кислота (H2SO4)
Молекула серной кислоты имеет крестовидную форму:
Физические свойства серной кислоты:
- плотная маслянистая жидкость без цвета и запаха;
- плотность 1,83 г/см 3 ;
- температура плавления 10,3°C;
- температура кипения 296,2°C;
- очень гигроскопична, смешивается с водой в любых отношениях;
- при растворении концентрированной серной кислоты в воде происходит выделение большого кол-ва тепла ( ВАЖНО ! Приливают кислоту в воду! Воду в кислоту приливать нельзя. )
Серная кислота бывает двух видов:
- разбавленная H2SO4(разб) — водный раствор кислоты, в котором процентное содержание H2SO4 не превышает 70%;
- концентрированная H2SO4(конц) — водный раствор кислоты, в котором процентное содержание H2SO4 превышает 70%;
Химические свойства H2SO4
Серная кислота полностью диссоциирует в водных растворах в две ступени:
Разбавленная серная кислота проявляет все характерные свойства сильных кислот, вступая в реакции:
- с основными оксидами:
- с основаниями:
- с солями:
В окислительно-восстановительных реакциях серная кислота выступает в роли окислителя, при этом, в разбавленной H2SO4 роль окислителей играют катионы водорода (H + ), а в концентрированной — сульфат-ионы (SO4 2- ) (более сильные окислители, чем катионы водорода).
- разбавленная серная кислота:
H2 +1 S +6 O4 -2
окислитель H + : 2H + +2e — → H2 0 ↑ - концентрированная серная кислота:
H2 +1 S +6 O4 -2
окислитель S +6 :- S +6 +2e — → S +4 (SO2)
- S +6 +6e — → S 0 (S)
- S +6 +8e — → S -2 (H2S)
Разбавленная серная кислота реагирует с металлами, стоящими в электрохимическом ряду напряжений левее водорода (реакция проходит с образованием сульфатов и выделением водорода):
С металлами, стоящими правее водорода (медь, серебро, ртуть, золото), разбавленная серная кислота не реагирует.
Концентрированная серная кислота является более сильным окислителем, особенно это проявляется при нагревании. Концентрированная серная кислота не реагирует только с золотом, с остальными металлами, стоящими правее водорода, кислота взаимодействует с образованием сульфатов и сернистого газа. Более активными металлами (цинк, алюминий, магний) концентрированная серная кислота восстанавливается до свободной серы или сероводорода.
С остальными металлами серная кислота взаимодействует с образованием сернистого газа, серы или сероводорода (конкретный продукт восстановления серной кислоты зависит от ее концентрации):
Концентрированная серная кислота окисляет некоторые неметаллы, восстанавливаясь до сернистого газа:
При низких температурах концентрированная серная кислота пассивирует некоторые металлы (железо, алюминий, никель, хром, титан), что дает возможность ее промышленной перевозки в железных цистернах.
Получение и применение серной кислоты
Серную кислоту в промышленности получают двумя способами: контактным и нитрозным.
Контактный способ получения H2SO4:
- На первом этапе получают сернистый газ путем обжига серного колчедана:
- На втором этапе, сернистый газ окисляют кислородом воздуха до серного ангидрида, реакция идет в присутствии оксида ванадия, играющего роль катализатора:
- На третьем, последнем этапе, получают олеум, для этого серный ангидрид растворяют в концентрированной серной кислоте:
- В дальнейшем олеум транспортируется в железных цистернах, а серная кислота получается из олеума разбавлением водой:
Нитрозный способ получения H2SO4:
- На первом этапе очищенный от пыли сернистый газ обрабатывается серной кислотой, в которой растворена нитроза (оксид азота):
- Выделившийся оксид азота окисляется кислородом и снова поглощается серной кислотой:
Применение серной кислоты:
- для осушки газов;
- в производстве других кислот, солей, щелочей и проч.;
- для получения удобрений, красителей, моющих средств;
- в органическом синтезе;
- в производстве органических веществ.
Соли серной кислоты
Поскольку серная кислота является двухосновной кислотой, она дает два вида солей: средние соли (сульфаты) и кислые соли (гидросульфаты).
Сульфаты хорошо растворяются в воде, исключение составляют CaSO4, PbSO4, BaSO4 — первые два плохо растворяются, а сульфат бария практически нерастворим. Сульфаты, в состав которых входит вода, называются купоросами (медный купорос — CuSO4·5H2O).
Отличительной особенностью солей серной кислоты является их отношение к нагреванию, например, сульфаты натрия, калия, бария устойчивы к нагреванию, не разлагаясь даже при 1000°C, в то же время, сульфаты меди, алюминия, железа разлагаются даже при незначительном нагревании с образованием оксида металла и серного ангидрида: CuSO4 = CuO+SO3.
Горькая (MgSO4·7H2O) и глауберова (Na2SO4·10H2O) соль используются в качестве слабительного средства. Сульфат кальция (CaSO4·2H2O) — при изготовлении гипсовых повязок.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
http://studarium.ru/article/174
http://prosto-o-slognom.ru/chimia/503_sernaya_kislota_H2SO4.html