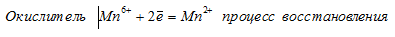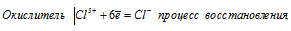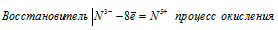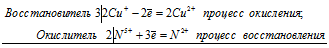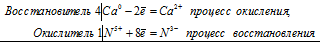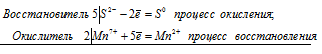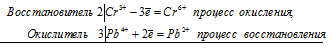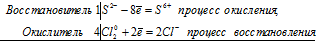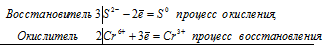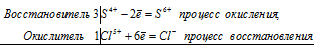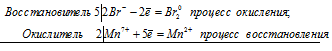Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2db0f6a9df16bf • Your IP : 85.95.188.35 • Performance & security by Cloudflare
На основании электронных схем расставьте коэффициенты в уравнении реакции: Cu2О+HNO3 = Cu(NO3)2 + NO +H2O. Укажите, какое вещество является






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
На основании электронных схем расставьте коэффициенты в уравнении реакции:
Cu2 О +HNO3 = Cu(NO3)2 + NO +H2O.
Укажите, какое вещество является восстановителем, какое окислителем, какое восстанавливается, какое окисляется.
Решение :
восстановитель 2 Cu +1 – 2ē → 2 Cu +2 3 окисление
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Объёмные доли хлора и азота в газовой смеси составляют соответственно 35 и 65 %. Рассчитайте парциальное давление каждого газа
- При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03л водорода, измеренного при нормальных условиях
- Составьте по два молекулярных уравнения к каждому из ионных уравнений
- При смешении растворов CuSO4 и К2СО3 выпадает осадок карбоната гидроксомеди и выделяется газ. Составьте молекулярное и ионные уравнения
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Методы составления уравнений окислительно-восстановительных реакций
Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
Задание 226.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
Мn 6+ ⇔ Мn 2+ ; С1 5+ ⇔ С l- ; N 3- ⇔ N 5+ . На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Сu2O + HNO3 ⇔ Cu(NO3)2 + NO + H2O.
Решение:
При превращении Мn 6+ ⇔ Мn 2+ происходит процесс восстановления (присоединение электронов).
При превращении С1 5+ ⇔ С l- происходит процесс восстановления (присоединение электронов).
При превращении N 3- ⇔ N 5+ происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
6Сu + + 2N 5+ = 6Cu 2+ + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 227.
Реакции выражаются схемами:
HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O;
K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Са 0 + N 5+ = 4Са 2+ + N 3-
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Са – восстановитель, HNO3 – окислитель; Са окисляется до Ca(NO3)2, HNO3 – восстанавливается до NH4NO3.
5S 2- + 2Mn 7+ ⇔ 5S 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: К2S – восстановитель, KMnO4 – окислитель; К2S окисляется до К2SO4, KMnO4 – восстанавливается до MnSO4.
Задание 228.
Исходя из степени окисления хрома, йода и серы в соединениях К2Cr2O7, КI и Н2SO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Решение:
а) Степень окисления хрома, йода и серы в указанных соединениях соответственно равна +6 (высшая), -1 (низшая) и +6 (высшая). Отсюда: К2Cr2O7 только окислитель; КI — только восстановитель; Н2SO4 — только окислитель.
б) NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Сr 3+ + 3Pb 4+ ⇔ 2Сr 6+ + Pb 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 229.
Реакции выражаются схемами:
H2S + Cl2 + H2O ⇔ H2SO4 + HCl
K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнения электронного баланса:
S -2 + 4Cl2 0 ⇔ S +6 + 8Cl -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 2, получаем коэффициент 4 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Н2S – восстановитель, Cl2 – окислитель; Н2S окисляется до Н2SO4, Cl2 – восстанавливается до HCl.
б) K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
3S 2- + 2Cr 6+ ⇔3S 0 + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 230.
Реакции выражаются схемами:
KClO3 + Na2SO3 ⇔ KCl + Na2SO4;
KMnO4 + HBr ⇔ Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KClO3 – окислитель; Na2SO3 окисляется до Na2SO4, KClO3 – восстанавливается до KCl.
10Br — + 2Mn 7+ ⇔ 5Br2 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HBr – восстановитель, KMnO4 – окислитель; HBr окисляется до Br2, KMnO4 – восстанавливается до MnBr2.
http://natalibrilenova.ru/na-osnovanii-elektronnyih-shem-rasstavte-koeffitsientyi-v-uravnenii-reaktsii-cu2ohno3—cuno32—no-h2o-ukazhite-kakoe-veschestvo-yavlyaetsya-/
http://buzani.ru/zadachi/khimiya-shimanovich/935-okislitelno-vosstanovitelnye-reaktsii-zadaniya-226-230