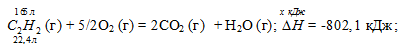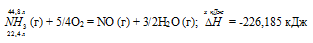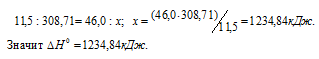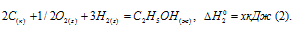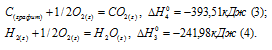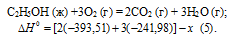Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e33fcc3aa0a7b1b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составление термохимического уравнения реакции и вычисление теплот образования веществ
Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
На основании термохимических уравнений сравните количество теплоты
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Приведите по два примера экзотермических и эндотермических реакций.
Экзотермические реакции:
N2 (г) + 3H2 (г) ⇄ 2NH3 (г) + 92 кДж
С (тв) + О2 (г) = СО2 (г) + 410 кДж
Эндотермические реакции:
CaCO3 (тв) = CaO (тв) + CO2 (г) ― 170 кДж
N2 (г) + O2 (г) = 2NO (г) ― 180 кДж
Задание 2
Даны термохимические уравнения нескольких реакций. Какие из них являются экзотермическими; эндотермическими?
а) 4P (тв) + 5O2 (г) = 2P2O5 (тв) + 2984 кДж; Экзотермическая реакция
б) 2Al (тв) + Fe2O3 (тв) = Al2O3 (тв) + 2Fe (тв) + 850 кДж; Экзотермическая реакция
в) N2 (г) + O2 (г) = 2NO (г) ― 180 кДж; Эндотермическая реакция
г) C6H12O6 (тв) + 6O2 (г) = 6CO2 (г) + 6H2O (ж) + 2800 кДж. Экзотермическая реакция
Задание 3
При кристаллизации свинца из расплава происходит выделение теплоты. Какой это процесс – экзо- или эндотермический? Экзотермический процесс, так как происходит выделение теплоты.
Задание 4
Пользуясь данными, приведёнными в параграфе, составьте термохимическое уравнение разложения жидкой воды на водород и кислород.
2Н2О (ж) = 2H2 (г) + O2 (г) ― 572 кДж
Задание 5
Дано термохимическое уравнение синтеза аммиака: N2(г) + 3H2(г) = 2NH3(г) + 92 кДж. Рассчитайте, сколько теплоты выделится при образовании:
а) 10 моль;
Решение
По термохимическому уравнению с 2 моль NH3 выделяется 92 кДж теплоты,
По условию задачи с 10 моль NH3 ― х кДж теплоты.
х=10 моль ● 92 кДж : 2 моль=460 кДж
Ответ: 460 кДж
б) 10 г;
Решение
По термохимическому уравнению с 34 г (2 моль) NH3 выделяется 92 кДж теплоты,
По условию задачи с 10 г NH3 ― х кДж теплоты.
х=10 г ● 92 кДж : 34 г=27 кДж
Ответ: 27 кДж
в) 10 л (н.у.) аммиака.
Решение
По термохимическому уравнению с 44,8 л (2 моль) NH3 выделяется 92 кДж теплоты,
По условию задачи с 10 л NH3 ― х кДж теплоты.
х=10 л ● 92 кДж : 22,4 л =20,5 кДж
Ответ: 20,5 кДж
Задание 6
Теплота сгорания угля равна 393,5 кДж/моль. Напишите термохимическое уравнение реакции. Рассчитайте количество теплоты, которое выделится при сгорании 1 кг угля. Какой объём углекислого газа (н.у.) образовался, если при сгорании угля выделилось 157,4 кДж теплоты?
Решение
C 12 г (1 моль) С выделяется 393,5 кДж теплоты,
с 1000 г С ― х кДж теплоты.
х=393,5 кДж : 12 г = 32780 кДж
С 22,4 л (1 моль) СО2 выделяется 393,5 кДж теплоты,
с х л СO2 ― 157,4 кДж теплоты.
х=157,4 кДж ● 393,5 кДж: 22,4 л=8,96 л
Ответ: выделится 32780 кДж теплоты, образуется 8,96 л углекислого газа.
Задание 7
На разложение 19,7 г карбоната бария на оксид бария и углекислый газ затратили 27,2 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение
Составляем термохимическое уравнение с указанием агрегатного состояния веществ:
BaCO3 (т.) = BaO (т.) + CO2 (г.)
По термохимическому уравнению на 197 г (1 моль) BaCO3 затратили х кДж теплоты,
По условию задачи на 19,7 г BaCO3 ― 27,2 кДж теплоты
х=197 ● 27,2 кДж : 19,7 г = 272 кДж
Термохимическое уравнения реакции имеет вид: BaCO3 (т.) = BaO (т.) + CO2 (г.) -272 кДж
Задание 8
Рассчитайте количество теплоты, которая выделится при сгорании 1 м 3 (н.у.) природного газа, содержащего 90% метана CH4, 8% этана C2H6 и 2% пропана C3H8 (по объёму). Теплоты сгорания метана, этана и пропана равны соответственно 802, 1428 и 2045 кДж/моль.
Дано: V(смеси)=1 м 3 =1000 л, φ(CH4)=90%, φ(C2H6)=8%, φ(C3H8)=2%,
Найти: Q-?
Решение
V(CH4)=φ(CH4)●V(смеси):100%=90% ● 1000 л : 100%=900 л
V(C2H6)=φ(C2H6)●V(смеси):100%=8% ● 1000 : 100%=80 л
V(C3H8)=φ(C3H8)●V(смеси):100%=2% ● 1000 : 100%=20 л
С 22,4 л (1 моль) СH4 выделяется 802 кДж теплоты,
с 900 л СH4 ― x кДж теплоты.
х=802 кДж ● 900 л : 22,4 л=32223 кДж
С 22,4 л (1 моль) С2H2 выделяется 1428 кДж теплоты,
с 80 л С2H2 ― у кДж теплоты.
у=1428 кДж ● 80 л : 22,4 л=5100 кДж
С 22,4 л (1 моль) С3H8 выделяется 2045 кДж теплоты,
с 20 л С2H2 ― z кДж теплоты.
z=2045 кДж ● 20 л : 22,4 л=1826 кДж
Q =х + y + z= 32223 кДж + 5100 кДж + 1825 кДж = 39150 кДж
Ответ: Q=39150 кДж
Задание 9
Термохимическое уравнение реакции разложения воды на простые вещества: 2H2O (г) = 2H2 (г) + O2(г) — 484 кДж. Сколько теплоты надо затратить для разложения 90 г газообразной воды?
Решение
По термохимическому уравнению на 36 г (2 моль) H2O затратится 484 кДж теплоты,
По условию задачи на 90 г H2O ― х кДж теплоты.
х=90 г ● 484 кДж : 36 г=1210 кДж
Ответ: надо затратить 1210 кДж
Задание 10
Теплоты сгорания метана и ацетилена равны соответственно 802 и 1260 кДж/моль. Какой из двух газов даёт больше теплоты при сгорании: а) 1 кг вещества;
Решение
С 16 г (1 моль) СH4 выделяется 802 кДж теплоты,
с 1000 г СH4 ― х кДж теплоты.
х=1000 г ● 802 кДж : 16 г=50125 кДж
С 26 г (1 моль) C2H2 выделяется 1260 кДж теплоты,
с 1000 г С2H2 ― у кДж теплоты.
у=1000 г ● 1260 кДж : 26 г=48461 кДж
QCH4 > QC2H2
Ответ: 1 кг метана CH4 дает больше теплоты при сгорании.
б) 1 м 3 (н.у.) вещества.
Решение
С 22,4 л (1 моль) СH4 выделяется 802 кДж теплоты,
с 1000 л СH4 ― х кДж теплоты.
х= QCH4= 1000 л ● 802 кДж : 22,4 л=35804 кДж
С 22,4 л (1 моль) С2H2 выделяется 1260 кДж теплоты,
с 1000 л С2H2 ― y кДж теплоты.
y= QC2H2= 1000 л ● 1260 кДж : 22,4 л=56250 кДж
QCH4 QC2H2
Ответ: 1 м 3 ацетилена C2H2 дает больше теплоты при сгорании.
Задание 11
Используя данные задачи 2, определите тепловой эффект реакции фотосинтеза: 6CO2 (г) + 6H2O (ж) = C6H12O6 (тв) + 6O2 (г).
Дано: Qобр.(CO2)=393,5 кДж/моль, Qобр.(H2O)=286 кДж/моль, Qобр.(C6H12O6)=1274 кДж/моль
Найти: Qреакции=?
Решение
На 1 моль СO2 затрачивается 393,5 кДж теплоты,
на 6 моль CO2 ― х кДж теплоты.
х= Q1=6 моль ● 393,5 кДж : 1 моль=2361 кДж
На 1 моль H2O затрачивается 286 кДж теплоты,
на 6 моль H2O ― х кДж теплоты.
х= Q2=6 моль ● 286 кДж : 1 моль=1716 кДж
На 1 моль C6H12O6 затрачивается 1274 кДж теплоты, поэтому Q3= 1274 кДж
Qреакции= Q1— Q2— Q3= 1274 кДж — 1716 кДж — 2361 кДж=-2803 кДж
Ответ: Qреакции= -2803 кДж
Откуда берётся энергия, необходимая для этой реакции? Энергия солнца
Залание 12
Теплота сгорания водорода равна 286 кДж/моль. Используя данные задач 6 и 8, определите, какое топливо – уголь, водород или метан – даёт больше теплоты в расчёте на единицу массы (например, 1 г).
Решение
С 44 г (1 моль) С выделяется 393,5 кДж теплоты,
с 1 г C ― х кДж теплоты.
х= QС=1 г ● 393,5 кДж : 10 г=39,35 кДж
С 2 г (1 моль) H2 выделяется 286 кДж теплоты,
с 1 г H2 ― х кДж теплоты.
х= QH2=1 г ● 286 кДж : 2 г=143 кДж
С 16 г (1 моль) CH4 выделяется 802 кДж теплоты,
с 1 г CH4 ― х кДж теплоты.
х= QCH4=1 г ● 802 кДж : 16 г=50,125 кДж
QH2> QCH4> QC
Ответ: при сгорании водород даёт больше теплоты в расчёте на единицу массы, чем метан и уголь.
http://buzani.ru/zadachi/khimiya-shimanovich/913-termokhimicheskie-uravneniya-teplota-obrazovaniya-zadanie-88-94
http://gdz.cool/h9_edl_2019/1278-h9_ekdl_2019_19____.html