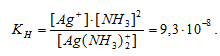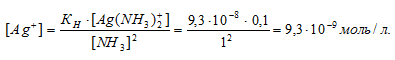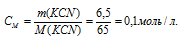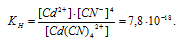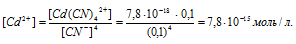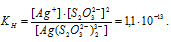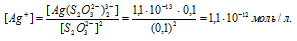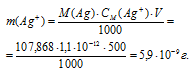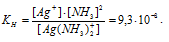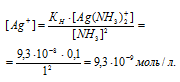Задачи к разделу Комплексные соединения
Здесь приведены задачи к разделу Комплексные соединения: структура, классификация, номенклатура комплексных соединений, а также их устойчивость и химические свойства.
Задача 1. Из сочетаний частиц Hg 2+ , NH3, I — и K + можно составить 5 координационных формул комплексных соединений ртути. Укажите формулы данных соединений, если координационное число ртути равно четырем. Назовите эти соединения и запишите уравнения их диссоциации на ионы.
Решение.
Диссоциация протекает ступенчато:
K[Hg(NH3)I3] – моноамминотрийодомеркурат (II) калия
Вторичная диссоциация протекает ступенчато (см. пример выше).
K2[HgI4] — тетрайодомеркурат (II) калия
Вторичная диссоциация протекает ступенчато; суммарно выглядит следующим образом:
[Hg(NH3)3I]I – йодид триамминомонойодортути (II)
Вторичная диссоциация идет по ступеням; суммарно выглядит следующим образом:
[Hg(NH3)4]I2 – йодид тетраамминортути (II)
Вторичная диссоциация протекает ступенчато; суммарно выглядит следующим образом:
Задача 2. Рассмотрите следующую реакцию:
Решение.
В целом, комплексное соединение нейтрально. Составим уравнение, в котором заряд иона кобальта обозначим через x:
[Co(H2O)6)]Cl2
Координационное число в обоих соединениях равно к.ч. = 6
В данной реакции H2O2 играет роль окислителя, Co +2 — роль восстановителя, а аммиак принимает участие в образовании аммиачного комплекса.
Решение.
Координационное число показывает количество лигандов, окружающих комплексообразователь. В данном примере к.ч = 6.
Cr(NH3)5Сl3
Co(NH3)5(NO2)3
Задача 4. Пользуясь таблицей констант нестойкости, определите, в каких случаях произойдет взаимодействие между растворами электролитов. Укажите для этих случаев молекулярные и ионные формы уравнений:
Решение.
Реакция протекает в сторону образования более прочного соединения. Чтобы определить вероятность протекания реакции, необходимо сравнить константы нестойкости исходного и образовавшегося комплексных соединений. Комплексное соединение тем прочнее, чем более низкое значение имеет константа нестойкости.
2K + + [HgBr4] 2- + 4K + + 4CN — = 2K + + [Hg(CN)4] 2- + 4K + + 4Br —
Во всех приведенных реакциях Kн исходных комплексных соединений имеют большее значение, чем Kн образовавшихся комплексных соединений, поэтому между всеми растворами электролитов произойдет взаимодействие.
Задача 5. Приведите схемы диссоциации и выражения констант нестойкости следующих комплексных ионов:
Определите степень окисления указанных комплексообразователей.
Решение.
Обозначим степень окисления центрального атома через х:
а) [Fe(CN)6] 4- ;
в) [Cr(H2O)6] 3+
Задача 6. Укажите названия соединений, определите степень окисления комплексообразователя:
Составьте уравнения электролитической диссоциации перечисленных веществ и запишите соответствующие им выражения констант нестойкости комплексных ионов.
Решение.
Чтобы определить степень окисления центрального атома, необходимо решить простое уравнение, обозначив через х степень окисления комплексообразователя:
а) [Cr(NH3)6]Cl3 – хлорид гексаамминхрома (III)
б) [Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
в) K4[Fe(CN)6] – гексацианоферрат(II) калия
г) Na2[Be(OH)4] – тетрагидроксоберрилат(II) натрия
д) [Co(NH3)3Cl3] – триамминтрихлорокобальтат(III)
е) K[Pt(NH3)Cl3] – амминтрихлороплатинат(II) калия
1·1 + х + 1·0 + 3·(-1) = 0
Задача 7. Напишите формулы комплексных соединений по указанным названиям:
а) хлорид тетраамминцинка (II), б) тетраиодокобальтат (III) натрия.
Составьте уравнение реакции между указанными соединениями и раствором KNO2 в молекулярной и ионно-молекулярной формах. Назовите образующиеся комплексные соединение.
Решение.
а) хлорид тетраамминцинка (II) – [Zn(NH3)4]Cl2
б) тетраиодокобальтат (III) натрия — Na[CoI4]
Na[Co(NO2)4] — тетранитрокобальтат(III) натрия
Задача 8. Эмпирическая формула соли CrCl3×5 H2O. Исходя из того, что координационное число хрома равно шести, определите, какой объем 1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 300 мл 0,1 М раствора комплексной соли. При вычислениях считать, что вся вода, входящая в состав соли, связана внутрисферно.
Решение.
Известно, что вся вода связана внутрисферно, а к.ч. = 6, поэтому формула соединения следующая:
[Cr(H2O)5Cl]Cl2 – хлорид пентааквахлорохрома (III)
Используя «золотое правило аналитики», найдем какой объем 1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 300 мл 0,1 М раствора комплексной соли:
где С1 и С2 – молярные концентрации растворов AgNO3 и комплексной соли, а V1 и V2 – их объемы.
Для AgNO3 нормальная концентрация совпадает с молярной концентрацией. Подставим значения в формулу:
V1 = 0,03 л = 30 мл.
Из уравнения реакции видно, что на осаждение всего хлора понадобится 2 моля AgNO3, поэтому:
Решение.
Известно, что имея один и тот же комплексообразователь, цианидные комплексы более устойчивы аммиачных.
Это можно увидеть по значениям констант нестойкости этих комплексов. Пользуясь таблицей констант нестойкости, определим:
Комплексное соединение тем прочнее, чем более низкое значение имеет константа нестойкости. А реакция всегда протекает в сторону образования более прочного комплекса, поэтому данная реакция возможна.
Уравнения химических реакций комплексных соединений в молекулярной и ионно-молекулярной форме
Задача 729.
Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнения реакций в молекулярной и ионно-молекулярной форме:
а) К2[HgI4] + KBr;
б) К2[HgI4] + KCN;
в) [Ag(NH3)2]Cl + K2S2O3;
г) K[Ag(CN)2] + KBr;
д) K[Ag(CN)2] + NH3;
е) K[Ag(NO2)2] + NH3;
ж) [Ag(NH3)2]Cl + NiCl2;
з) K3[Cu(CN)4] + Hg(NO3)2.
Решение:
а) К2[HgI4] + KBr
Реакция не протекает так как Kн(K2[HgI4] 2- ) 2- ),
При диссоциации К2[HgI4] и KBr образуются ионы К +, Br — и [HgI4] 2- , который обладает большой устойчивостью:
2K + + [HgI4] 2- + K + + Br — = 3K + + [HgI4] 2- + Br — — реакция не протекает.
б) К2[HgI4] + KCN
Реакция протекает так как Kн(K2[HgI4]) > Kн(K2[Hg(CN)4], получим:
K2[HgI4] + 4KCN = K2[Hg(CN)4] + 4KI (молекулярная форма);
2K + + [HgI4] 2- + 4K + + 4CN — = 2K + + [Hg(CN)4] 2- + 4K + + 4I — (полная ионная форма);
[HgI4] 2- + 4CN — = [Hg(CN)4] 2- + 4I — (сокращенная ионная форма).
г) K[Ag(CN)2] + KBr;
Реакция не протекает так как при диссоциации K[Ag(CN)2] и KBr образуются ионы К+, Br- и [Ag(CN)2]-, который обладает большой устойчивостью.
д) K[Ag(CN)2] + NH3
Реакция не протекает так как Kн([Ag(CN)2] — ) + ). При диссоциации K[Ag(CN)2] образуются ионы К + и [Ag(CN)2] — , который ведет себя в обменных реакциях как неразрывное целое:
K[Ag(CN)2] + NH3 = K + + [Ag(CN)2] — + NH3.
е) K[Ag(NO2)2] + NH3
При диссоциации K[Ag(NO2)2] образуются ионы K + и [Ag(NO2)2] — , который обладает большой устойчивостью:
K[Ag(NO2)2] = K + и [Ag(NO2)2] — . Реакция не протекает, так как ион [Ag(NH3)2] + не образуется, потому что Kн([Ag(NO2)2] — ) + .
ж) [Ag(NH3)2]Cl + NiCl2
Как электролиты обе соли диссоциируют:
[Ag(NH3)2]Cl = [Ag(NH3)2] + + Сl — ;
NiCl2 = N1 2+ + 2Cl — .
Ионы Ag + и Cl — соединяясь друг с другом образуют нерастворимое соединение AgCl, а ион Ni 2+ с NH3 образует комплекс [Ni(NH3)6] 2+ , так как Kн (Ni(NH3)6] 2+ ) + ), получим:
3[Ag(NH3)2]Cl + NiCl2 = [Ni(NH3)6]Сl2 + 3AgCl↓ (молекулярная форма);
3[Ag(NH3)2] + + Cl — + Ni 2+ + 2Cl — = [Ni(NH3)6] 2+ + 2Сl — + 3AgCl↓ (полная ионная форма);
3[Ag(NH3)2] + + Ni 2+ + 3Cl — = [Ni(NH3)6] 2+ + 3AgCl↓ (сокращенная ионная форма).
Задача 730.
Вычислить концентрацию ионов Ag+ в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3.
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -8 . Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag + + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2] + может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
Ответ: 9,3 . 10-8 моль/л.
Задача 731.
Вычислить концентрацию ионов кадмия в 0,1 М растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л КCN.
Решение:
M(KCN) = 65г/моль. Рассчитаем концентрацию цианида калия:
Константа нестойкости иона [Cd(CN)4] 2+ равна 7,8 . 10 -18 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов CN — , создаваемого в результате диссоциации КCN (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов CN — , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Сd 2+ ] = С(соли) = 0,01 моль/л. По той же причине равновесная концентрация ионов [Cd(CN)4] 2- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Сd 2+ :
Ответ: 7,8 . 10-15 моль/л.
Задача 732.
Найти массу серебра, находящегося в виде ионов в 0,5 л 0,1 М раствора дитиосульфатоаргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия.
Решение:
М(Ag) = 107,868г/моль. Константа нестойкости иона [Ag(S2O3)2] 3- равна 1,1 . 10 -13 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов S 2 O 3 2- , создаваемого в результате диссоциации К2S2O3 (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов S 2 O 3 2- , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Ag + ] = С(К2S2O3) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(S2O3)2] 3- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).По условию задачи:
Отсюда выражаем концентрацию ионов Ag + :
Теперь рассчитаем массу серебра, находящуюся в виде ионов в количестве 1,1 . 10 -12 моль/л в растворе комплексной соли:
Ответ: 5,9 . 10 -9 г.
Задача 733.
Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 м раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 1 . 10 -5 моль КВг; б) 1 . 10 -5 моль КI? ПР(AgBr) = 6 . 10 -13 ; ПР(AgI) = 1,1 . 10 -16 .
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -9 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда
По условию задачи:
Отсюда выражаем концентрацию ионов Ag+:
а) Уравнение реакции имеет вид:
Из уравнения реакции следует, что из 1 моль КBr и 1 моль [Ag(NH 3 ) 2 ]NO 3 образуется 1 моль AgBr. Так как [Ag + ] = 9,3 . 10 -9 моль/л; [Br — ] =1 . 10 -5 моль/л, то произведение концентраций ионов Ag + и Br — будет равна: (9,3 . 10 -9 ) . (1 . 10 -5 ) = 9,3 . 10 -14 . Так как 9,3 . 10 -14 > 1,1 . 10 -16 , то осадок бромида серебра не образуется.
Электролитическая диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, т.е. как сильные электролиты (первичная диссоциация).
Пример 2.9. Первичная диссоциация комплексных соединений.
комплексная соль катионного типа:
комплексная соль анионного типа:
Комплексные частицы, или комплексы (молекулыили ионы), в свою очередь,диссоциируют лишь частично (aдис 2+ ⇄ [Cu(NH3)3] 2+ + NH3 ; (К1)
Прочность комплекса обычно характеризуют полной константой равновесия его диссоциации.Константа суммарной реакции диссоциации комплекса называется константой нестойкости КН. Она равна произведению констант диссоциации отдельных ступеней. Например, для суммарного уравнения для всех 4-х ступеней
константа нестойкости равна:

В общем виде для диссоциации комплекса [ MХn] Z :
[ MХ] Z ⇄ 
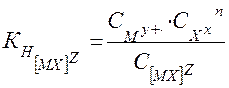
где z – заряд комплекса; n – заряд комплексообразователя; m – заряд лиганда.
Из приведенного уравнения легко определить концентрацию ионов комплексообразователя, образующихся при диссоциации комплекса, если принять, что активности ионов равны концентрациям, и в растворе нет избытка лигандов.
Чем меньше КН, тем прочнее комплекс.
Константа процесса, обратного диссоциации комплекса, т.е. процесса образования комплекса, называется константой устойчивости комплекса (Ку):

Чем больше значение Ку, тем устойчивее комплексная частица.
Значения констант нестойкости некоторых комплексных ионов приведены в табл.12.
Константы нестойкости комплексных ионов при 298 К
| Комплексный ион | КН | Комплексный ион | КН |
| [AgCl2] — | 1,76 ∙10 -5 | [Hg(NH3)4] 2+ | 5,3∙10 -20 |
| [Ag(NH3)2] + | 9,3∙10 -8 | [Co(NH3)4] 2+ | 2,8∙10 -6 |
| [ Ag(CN)2] — | 8∙10 -22 | [Fe(CN)6] 4- | 1,1∙10 -24 |
| [AgBr2] | 7,8∙ 10 -8 | [Fe(CN)6] 3- | 1∙10 -31 |
| [Cu(NH3)4] 2+ | 2,14∙10 -13 | [Zn(NH3 )4] 2+ | 3,46∙10 -10 |
| [Cu(CN)4] 2- | 9,6 ∙10 -29 | [Zn(OH)4] 2- | 3,6∙10 -16 |
| [Cd(NH3)4] 2 + | 7,56∙10 -8 | [Ni(NH3)4] 2 + | 1,12∙10 -8 |
| [Cd(CN)4] 2- | 1,41∙10 -19 | [Ni(CN)4] 2 — | 1,8∙10 -14 |
| [HgCl4] 2 — | 8,5∙10 -16 | [PbBr4] 2- | 1,1∙10 -3 |
| [Hg(NH3)4] 2 + | 5,4∙10 -20 | [CuCl4] 2 — | 6,4∙10 -6 |
| [HgBr4] 2 — | 1,1∙10 -21 | [CdI4] 2 — | 8,1∙10 -7 |
| [Hg(CN)4] 2- | 4,0∙10 -42 | [Co(NH3)6] 2 + | 7,8∙10 -6 |
| [HgI4] 2 — | 1,48∙10 -30 | [Co(NH3)6] 3+ | 7,1∙10 -36 |
Задача 2.2.Рассчитайте концентрацию ионов Ag + в 0,02 М растворе Na[Ag(CN)2] а) в отсутствии избытка лиганда; б) при наличии избытка ионов (СN) — при их концентрации в растворе NaCN 0,5 М.
а) Уравнение первичной диссоциации комплексной соли как сильного электролита:
Na[Ag(CN)2] 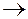
Уравнение суммарной диссоциации комплекса:
[Ag(CN)2] + ⇄ Ag + + 2 (CN ) — , а КН = 8∙10 -22 (см. табл.12).
Обозначим через x концентрацию Ag + . Тогда равновесная концентрация лиганда согласно уравнению равна 2 x, а равновесная концентрация недиссоциированного комплексного иона – (0,02 – х). Так как значение Кн очень мало, величиной х по сравнению с 0,02 можно пренебречь. С учетом этого запишем выражение для Кн:

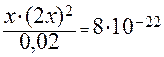

б) Концентрацию Ag + рассчитываем аналогично, но концентрацию лиганда (CN) — принимаем равной 0,5 М:
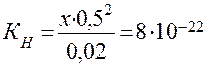

Таким образом, в 0,5 М растворе NaCN концентрация ионов Ag + почти на 14 порядков ниже, чем концентрация ионов [H + ] в воде.
Дата добавления: 2016-02-24 ; просмотров: 1894 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://buzani.ru/zadachi/khimiya-glinka/1248-khimicheskie-reaktsii-kompleksnykh-soedinenij-za9-733
http://helpiks.org/7-18364.html