Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
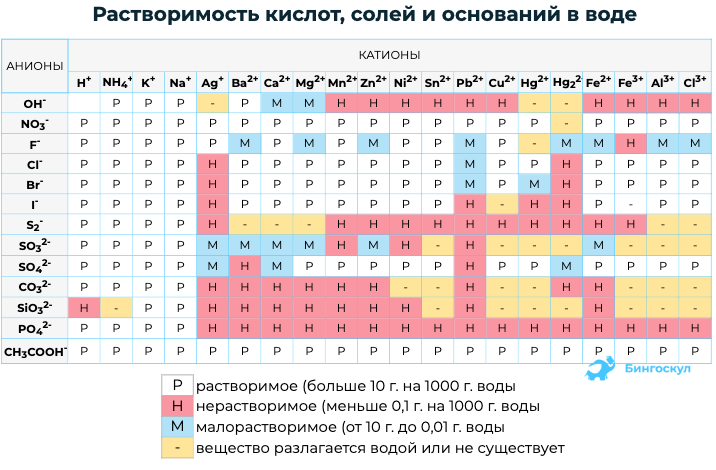
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
Реакции ионного обмена
Содержание:
Что есть реакция ионного обмена? Определение
Химическое взаимодействие ионов в электролитах называется реакцией ионного обмена (РИО).
Сущность РИО заключается в связывании ионов.
Напоминание. Электролиты – это водные растворы кислот, солей или оснований, в которых эти вещества распадаются (диссоциируют) на свободные заряженные ионы.
Необходимое условие РИО. Правило Бертолле
Главное условие необратимого протекания ионнообменной реакции между электролитами – образование осадка, газообразного вещества или малодиссоциирующего соединения (слабого электролита, в т.ч. воды).
Данное утверждение носит название правила Бертолле. Этот французский химик сформулировал его в 1803 г.
Следует помнить, что это правило справедливо при взаимодействии ненасыщенных растворов.
Особенности РИО. Суть необратимого процесса
- В ходе ионообменной реакции не происходит перехода электронов и соответственно изменения степени окисления реагирующих частиц.
- Ионообменный процесс может быть и обратимым, то есть реакция будет протекать в двух направлениях. Это происходит в случае, когда одно из исходных веществ — слабый электролит.
- В соответствии с правилом Бертолле, например, азотная кислота реагирует с гидроокисью натрия. В результате образуются сильный электролит азотнокислого натрия и малодиссоциирующий электролит – вода.
HNO3, NaOH, NaNO3 — будучи сильными электролитами в растворе находятся в виде ионов. А вода, H2O как слабый электролит фактически не распадается на ионы.
Более реально состояние реагентов в растворе демонстрирует запись в виде заряженных ионов:
H + + NO3 — + Na + + OH — = Na + + NO3 — + H2O (2)
В уравнении (2) видно, что ионы NO3 — и Na + находятся в растворе и до и после реакции, т.е. в ней не участвуют. После сокращения в обеих частях уравнения одинаковых ионов получается короткая запись:
Эти уравнения получили названия:
(3) — сокращенное ионное уравнение,
(2) – полное ионное уравнение,
(1) – молекулярное уравнение реакции.
Вывод: уравнение в ионной форме отражает сущность процесса, показывает за счёт чего возможно его протекание.
Знать: в обратимых РИО не бывает сокращенной ионной формы уравнения.
Правила (алгоритм) составления уравнений ионно-обменных реакций
В обычных химических уравнениях разложение молекул на ионы не учитывается. Чтобы отразить сущность взаимодействия электролитических растворов, пользуются ионными уравнениями, которые составляются по определённым правилам.
- Для составления уравнения РИО следует проверить растворимость реагентов по таблице растворимости веществ.
Примеры РИО с выделением газа и выпадением осадка
- Пример ионнообменной реакции с выделением углекислого газа и воды (реагенты соль и кислота):
- Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O — уравнение в молекулярной форме;
- 2Na + + CO3 2- + 2H + + SO4 2- = 2Na + + SO4 2- + CO2↑ + H2O – уравнение в полной ионно-молекулярной форме;
- CO3 2- + 2H + = CO2↑ + H2O – уравнение в сокращённой ионно-молекулярной форме.
- Пример ионообменной реакции с образованием нерастворимого сернокислого свинца:
- Pb(NO3)2 + K2SO4 = PbSO4 + 2KNO3 – уравнение в молекулярной форме;
- Pb 2+ + 2NO3 — + 2K + + SO4 2- = PbSO4↓ + 2K + + 2NO3 — — уравнение в полной ионно-молекулярной форме;
- Pb 2+ + SO4 2- = PbSO4↓ – уравнение в сокращённой ионно-молекулярной форме.
Применение РИО
Во многих отраслях индустрии, сельском хозяйстве, в решении проблем экологии используются реакции ионного обмена. Несколько примеров применения РИО.
- Для обессоливания (деминерализации) воды с помощью катионитных и анионитных колонок. Катиониты поглощают ионы Ca 2+ , Mg 2+ , заменяя их на ионы H + . На анионите группа OH — заменяется анионами Cl — . В итоге получается почти дистиллированная вода.
- Для опреснения воды в космических кораблях и морских судах.
- Для обеспечения ионного обмена в почвах, что помогает улучшению их агротехнических свойств.
- Для извлечения ценных примесей (уран, золото, серебро).
- Для удаления ионов тяжелых металлов при очистке промышленных сточных вод.
В заключении интересный факт: домашние хозяйки, сами того не зная, используют правило Бертолле, когда применяют реакцию ионного обмена между столовым уксусом и пищевой содой. Выделяющийся при этом газ способствует «поднятию» теста.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакции ионного обмена протекали, необходимо, чтобы выполнялись не только условия: образование осадка, газа или воды, но и вещества –реагенты должны быть растворимыми.
- CuS + Fe(NO3)2 ≠ FeS + Cu(NO3)2
- реакция не идет, потому что FeS – нерастворим, а так же нерастворимой солью является соль – реагент сульфид меди — (CuS).
- Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
- реакция протекает, так как карбонат кальция нерастворим и соли – реагенты являются растворимыми.
- Cu(OH)2 + Na2S – не протекает,
- Чтобы соль с основанием реагировали, необходима растворимость их обоих.
- Cu(OH)2 — нерастворим, хотя потенциальный продукт CuS был бы осадком. В одной системе 2-х осадков не бывает.
- 2NaOH + Cu(NO3)2 = Cu(OH)2 ↓+ 2NaNO3
- реакция протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
- Это требование не распространяется на растворимость исходных веществ дальше реакций соль1+ соль2 и соль + основание.
- Все растворимые кислоты реагируют со всеми карбонатами, в том числе нерастворимыми.
Вывод:
- Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
- Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть садок или гидроксид аммония.
Задания 31. Диссоциация электролитов. Реакции ионного обмена.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
перманганат калия, гидрокарбонат калия, сульфит натрия, сульфат бария, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
K + + HCO3 — + K + + OH — = 2K + + CO3 2- + H2O
Комментарий: формулы слабых кислот, а также формулы водородсодержащих кислотных остатков слабых кислот в ионных уравнениях записываются целиком.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидрокарбонат натрия, алюминат натрия, бромид калия, углекислый газ, концентрированная серная кислота.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
Комментарий: формулы слабых кислот, а также формулы водородсодержащих кислотных остатков слабых кислот в ионных уравнениях записываются целиком.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
азот, хлороводород, оксид фосфора (V), диоксид марганца, ацетат калия.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
CH3COOK + HCl = CH3COOH + KCl
CH3COO — + K + + H + + Cl — = CH3COOH + K + + Cl —
Комментарий: формулы слабых кислот, а также формулы водородсодержащих кислотных остатков слабых кислот в ионных уравнениях записываются целиком.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
серная кислота, оксид серы (VI), гидроксид натрия, бром, силикат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Первый вариант ответа:
Комментарий: формулы нерастворимых веществ в ионных уравнениях реакций записывают целиком.
Второй вариант ответа:
2Na + + 2OH — + 2H + + SO4 2- = 2Na + + SO4 2- + H2O
Комментарий: формулы нерастворимых веществ в ионных уравнениях реакций записывают целиком.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
углекислый газ, сульфат натрия, бром, бромоводород, сульфит калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
2H + + 2Br — + 2K + + SO3 2- = 2K + + 2Br — + H2O + SO2
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидрокарбонат кальция, углерод, сульфид меди, азотная кислота, тетрагидроксоалюминат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
пероксид водорода, фосфат лития, гидрокарбонат калия, гидроксид хрома (III), гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Первый вариант ответа:
K + + OH — + K + + HCO3 — = 2K + + CO3 2- + H2O
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
карбонат натрия, иодоводородная кислота, оксид серы (IV), гидроксид железа (III), хлорид алюминия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
2H + + 2I — + 2Na + + CO3 2- = 2Na + + 2I — + H2O + CO2
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфид железа (II), гидроксид натрия, гидроксид алюминия, нитрит натрия, хлорид аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
Na + + OH — + NH4 + + Cl — = Na + + Cl — + NH3 + H2O
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
иодид натрия, ацетат бария, уксусная кислота, серная кислота, угарный газ. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
Так как в левой и правой частях полного ионного уравнения не обнаруживаются одинаковые ионы, сокращенное ионное уравнение будет совпадать с полным ионным.
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид железа (II), хлорид бария, гидроксид натрия, оксид кремния (IV), концентрированная азотная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидроксид натрия, дихромат калия, хлорид бария, диоксид кремния, соляная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
HCl + NaOH = NaCl + H2O
H + + Cl — + Na + + OH — = Na + + Cl — + H2O
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
дихромат калия, сульфат меди, серная кислота, бромид калия, гидроксид алюминия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
азотная кислота, гидроксид калия, бром, гидроксид хрома (III), серная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Первый вариант ответа:
Второй вариант ответа:
2K + + 2OH — + 2H + + SO4 2- = 2K + + SO4 2- + 2H2O
Третий вариант ответа:
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
карбонат бария, оксид меди (I), концентрированная серная кислота, гидрокарбонат натрия, дихромат натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Первый вариант ответа:
Так как в левой и правой частях полного ионного уравнения не обнаруживаются одинаковые ионы, сокращенное ионное уравнение будет совпадать с полным ионным.
Второй вариант ответа:
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
нитрат калия, углекислый газ, алюминий, гидрофосфат калия, гидроксид калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
K + + OH — + 2K + + HPO4 2- = 3K + + PO4 3- + H2O
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
оксид фосфора (III), азотная кислота, оксид железа (III), оксид серы (IV), карбонат кальция. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
гидроксид алюминия, сульфат меди (II), нитрат железа (II), концентрированная азотная кислота, гидроксид калия
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Первый вариант ответа:
Второй вариант ответа:
Fe 2+ + 2NO3 — + 2K + + 2OH — = Fe(OH)2 + 2K + + 2NO3 —
Третий вариант ответа:
Cu 2+ + SO4 2- + 2K + + 2OH — = Cu(OH)2 + 2K + + SO4 2-
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфат бария, сульфид калия, сульфат натрия, ацетат бария, перманганат калия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Вариант ответа:
2Na + + SO4 2- + 2CH3COO — + Ba 2+ = BaSO4 + 2CH3COO — + 2Na +
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
раствор серной кислоты, гидроксид меди (II), дихромат калия, диоксид кремния, сульфат железа (II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
http://bingoschool.ru/manual/reakczii-ionnogo-obmena/
http://scienceforyou.ru/reshenie-realnyh-zadanij-egje-2016-goda/slozhnye-zadanija-na-reakcii-ionnogo-obmena