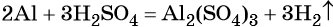Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость.
Влияние природы реагирующих веществ
1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее?
2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
Влияние концентрации реагирующих веществ
В две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30 %-ной соляной кислоты, в другую — 1 мл 10 %-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
Влияние поверхности соприкосновения реагентов
В одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Влияние температуры
В две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
Влияние катализатора
В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца (IV) MnO2 и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет MnO2?
Влияние природы реагирующих веществ
При добавлении кусочка магния в соляную кислоту, выделяется газ:
Mg + 2HCl ⟶ MgCl2 + H2↑
При добавлении кусочка цинка в соляную кислоту, выделяется газ:
Zn + 2HCl ⟶ ZnCl2 + H2↑
При добавлении кусочка меди в соляную кислоту, изменений не наблюдается:
Cu + HCl ⇸
Быстрее протекает реакция с магнием, чем с цинком, т. к. магний в ряду напряжений металлов располагается левее цинка.
В пробирке с соляной кислотой наблюдается более интенсивное выделение газа, чем в пробирке с уксусной кислотой, значит реакция цинка с соляной кислотой протекает быстрее, чем реакция цинка с уксусной кислотой.
Влияние концентрации реагирующих веществ
Цинк быстрее реагирует с 30%-ной соляной кислотой, чем с 10%-ной кислотой потому, что чем больше концентрация кислоты, тем больше число столкновений молекул хлороводорода с атомами цинка.
Zn + 2HCl ⟶ ZnCl2 + H2↑
Влияние поверхности соприкосновения реагентов
Быстрее выделения газа протекает при реакции соляной кислоты с порошком мела, чем с цельным кусочком мела.
2HCl + CaCO3 ⟶ CaCl2 + H2O + CO2↑
Влияние температуры
Реакция цинка с соляной кислотой сопровождается выделением водорода, в нагретой пробирке процесс выделения газа протекает более интенсивно, чем не в нагретой.
Вывод: при повышении температуры скорость химической реакции возрастает.
Влияние катализатора
При внесении тлеющей лучинки в пробирку с перекисью водорода видимых изменений не наблюдается. После добавления оксида марганца (IV) в пероксид водорода наблюдается бурное выделение газа:
2H2O2 MnO₂ ⟶ 2H2O + O2
При повторном внесении тлеющей лучины, наблюдается её воспламенение.
Так как по окончании реакции чёрный порошок оксид марганца (IV) не израсходовался, то значит оксид марганца (IV) в данной реакции является катализатором.
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
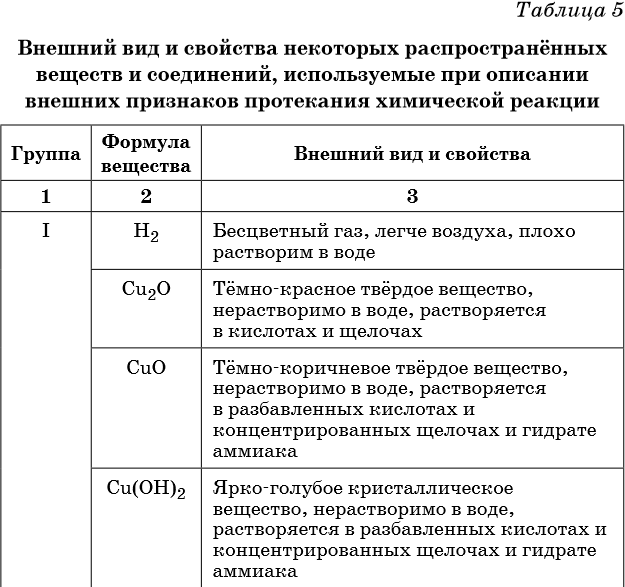
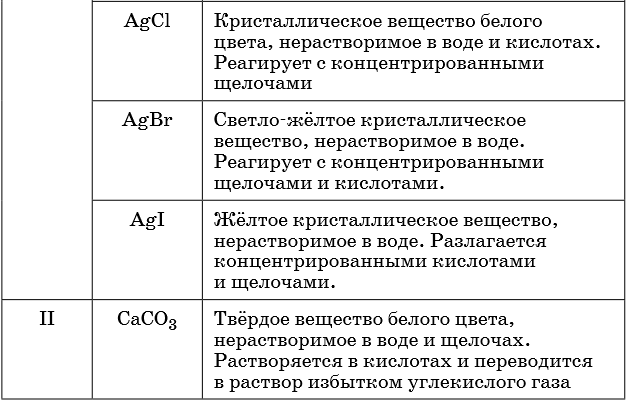
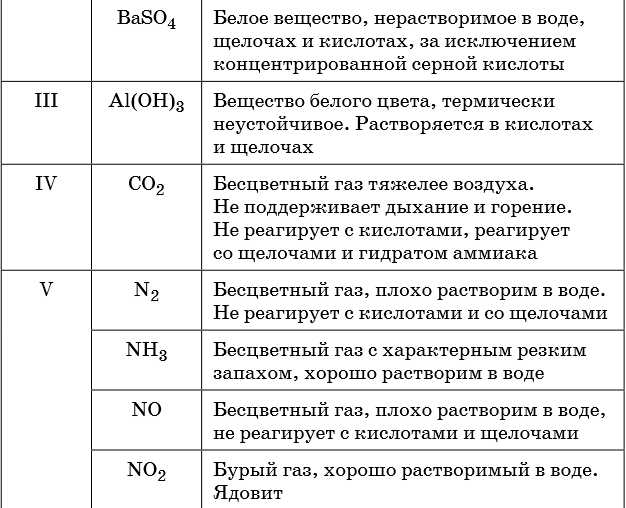
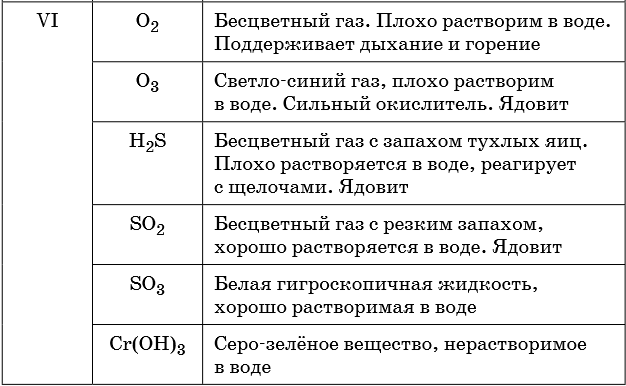
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Практическая работа «Наблюдение признаков химических реакций»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Практическая работа № 6.
«Наблюдение признаков химических реакций»
Цель: Формировать навык описания признаков химических реакций; учиться
отличать физические явления от химических реакций.
В ходе проведения химических опытов выявить и записать в тетрадь признаки химических реакций и физических явлений.
Сделать вывод по работе.
Выполнение работы:
Опыт № 1. Горение свечи. Химическую реакцию можно определить по следующим признакам: свет, тепло, запах, выделение газа, выпадение осадка, изменение цвета. Записываем свои наблюдения: При горении свечи я наблюдаю свет, дым, ощущаю запах и тепло. Пламя от свечи закоптило стекло, значит образовались новые вещества (дым, копоть).
Зарисовать пламя свечи, подписать его части: верхняя – самая горячая, нижняя – самая холодная.
Опыт № 2. Описываем опыт: Щепотку снега помещаем в пробирку и начинаем нагревать. Сначала снег тает и превращается в воду. Продолжаем нагревать пробирку, накрыв её стеклом. Вода начинает закипать, испаряясь и оседая на стекле в виде капель пара. Новых веществ не образовалось, так как вода просто перешла сначала из твёрдого состояния (снег) в жидкое (вода), а затем из жидкого (вода) в газообразное (пар).
Вывод: в первом опыте мы наблюдали признаки химической реакции (дым,
свет, тепло, запах, образование нового вещества – копоти), а во
втором – признаки физического явления (таяние, кипение, испарение;
http://himi4ka.ru/ogje-2018-po-himii/urok-7-himicheskaja-reakcija-uslovija-i-priznaki-protekanija-himicheskih-reakcij-himicheskie-uravnenija-sohranenie-massy-veshhestv-pri-himicheskih-reakcijah.html
http://infourok.ru/prakticheskaya-rabota-nablyudenie-priznakov-himicheskih-reakciy-1769028.html