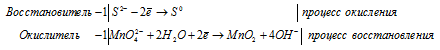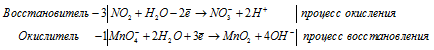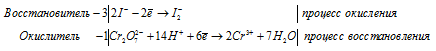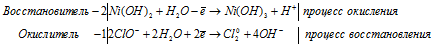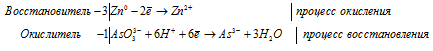Ионно – молекулярные (ионные) реакции обмена
Для решения задач этого раздела рекомендуем воспользоваться литературой 4, 6, 8, 14 и таблицей 7.
Электролиты – вещества, которые в растворенном или расплавленном состоянии проводят электрический ток. При растворении в воде или других полярных растворителях электролиты подвергаются электролитической диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы – катионы и анионы.
Уравнения диссоциации обычно записываются следующим образом:
НСl = Н + + С1 — КОН = К + + ОН —
Нужно иметь ввиду, что эти уравнения только приблизительно отображают подлинный процесс диссоциации, поскольку не показано участие молекул растворителя, без которого сама диссоциация невозможна.
Электролиты практически полностью диссоциирующие на ионы называются сильными электролитами. К ним относятся большинство неорганических солей, гидроксиды щелочных металлов, растворимые гидроксиды щелочноземельных металлов, некоторые минеральные кислоты, например, H2SO4, HNO3, HCl, HI, HBr.
Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами. К ним относятся почти все органические кислоты, некоторые минеральные кислоты, например,H2CO3, H2S, HNO2, H2SO3, HCN, многие основания металлов, а также NH4OH.
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации – ионами. В этом случае можно применить законы химического равновесия и записать выражение константы равновесия. Например, в водном растворе уксусной кислоты устанавливается равновесие:

которое характеризуется константой равновесия (константа диссоциации):

Величина 

В табл. 1 приведены значения констант диссоциации некоторых слабых электролитов.
Количественно процесс электролитической диссоциации выражают с помощью степени диссоциации, т.е. доли молекул, распавшихся на ионы. Её представляют в процентах или в долях единицы:

где n – число молекул, распавшихся на ионы, n0 – общее число растворенных молекул.
Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Пример 1. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а)HCl и NaOH; б) Pb(NO3)2 и Na2S; в) NaClO и HNO3; г) K2CO3 и H2SO4; д) CH3COOH и NaOH.
Решение: запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) HCl + NaOH = NaCl + H2O
б) Pb(NO3)2 + Na2S = PbS 
в) NaClO + HNO3 = NaNO3 + HClO
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (H2O, HClO), осадка (PbS), газа (CO2).
В реакции (д) имеются два слабых электролита — CH3COOH и H2O, но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства: а) Na + и Cl 



а) H + + OH 
б) Pb 2+ + S 
в) ClO 
г) CO 
д) CH3COOH + OH 

Пример 2.Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
а) SO 
б) Pb 2+ + CrO 
в) HCO 


г) ZnOH + + H + = Zn 
Решение: В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например:
Контрольные вопросы:
| 141.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) хлоридом бария и сульфатом алюминия; б) фосфорной кислотой и нитратом кальция; в) ацетатом калия и серной кислотой. |
| 142. Какое из веществ: KCl, FeSO4, Zn(OH)2, NaHCO3 — взаимодействует с раствором гидроксида натрия? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. |
143. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Zn 2+ + H2S = ZnS + 2H + б) Н + + ОН — = Н2 О в) CO  +2H + = CO2 + H2O +2H + = CO2 + H2O |
| 144. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и КОН; б) MnSO4 и (NH4)2S; в) CaСО3 и НCl. |
145.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Pb 2+ + H2S = PbS + 2H + б) Н б) СО  + 2Н + = H2 O + CO2 в) Ba 2 + + SO + 2Н + = H2 O + CO2 в) Ba 2 + + SO  = BaSO4 = BaSO4 |
146.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) СаСО3 + 2Н + = Са 2+ + Н2О + СО2 б) Zn(ОН)2 + 2ОН — = ZnО  + 2Н2О в) Ag + + Cl — = AgCl + 2Н2О в) Ag + + Cl — = AgCl |
| 147.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Cu(ОН)2 + 2Н + = Cu 2+ + 2Н2О б) Fe 2+ + 2ОН — = Fe(ОН)2 в) Н + + OH — = Н2O |
| 148.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(ОН)2 и NaOH; б) Fe(ОН)2 и Н2SO4; в) CuOHCl и HCl. |
| 149. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2CO3 и НNO3; б) Zn(ОН)2 и NaOH; в) Ва(ОН)2 и NiСl2. |
| 150. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na2CO3 и MnSO4; б) К3PO4 и Al2(SO4)3; в) Pb(OH)2 и NaОН. |
| 151. Составьте молекулярные уравнения реакций взаимодействия в растворах между а) FeSO4 и Н2S; б) (NH4)2СО3 и НNO3; в) СrCl3 и NaOH. |
| 152. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между а) Zn(OH)2 и НСl; б) МgSO4 и КОН; в) NH4 Сl и NaОН. |
| 153.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) АgNO3 и К3PО4; б) Рb(NO3)2 и КСl; в) СuSO4 и Na2S. |
154. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe 2+ + S 2-  FeS б) SiO3 2- + 2Н + FeS б) SiO3 2- + 2Н +  Н2SiO3 Н2SiO3 |
| 155.Какое из веществ: NaНСО3, СН3СООН, MnSO4, К2S — взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. |
| 156. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaНСО3 и НNO3; б) Аl(ОН)3 и NaOH; в) ВаСl2 и AgNO3. |
| 157.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H3PO4 и Ва(ОН)2; б) CrCl3 и NH4OH; в) Na2SiO3 и НСl. |
| 158.Какое из веществ: Zn(OH)2, НСl, Fe(OH)2 — будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. |
| 159.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) хлоридом бария и сульфатом алюминия; б) фосфорной кислотой и нитратом кальция; в) ацетатом калия и серной кислотой. |
| 160. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) сульфидом натрия и соляной кислотой; б) сульфатом железа (II) и сульфидом калия; в) иодидом натрия и нитратом свинца. |
Гидролиз солей
Для решения задач этого раздела рекомендуем воспользоваться литературой 4, 6, 8, 14 и таблицами 4,5.
Вода является очень слабым электролитом, степень ее диссоциации равна 
или с учетом гидратации:
На основании законов химического равновесия получим выражение константы диссоциации воды:

По данным измерения электропроводности при температуре 18 0 С 



Если 

При 

Более удобен способ выражения реакции среды с помощью отрицательного десятичного логарифма концентрации водородных ионов, именуемого водородным показателем рН:
В нейтральной среде рН =7; в кислой – рН 7.
Растворениеразличных веществ в воде часто сопровождается химическим взаимодействием обменного характера. Процессы подобного типа объединяют под общим названием гидролиза. Гидролиз – это химический процесс обменного разложения вещества с водой.Гидролиз солей – частный случай взаимодействия растворенных солей с водой, где их составные части соединяются с составными частями воды с образованием соответствующего слабого электролита.
Реакцию гидролиза соли можно представить общим уравнением:
Ионно-молекулярные (ионные) реакции обмена
При решении задач этого раздела см. табл. 9,12 приложения.
Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения,
Пример 1.Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: a) HCl и NaOH; б) Pb(NO3)2 и Na2S; в) NaClO и HNO3; г) К2СО3 и H2SO4; д) СН3СООН и NaOН.
Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) HCl + NaOH = NaCl + H2O
в) NaClO + HNO3 = NaNO3 + HClO
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (Н2О, HClO), осадка (РbS), газа (СО2).
В реакции (д) два слабых электролита, но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства a) Na + и Сl – ; б) Na + и NO – 3; в) Na + и NO – 3; г) К + и SO 2– 4; д) Na + , получим ионно-молекулярные уравнения соответствующих реакций:
б) Pb 2+ + S 2– = PbS
в) Сl – + Н + = НСlO
Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
б) Pb 2 + + CrO 2– 4
г) ZnOH + + H + = Zn 2+ + H2O
В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из, соответствующих растворимых сильных электролитов. Например:
Контрольные вопросы
181.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) NaHCO3 и NaOH; б) K2SiO3 и HCl; в) ВаС12 и Na2SO4.
182.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) K2S и HCl; б) FeSO4 и (NH4)2S; в) Сr(ОН)3 и КОН.
183.Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
184.Какое из веществ: Al(OH)3; H2SO4; Ba(OH)2 – будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
185.Составьте молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) КНСО3 и H2SO4; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3.
186.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между a) CuSO4 и H2S; б) ВаСО3 и HNO3; в) FeCl3 и КОН.
187.Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Сu 2+ + S 2– = CuS
188. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между a) Sn(OH)2 и HCl; б) BeSO4 и КОН; в) NH4Cl и Ва(ОН)2.
189.Какое из веществ: КНСО3, СН3СООН, NiSO4, Na2S – взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
190.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) AgNO3 и К2СrО4; б) Pb(NO3)2 и KI; в) CdSO4 и Na2S.
191.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
в) РЬ 2+ + 2I – = РbI2
192. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Ве(ОН)2 и NaOH; б) Сu(ОН)2 и HNO3; в) ZnOHNO3 и HNO3.
193.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Na3PO4 и CaCl2; б) К2СОз и ВаСl2; в) Zn(OH)2 и КОН.
194.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
195.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) CdS и HCl; б) Сr(ОН)3 и NaOH; в) Ва(ОН)2 и СоСl2.
196.Составьте молекулярные уравнения реакций, которые выражаются ионно-молёкулярными уравнениями:
a) Zn 2+ + H2S = ZnS + 2H +
в) Аg + + Сl – = AgCl
197.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) H2SO4 и Ва(ОН)2; б) FеСl3 и NН4ОН; в) CH3COONa и HCl.
198.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FеСl3 и КОН; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3.
199.Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
200. Какое из, веществ: NaCl, NiSO4, Be(OH)2, KHCO3 – взаимодействует с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
Гидролиз солей
Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды, называется гидролизом.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN, б) Na2СО3, в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение, а) Цианид калия KCN – соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основании КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы К + и анионы CN – . Катионы К + не могут связывать ионы ОН – воды, так как КОН – сильный электролит. Анионы же CN – связывают ионы Н + воды, образуя молекулы слабого электролита HCN. Соль гидролизуется, как говорят, по аниону. Ионно-молекулярное уравнение гидролиза
CN – + H2O 
или в молекулярной форме
KCN + Н2О 
В результате гидролиза в растворе появляется некоторый избыток ионов ОН – , поэтому раствор KCN имеет щелочную реакцию (рН >7).
б) Карбонат натрия Na2СО3 – соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO 2– 3, связывая водородные ионы воды, образуют анионы кислой соли НСО – 3, а не молекулы Н2СО3, так как ионы НСО3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CO 2– 3 + Н2О 
или в молекулярной форме
Na2CO3 + H2O 
В растворе появляется избыток ионов ОН – , поэтому раствор Na2CО3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 – соль слабого многокислотного основания Zn(ОН)2 и сильной кислоты H2SO4. В этом случае катионы Zn 2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образование молекул Zn(OH)2 не происходит, так как ионы ZnOH + диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
Zn 2+ + Н2О 
или в молекулярной форме:
2ZnSO4 + 2Н2О 
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (pH 3+ + Н2О 
CO 2– 3 + H2O 
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН – образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2(Н2СО3). Ионно-молекулярное уравнение:
Контрольные вопросы
201. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и СrСl3. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты.
202. К раствору FeCl3 добавили следующие вещества: a) HCl; б) КОН; в) ZnCl2; г) Na2СОз. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
203. Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, КСl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 7 7 7 7 7 7 7 7 7
Что делает отдел по эксплуатации и сопровождению ИС? Отвечает за сохранность данных (расписания копирования, копирование и пр.).
Живите по правилу: МАЛО ЛИ ЧТО НА СВЕТЕ СУЩЕСТВУЕТ? Я неслучайно подчеркиваю, что место в голове ограничено, а информации вокруг много, и что ваше право.
Что способствует осуществлению желаний? Стопроцентная, непоколебимая уверенность в своем.
ЧТО ПРОИСХОДИТ, КОГДА МЫ ССОРИМСЯ Не понимая различий, существующих между мужчинами и женщинами, очень легко довести дело до ссоры.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
http://zdamsam.ru/b39232.html
http://buzani.ru/zadachi/khimiya-glinka/1213-uravneniya-v-ionno-molekulyarnoj-forme-zadachi-640