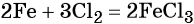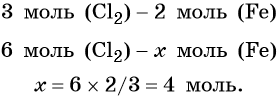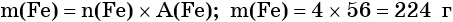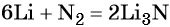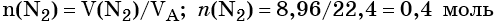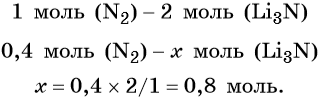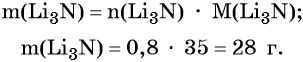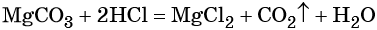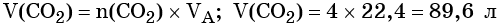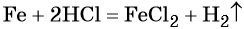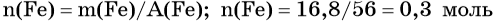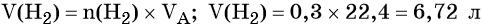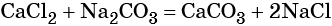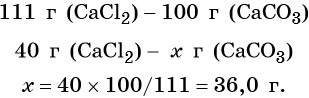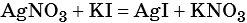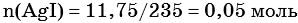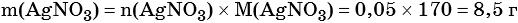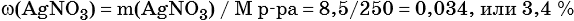Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Методическая разработка на тему «Решение задач на расчеты по уравнениям реакций»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
МКОУ «Кужникская СОШ»
Решение задач на расчеты по уравнениям реакций
(методическая разработка по химии)
Составил: учитель химии и биологии
Нахождение массы (количества) вещества по известной массе (количеству) другого…4
Нахождение объема (массы, количества) одного вещества по известному объему (массе, количеству) другого………………………………………………………………….5
Расчеты на объемные отношения газов в химических реакциях………………………..7
Расчеты по термохимическим уравнениям………………………………………………..8
Расчеты по уравнениям с использованием понятия доля………………………………10
Задачи с использованием понятия «Выход продукта реакции»……………………….11
Расчеты по уравнениям, если одно из веществ дано в избытке………………………..13
Расчеты по уравнениям последовательно протекающих реакций……………………..15
Задачи с образованием кислой соли………………………………………………………..19
Задачи на смеси веществ, в случае параллельно протекающих реакций………………..21
Литература для учителей и учащихся……………………………………………………23
Данная разработка предназначена для использования на уроках химии 8-11 классов, на факультативных и кружковых занятиях по химии, а также при подготовке к ОГЭ и ЕГЭ.
Решение задач на расчеты по уравнениям реакций позволяет контролировать усвоение теоретического материала по химии. Решение задач развивает:
— навыки по составлению химических формул, уравнений реакций;
— навыки по преобразованию формул и физических величин;
— способность логически мыслить;
— знание химической терминологии и понимание сущности описанных в задаче процессов.
При решении расчетных задач учащиеся научатся:
— решению различных типов задач;
— решению усложненных задач;
— разным методам решения;
— составлению плана решения;
— оценке правильности полученных результатов;
— самостоятельному составлению химических задач и объяснению их решения.
Основные типы расчетных задач.
Нахождение массы (количества) вещества по известной массе (количеству) другого.
Нахождение объема (массы, количества) одного вещества по известному объему (массе, количеству) другого.
Расчеты на объемные отношения газов в химических реакциях.
Расчеты по термохимическим уравнениям.
Расчеты по уравнениям с использованием понятия доля.
Задачи с использованием понятия «Выход продукта реакции».
Расчеты по уравнениям, если одно из веществ дано в избытке.
Расчеты по уравнениям последовательно протекающих реакций.
Задачи на смеси веществ.
Задачи с образованием кислой соли.
Задачи на смеси веществ, в случае параллельно протекающих реакций.
Нахождение массы (количества) вещества по известной массе (количеству) другого.
1. Какое количество вещества и масса оксида фосфора ( V ) получится при сгорании фосфора массой 6,2 г.
Можно решать методом пропорций и через количество вещества.
1.Запишем уравнение реакции; подчеркнем что знаем, и что необходимо найти:
2.Найдемм количество известного вещества:
ν ( P ) = 

3.Запишем количества под формулами, делаем вывод о том, что количество вещества P 2 О5 в 2 раза меньше, чем количество вещества P и находим его количество:
0,2 моль 0,1 моль
m ( P 2 О5 ) = ν•М = 0,1 моль • 142 г/моль = 14,2 г
2. Железные опилки массой 5,6 г поместили в раствор, содержащий соответствующее количество вещества сульфата меди ( II ). Вычислите количество вещества и массу выделившейся по окончании реакции меди.
3. Найдите массу гидроксида калия, необходимого для полной нейтрализации раствора, содержащего 73 г соляной кислоты. Какова масса соли, образующейся при этом?
4. Вычислите массу осадка, выпадающего при взаимодействии раствора, содержащего 32 г сульфата меди ( II ) с избытком раствора гидроксида натрия.
5. Рассчитайте количество вещества и массу оксида железа ( III ) в реакции с серной кислотой, необходимой для получения 50 г сульфата железа ( III ).
6. Вычислите массу жженой извести, получающейся при обжиге 10 т известняка.
1.Запишем уравнение реакции; отметим что дано, и что необходимо найти:
2.Составим пропорцию и решим:



7. Какую массу жженой извести нужно взять для получения 100 кг гашеной извести?
Нахождение объема (массы, количества) одного вещества по известному объему (массе, количеству) другого.
8. Какое количество вещества и объем водорода (н. у.) выделится при взаимодействии 1,08 г алюминия с достаточным объемом соляной кислоты?
1.Запишем уравнение реакции; подчеркиваем что знаем, и что необходимо найти:
2.Найдем количество известного вещества:
ν ( Al ) = 

3.Запишем количества под формулами, делаем вывод о том, что количество вещества H 2 в 1.5 раза больше, чем количество вещества Al , и находим его количество:
0,04 моль 0,06 моль
4.Рассчитаем объем H 2 :
V ( H 2 ) = ν• Vm = 0,06 моль • 22,4 л/моль = 1,344 л
ν ( H 2 ) = 0,06 моль
V ( H 2 ) = 1,344 л
9. Гранулы цинка массой 13 г поместили в раствор серной кислоты. Какой объем водорода (н. у.) выделится после полного растворения данной массы цинка?
10. Вычислите количество вещества и объем углекислого газа (н. у.), выделяющегося в реакции 25 г мела с соляной кислотой.
11. Какой объем (н. у.) кислорода и водорода можно получить разложением 200 мл воды постоянным током?
12. Рассчитайте количество вещества и массу перманганата калия, которого нужно разложить для получения 5 л кислорода (н. у.).
13. Для заполнения метеозондов часто применяют получение водорода реакцией гидрида кальция СаН2с водой. Какую массу гидрида кальция необходимо взять для реакции с водой, чтобы получить 300 л водорода (н. у.)?
14. Какой минимальный объем водорода (н. у.) необходим для полного восстановления железа из 100 кг магнитного железняка Fe 3 O 4 ?
Расчеты на объемные отношения газов в химических реакциях.
15. 200 л водорода сожгли в атмосфере хлора. Какой объем хлороводорода при этом получится? Все объемы приведены к н. у.
Такие задачи легче решать методом пропорций.
1.Запишем уравнение реакции; отметим что знаем, и что необходимо найти:
2.Запишем объемы газов согласно стехиометрическим коэффициентам:
3.Составим пропорцию и решим:



16. Найдите объем кислорода и объем воздуха, расходующегося на полное сгорание 100 м 3 метана.
17. Вычислите объемы азота и водорода, которые должны прореагировать, для получения 500 м 3 аммиака.
18. Какой объем водорода расходуется на полное гидрирование 150 л ацетилена?
19. Вычислите объем хлора, необходимого для полного хлорирования 300 мл метана.
20. Сколько м 3 углекислого газа выделится в результате полного сгорания 1 м 3 пропана? Какой объем кислорода при этом израсходуется?
Расчеты по термохимическим уравнениям.
21. По термохимическому уравнению
4 P + 5 O 2 = 2 P 2 O 5 + 3010 кДж
1)вычислите количество теплоты, выделяющейся при сгорании 62 г фосфора;
1.Запишем уравнение реакции; подчеркнем что дано, и что необходимо найти. Запишем данные по уравнению:
3.Составим пропорцию и решим:



2) вычислите массу образовавшегося оксида фосфора ( V ), если в реакции выделилось 9030 кДж теплоты.
1.Запишем уравнение реакции; подчеркнем что дано, и что необходимо найти. Запишем данные по уравнению:
3.Составим пропорцию и решим:



22. По термохимическому уравнению
1)найдите количество теплоты, выделяющейся в результате сгорания 336 л ацетилена; Ответ: 10 500 кДж
2)рассчитайте объем (н. у.) ацетилена, который нужно сжигать для получения 7000 кДж теплоты. Ответ:22,4 л
23. При сжигании 1,2 г магния выделилось 30,1 кДж теплоты. Составьте термохимическое уравнение этой реакции.
1. C оставим уравнение реакции; запишем данные по уравнению:
2 Mg + O 2 = 2 MgO + Q
2.Составим пропорцию и решим:



3.Запишем уравнение заново, вместо Q подставим полученное число:
2 Mg + O 2 = 2 MgO + 1 204 кДж
24. В результате сгорания 9 г алюминия выделилось 273,5 кДж теплоты. Составьте термохимическое уравнение этой реакции.
25. Теплота сгорания пропана равна 2202 кДж/моль. Какое количество теплоты выделится при сгорании 224 л пропана? 10 м 3 пропана? (н. у.).
Ответ: 22020 кДж; 983 036 кДж
26. Теплота образования аммиака 46 кДж/моль.
1)Найдите количество теплоты, выделяющейся в результате образования 5 моль аммиака; 44,8 л аммиака (н. у.). Ответ: 230 кДж; 92 кДж
2)Вычислите количество теплоты, выделяющейся в результате соединения 0,5 моль азота с водородом. Ответ:46 кДж
Расчеты по уравнениям с использованием понятия доля.
27. Какое количество вещества и массу гидроксида натрия нужно для полной нейтрализации 120 г 6%-ного раствора серной кислоты?
w = 
1.Запишем уравнение реакции; подчеркнем что знаем, и что необходимо найти:
2.Находим количество известного вещества:
ν (H2SO4) = 

3.Запишем количества под формулами, делаем вывод о том, что количество вещества NaOH в 2 раза больше, чем количество вещества H 2 SO 4 , и находим его количество:
0,147 моль 0,0735 моль
4.Рассчитаем массу NaOH :
m ( NaOH ) = ν • М = 0,147 моль • 40 г/моль = 5,88 г
ν ( NaOH ) = 0,147 моль
m ( NaOH ) = 5,88 г
28. Какую массу гидроксида калия необходимо взять для нейтрализации 80 мл 30% — ной азотной кислоты плотностью 1,18 г/мл?
29. Для реакции со 100 г раствора сульфата меди ( II ) был израсходован раствор, содержащий 3,9 г сульфида натрия. Вычислите массовую долю сульфата меди ( II ) в исходном растворе.
30. На полную нейтрализацию 50 г раствора соляной кислоты израсходовано 15 г 5%-ного раствора гидроксида калия. Вычислите массовую долю кислоты в исходном растворе.
31. Технический цинк, массой 20 г и содержащий 2% нерастворимых примесей, поместили в избыток соляной кислоты. Какой объем водорода (н. у.) выделится при этом?
w чист = 
1.Запишем уравнение реакции; подчеркнем что знаем, и что необходимо найти:
2.Найдем количество известного вещества:
ν (H2SO4) = 

3.Запишем количества под формулами, делаем вывод о равенстве количества вещества цинка и водорода:
0,3015 моль 0,3015 моль
4.Рассчитаем объем водорода:
V ( H 2 ) = ν• Vm = 0,3015 моль • 22,4 л/моль = 6,75 л
32. Какую массу фосфорной кислоты можно получить воздействием серной кислоты на 50 кг фосфорита, содержащего 16% процентов примесей?
Задачи с использованием понятия «Выход продукта реакции».
33. На получение 450 л хлороводорода (н. у.) было из расходовано 250 л хлора. Вычислите выход хлороводорода по сравнению с теоретическим.
V ( Cl 2 ) = 250 л
V прак ( HCl ) = 450 л
φ вых =
1.Находим по уравнению реакции V теор :



2.Рассчитаем объемную долю выхода HCl
φ вых = 

34. Окислением 140 м 3 (н. у.) этилена кислородом (процесс Вакера), было получено 200 кг ацетальдегида. Рассчитайте выход ацетальдегида по сравнению с теоретически возможным.
35. Гидратацией 250 м 3 (н. у.) этилена было получено 600 л 95%-ного этанола (ρ=0,8 кг/л). Вычислите выход этанола по сравнению с теоретическим.
36. Какая масса фосфора может быть получена из 10 т фосфорита, содержащего 20% примесей, если выход составляет 85% по сравнению с теоретически возможным.
37. Какой объем аммиака (н. у.) нужно израсходовать на производство 30 т 60%-ной азотной кислоты, если выход ее составляет 88%?
η вых = 88%, или 0,88
η вых =
w = 
соотношение масс и объемов:
1.Процесс производства HNO 3 описывается следующими уравнениями реакций:
Исходя из данных уравнений, составляем стехиометрическую схему: NH3 → HNO3
2.Находим массу чистой азотной кислоты:
m ( HNO 3 ) = 30 т • 0,6 = 18 т = 18000 кг – должно получиться практически
m теор ( HNO 3 ) = 

3.Подставим в уравнение и рассчитаем объем аммиака:



V ( NH 3 ) = 7273 м 3
38. Какая масса серной кислоты может быть получена из 100 т пирита, содержащего 5% примесей, при выходе 90%?
Расчеты по уравнениям, если одно из веществ дано в избытке.
39. Гидроксид натрия массой 8 г добавили к 50 г 5% — й соляной кислоты.
1)Найдите количество вещества и массу образовавшейся соли.
2)Рассчитайте массовую долю соли в образовавшемся растворе.
m р-ра ( HCl ) = 50 г
w ( HCl ) = 5%, или 0,05
w = 
1.Запишем уравнение реакции;
NaOH + HCl = NaCl + H 2 O
2.Найдемм количества веществ, массы которых даны:
ν ( Na ОН) = 

ν ( HCl ) = 

3.По уравнению реакции делаем вывод о том, что количество вещества NaOH дано в избытке, и записываем количество вещества HCl под формулой в уравнении:
NaOH + HCl = NaCl + H 2 O
4.Делаем вывод о том, ν ( NaCl ) равно ν (Н Cl )
NaOH + HCl = NaCl + H 2 O
0,0685 моль 0,0685 моль
5.Рассчитаем массу NaCl :
m ( NaCl ) = ν • М = 0,0685 моль • 58,5 г/моль = 4 г
6.Найдем массовую долю NaCl в образовавшемся растворе, предварительно рассчитав массу этого раствора
m (р-ра) = 50 + 8 = 58 г
w ( NaCl ) = 

1) ν (NaCl) = 0,0685 моль
40. 30 г 7% — ного раствора гидроксида калия смешали с 40 г 6%-ного раствора азотной кислоты.
1)Найдите массу образовавшейся соли. Ответ: m ( KNO 3 ) = 3.85 г
2)Вычислите массовую долю соли в полученном растворе. w ( KNO 3 ) = 5.5%
41. 200 мл 10%-й соляной кислоты плотностью 1,05 г/мл прилили к 300 г 8% раствора карбоната натрия.
1)Вычислите количество вещества и массу образовавшейся соли.
2)Какова массовая доля этой соли в получившемся растворе? w (NaCl) = 4.62%
42. Оксид магния массой 4 г поместили в 80 мл раствора серной кислоты, массовой долей 0,2 и плотностью 1,14 г/мл.
1)Какое количество вещества и масса соли при этом образуется?
2)Рассчитайте массовую долю соли в полученном растворе. w ( MgSO 4 ) = 18.61%
3)Какова массовая доля кислоты в получившемся растворе? w ( H 2 SO 4 ) = 4.57%
43. Цинк массой 13 г поместили в 90 г 25% -ной соляной кислоты.
1)Найдите объем (н. у.) газа, выделяющегося при этом. Ответ: V ( H 2 ) = 4.48 л
2)Найдите массовую долю соли в полученном растворе. w ( ZnCl 2 ) = 26,51%
3)Вычислите массовую долю кислоты в образовавшемся растворе. w ( HCl )=7.68%
44. 20 г 2% -ного раствора нитрата серебра ( I ) прилили к 25 г 1,5% -ного раствора фосфата калия.
2)Вычислите массовые доли солей в образовавшемся растворе. w ( KNO 3 ) = 0.64%
Расчеты по уравнениям последовательно протекающих реакций.
45. Хлор, полученный взаимодействием 30 мл 36%-ной соляной кислоты (плотностью 1,18 г/мл) с необходимым количеством оксида марганца ( IV ), пропустили через избыток раствора иодида калия. Вычислите массу иода, способного выделиться при этом.
V р-ра ( HCl ) = 30 мл
w ( HCl ) = 36%, или 0,36
w = 
ρ = 
m = ρ 
1.Записываем уравнения реакций, описанных в условии задачи; подчеркиваем что знаем, и что необходимо найти:
2.Находим количество известного нам вещества:
ν (HCl) = 

3.По уравнению (1) делаем вывод о том, что количество вещества Cl 2 в 4 раза меньше, чем количество вещества HCl , и находим его количество:
0,35моль 0,0873 моль
4.Делаем переход на уравнение (2) и вывод о количестве вещества I 2 :
0,0873 моль 0,0873 моль
5.Находим массу I 2 :
m ( I 2 ) = ν • М = 0,0873 моль • 254 г/моль = 22,17 г
m ( I 2 ) = 22,17 г
46. Газ, полученный взаимодействием перманганата калия с концентрированной соляной кислотой, пропустили через раствор иодида калия. Какую минимальную массу перманганата калия нужно израсходовать в ходе этих реакций, для выделения 25,4 г иода?
47. Сернистый газ, полученный при сжигании 6.4 г серы, пропустили через избыток раствора гидроксида натрия. Найдите массу соли, образовавшейся в данной реакции.
48. 3,2 г меди внесли в 20 мл 70%-ной азотной кислоты (плотность раствора 1,35 г/мл). Выделившийся газ полностью поглощен раствором гидроксида натрия. Вычислите массы солей, образовавшихся в этих реакциях.
49. В 200 г 2.5%-ного раствора гидроксида натрия на некоторое время поместили алюминиевую пластинку. После того, как пластинку извлекли из раствора, ее масса уменьшилась на 2,7 г. Далее, через этот раствор пропустили избыток углекислого газа.
1)Вычислите массу соли, образовавшейся в ходе этих реакций.
2)Найдите массовую долю этой соли в получившемся растворе.
m р-ра ( NaOH ) = 200 г
w ( NaOH ) = 2.5%, или 0,025
1. Составим уравнения реакций.
2 Al + 2 NaOH + 6 H 2 O = 2 Na [ Al ( OH )4] + 3 H 2
2.Рассчитаем количества веществ, данных по условию:
ν ( NaOH ) = 

ν ( Al ) = 

по ур-ю (1) NaOH в избытке, которая также реагирует с СО2
3.Запишем количества под формулами, молярные массы и массы
0,1 0,125- в избытке 0,1 0,15
0,1 — израсход. 2 г/моль
0,025 – остаток 0,3 г
суммируем 0,125 0,125
44 г/моль 84 г/моль
4.Найдем массовую долю NaHCO 3
w ( NaHCO 3 ) = 
50. Цинк массой 6,5 г растворили в 140 г 5%-ного раствора гидроксида калия. А затем, через этот раствор пропустили избыток сероводорода.
1)Найдите массы солей, образовавшихся в этой реакции.
2)Какова массовая доля соли в полученном растворе?
Задачи на смеси веществ.
51. Смесь железа и алюминия массой 5 г обработали раствором гидроксида натрия, при этом выделилось 3,36 л газа (н. у.). Рассчитайте массовые доли элементов в исходной смеси.
m смеси ( Al и Fe ) = 5 г
1.Составим уравнение реакции. В данном случае одно из веществ в смеси не реагирует, это Fe , а весь выделившийся водород – в реакции с алюминием:
2.Находим количество вещества водорода:
ν ( H 2 ) = 

3.По уравнению реакции находим количество вещества алюминия, зная, что он в 1,5 раз меньше количества H 2 :
0,1 моль 0,15 моль
4.Вычислим массу алюминия и массовые доли металлов в смеси:
m ( Al ) = ν • М = 0,1моль • 27 г/моль = 2,7 г
w ( Al ) = 

w (Fe) = 100 – 54 = 46%
52. Медно-цинковый сплав массой 7 г поместили в соляную кислоту. В ходе этой реакции выделилось 1,12 л газа (н. у.). Вычислите массовые доли металлов в исходном образце сплава.
53. 4 г смеси кремния и оксида кремния ( IV ) растворили в избытке щелочи. В результате выделился газ, способный восстановить 22,3 г оксида свинца ( II ). Найдите массовую долю кремния в исходной смеси.
54. Смесь оксида алюминия и алюминия массой 7,5 г растворили в избытке щелочи. При этом выделился газ, который может восстановить 17,4 г оксида вольфрама ( VI ) до металла. Каковы массовые доли веществ в исходной смеси?
55. В реакции смеси сульфида алюминия и алюминия с водой выделилось 6,72 л (н.у.) газа. Такая же смесь с избытком раствора гидроксида натрия дает 3,36 л (н.у.) газа. Вычислите массовую долю алюминия в исходной смеси.
56. 20 г смеси состоящей из карбоната и гидрокарбоната натрия прокалили. При этом масса смеси уменьшилась на 6,2 г. Рассчитайте массовые доли веществ в исходной смеси.
Задачи с образованием кислой соли.
57. Раствор гидроксида калия, массой 112 г и массовой долей 10%, прилили к 49,5 мл 18%-ного раствора фосфорной кислоты, плотностью 1,1 г/мл.
1)Вычислите количество вещества и массу получившейся соли.
2)Какова массовая доля соли в получившемся растворе?
w (КОН) = 10%, или 0,1
1.С многоосновной кислотой возможно образование разных солей – средней и кислых, поэтому нужно сначала рассчитать, в каких отношения взяты кислота и соль.
ν (КОН) = 

ν (H3PO4) = 

2.Исходя из найденных количеств, составляем уравнение реакции и делаем вывод о количестве полученной соли:
3.Вычислим массу гидрофосфата:
m (К2 HPO 4 ) = ν • М = 0,1моль • 174 г/моль = 17,4 г
4.Найдем массовую долю К2 HPO 4 в получившемся растворе:
m р-ра = 112 + 49,5 • 1,1 = 166,5 г
w (К2 HPO 4 ) = 
58. 196 мл раствора фосфорной кислоты с массовой долей 0,2 и плотностью 1,25 г/мл прореагировал с 400 г 5%-ного раствора гидроксида натрия.
1)Найдите количество вещества и массу образовавшейся соли.
2)Вычислите массовую долю соли в полученном растворе.
59. 224 г 5%-ного раствора гидроксида калия полностью поглотил углекислый газ объемом 3,36 л (н.у.).
1)Вычислите массы солей, образовавшихся в этой реакции.
2)Рассчитайте массовые доли солей в полученном растворе.
w (КОН) = 5%, или 0,05
1. Рассчитаем, в каких отношения взяты кислота и соль.
ν (КОН) = 

ν (СО2) = 

2.Исходя из найденных количеств, составляем уравнение реакции и делаем вывод о количестве полученных солей; в общем процесс можно представить так:
0,2 моль 0,1 моль 0,1 моль
(первоначально соединяется 0,1 моль СО2 с 0,2 моль КОН, а затем – остальные 0,05 моль СО2)
0,05 моль 0,05 моль 0,1 моль
В растворе остается: 0,1 – 0,05 = 0,05 моль К2СО3
3.Вычислим массы солей:
m (К2СО3) = ν • М = 0,05 моль • 138 г/моль = 6,9 г
m (КНСО3) = ν • М = 0,1 моль • 100 г/моль = 10 г
4.Найдем массовые доли солей в получившемся растворе, предварительно рассчитав массу раствора:
m (СО2) = 0,15 моль• 44 г/моль = 6,6 г
m р-ра = 224 + 6,6 = 230,6 г
w (К2СО3) = 
w (КНСО3) = 
60. Аммиак объемом 2,8 л был поглощен 49 г раствора фосфорной кислоты с массовой долей 0,1. Вычислите массы образовавшихся солей.
Задачи на смеси веществ, в случае параллельно протекающих реакций.
61. Сплав цинка и алюминия массой 4 г обработали избытком раствора гидроксида натрия. В этой реакции выделилось 3,808 л водорода (н.у.). Вычислите массовые доли элементов в данном сплаве.
m смеси (и Al ) = 4 г
V ( H 2 ) = 3.808 л
1.Запишем уравнения протекающих реакций:
2.Находим количество вещества водорода:
ν ( H 2 ) = 

3.По уравнению реакции находим количество вещества алюминия, зная, что он в 1,5 раз меньше количества H 2 :
0,1 моль 0,15 моль
4.Вычислим массу алюминия и массовые доли металлов в смеси:
m ( Al ) = ν • М = 0,1моль • 27 г/моль = 2,7 г
w ( Al ) = 

w (Fe) = 100 – 54 = 46%
62. Смесь стружек магния и цинка массой 5,56 г растворили в избытке соляной кислоты. Рассчитайте массовые доли металлов в смеси, если в этой реакции было получено 3,36 л газа (н.у.).
63. Образец сплава алюминия, цинка и меди массой 8 г обработали избытком концентрированного раствора гидроксида натрия. При этом выделился газ объемом 4,48 л (н.у.). Масса нерастворимого остатка составила 2,05 г. Найдите массовые доли металлов в исходном образце.
64. Смесь карбонатов кальция и магния общей массой 7,1 г растворили в азотной кислоте. По окончании реакции было собрано 1,68 л газа (н.у.). Вычислите массовые доли карбонатов в исходной смеси.
65. 4,15 г смеси муравьиной и уксусной кислот нейтрализовали 10%-ным раствором гидроксида натрия. На это было израсходовано 27,03 мл раствора плотностью 1,11 г/мл. Каковы массовые доли кислот в исходной смеси?
66. Смесь метилового и этилового спиртов массой 5,24 г прореагировал с металлическим натрием, взятым в избытке. Рассчитайте массовые доли спиртов в исходной смеси, если в этой реакции выделилось 1,344 л газа (н.у.).
Литература для учителей и учащихся.
1. Химия. Задачник. 8-11 кл.: Учеб. пособие для общеобразоват. Учеб. Заведений / Я. Л. Гольдфарб, Ю. В. Ходаков, Ю. В. Додонов. – 4-е изд., стереотип. – М.: Дрофа, 2002. – 272 с.: ил.
2. Хомченко И. Г. Сборник задач по химии для средней школы. – 2-е изд., испр. и доп.М.: РИА. «Новая волна», издатель Умеренков, 2011 . – 214 с.
3. Хомчеко Г. П., Хомченко И. Г. Сборник задач по химии для поступающих в вузы. – 4-е изд., испр. и доп.М.: РИА. «Новая волна», издатель Умеренков, 2013 . – 278 с.
4. Рябов М. А. Сборник задач и упражнений по химии: 8-9 классы: к учебникам Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия. 8 кл.», «Химия. 9 кл.». ФГОС – 3-е изд. доп. и перераб. М.: Изд. «Экзамен», 2018 – 335 с.
5. Рябов М. А. Сборник задач и упражнений по химии: 10-11 классы: к учебникам Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия. 10 кл.», «Химия. 11 кл.». ФГОС – 3-е изд. доп. и перераб. М.: Изд. «Экзамен», 2017 – 336 с.
Расчеты массы вещества по уравнению химической реакции
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
При решении расчетных химических задач необходимо умение производить вычисления по уравнению химической реакции. Урок посвящен изучению алгоритма расчетов массы (объема, количества) одного из участников реакции по известной массе (объему, количеству) другого участника реакции.
http://infourok.ru/metodicheskaya-razrabotka-na-temu-reshenie-zadach-na-raschety-po-uravneniyam-reakcij-5061750.html
http://interneturok.ru/lesson/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii