Характерные и специфические реакции катионов марганца
Прочитайте:
|
1.Окисление Mn 2+ до MnO4 — .
Наиболее характерной и специфической реакцией на катионы марганца, позволяющей открывать их следы, в присутствии катионов всех аналитических групп, является реакция окисления Mn 2+ до перманганат – иона MnO4 — , который обладает интенсивной малиновой окраской.
a) Окисление Mn 2+ диоксидом свинца PbO2 в сильно кислой среде.
В пробирку помещают небольшое количество (взятое на кончике шпателя) порошка PbO2 или Pb3O4, приливают 5-6мл 2н раствора HNO3, 1-2 капли разбавленного в 10 раз анализируемого раствора на Mn 2+ и содержимое пробирки нагревают в вытяжном шкафу до кипения. При наличии в растворе Mn 2+ жидкость в пробирке принимает малиновую окраску

Mn 2+ + 4H2O – 5e → MnO4 — + 8H + 2
PbO2 + 4H + + 2e → Pb 2+ + 2H2O 5



2Mn 2+ + 8H2O + 5PbO2 + 20H + → 2MnO4 — + 16H + + 10H2O

б) Окисление Mn 2+ пероксиддисульфатом аммония в кислой среде.
В результате реакции окисления – восстановления рвется связь в кислородном мостике в пероксиддисульфате.
В структурном виде формула пероксиддисульфата аммония:

Mn 2+ + 4H2O – 5e → MnO4 — + 8H + 2

В пробирку помещают небольшое количество твердого (NH4)2S2O8 приливают 5мл 2н раствора HNO3 (для создания кислой реакции), 5 капель 0,01н AgNO3 содержимое пробирки нагревают до 70° и прибавляют несколько капель разбавленного анализируемого раствора на Mn 2+ , если присутствует катион марганца, то жидкость в пробирке окрашивается в розово – малиновый цвет. Нитрат серебра AgNO3 в данной реакции является катализатором.
в) Окисление Mn 2+ до MnO2 (в щелочной среде) к отдельной пробе раствора приливают KOH. При этом все катионы пятой аналитической группы выпадают в осадок в виде гидроксидов, которые имеют белый цвет (гидроксид висмута, магния и сурьмы), или же бурый цвет (гидроксид железа (III) и марганца). Если к полученному осадку гидроксидов прибавить несколько капель пероксида водорода H2O2 и нагреть до кипения, то при наличии Mn 2+ осадок темно – бурого цвета Mn 2+ переходит в MnO2. Катионы пятой аналитической группы, за исключением катионов железа в очень больших концентрациях, не мешают открытию катионов Mn 2+ этой реакцией.
Из катионов других аналитических групп этой реакции мешают: катионы Cu 2+ , Co 2+ , Ni 2+ , Hg2 2+ , Hg 2+ , Ag + .
темно – бурый осадок
2) Капельная реакция с AgCl (Н.А. Тананаева).
На фильтровальную бумагу наносим каплю разбавленной соляной кислоты, а в центр влажного пятна поместить каплю с аммиачным раствором нитрата серебра, образуется при этом осадок AgCl. Тщательно промыть, держа в центре пятно, капилляр водой, пока диаметр пятна не увеличится в 2-3 раза. Промытый осадок смочить каплей исследуемого раствора и прилить небольшую каплю 25% NaOH. В присутствии Mn 2+ влажное пятно чернеет из-за выделения металлического серебра Ag:
Дата добавления: 2015-09-03 | Просмотры: 1658 | Нарушение авторских прав
Лабораторные работы по общей и неорганической химии
| Название | Лабораторные работы по общей и неорганической химии |
| Анкор | Laboratornye_raboty_po_neoranicheskoy_khimii_2015.doc |
| Дата | 14.12.2017 |
| Размер | 1 Mb. |
| Формат файла |  |
| Имя файла | Laboratornye_raboty_po_neoranicheskoy_khimii_2015.doc |
| Тип | Методические рекомендации #11455 |
| страница | 12 из 14 |
| Подборка по базе: Лабораторные работы-2.pdf, Организация работы приемного отделения.docx, Титульный лист курсовой работы .doc, План работы Артемовского сельского филиала на март месяц 2022.do, Программа групповой работыс родителями.pdf, БЖД.Задание для самостоятельной работы по Теме 1.docx, 02-Архитектура и принципы работы ЭВМ.pptx.pdf, Лабораторные работы _Маневрирование и Управление судном_Метод ук, Методы работы с родителями по развитию творческих способностей в, Темы самостоятельной работы студентов.docx 3. Аналитические реакции катиона марганца (II), Mn 2+ 3.1 Реакция с висмутатом натрия, NaBiO3. Ионы Mn 2+ в азотнокислой среде окисляются висмутатом натрия до ионов MnO4 — , окрашивающих раствор в малиновый цвет: 2Mn 2+ + 5NaBiO3 + 4H + 2MnO4 — + 5BiO + + 5Na + + 2H2O Выполнение реакции: внести в пробирку на кончике шпателя немножко порошка висмутата натрия. Прибавить 2 мл 2 М раствора азотной кислоты и 1-2 капли раствора соли марганца (II). Малиновый цвет раствора указывает на образование иона MnO4 — . Записать наблюдение и уравнение реакции в молекулярном и ионно-молекулярном виде. Групповым реагентом на катионы VI аналитической группы является 25% раствор NH3. При действии избытка раствора аммиака на раствор, содержащий катионы VI аналитической группы, образуются окрашенные растворы комплексных соединений — аммиакатов. 1. Аналитическая реакция катиона меди (II), Cu 2+ 1.1 Реакция с раствором аммиака. Катионы Cu 2+ с избытком концентрированного раствора аммиака образуют комплексное соединение — аммиакат меди, окрашенный в ярко-синий цвет: Выполнение реакции: поместить в пробирку 2-3 капли раствора соли меди (II) и прибавить к нему 4-6 капель 25% раствора аммиака. Обратить внимание на цвет раствора. Записать наблюдение и уравнение реакции в молекулярном и ионно-молекулярном виде. 2.1 Реакция с раствором аммиака. Катионы Со 2+ с избытком концентрированного раствора аммиака образуют комплексное соединение — аммиакат кобальта (II) [Co(NH3)6] 2+ , окрашенное в светло-коричневый цвет: Выполнение реакции: поместить в пробирку 2-3 капли хлорида кобальта (II) и прибавить 1-2 капли 25% раствора аммиака. Наблюдается выпадение синего осадка основной соли кобальта (II) — CoOHCl. Растворить осадок в избытке 25% раствора аммиака. Записать наблюдения и уравнения реакций в молекулярном и ионно-молекулярном виде. 2.2 Реакция с роданидом аммония, NH4SCN (или роданидом калия, KSCN). Катионы Со 2+ в нейтральной или слабокислой среде с роданид-ионами образуют комплексный ион [Co(SCN)4] 2- , окрашенный в синий цвет: Со 2+ + 4SCN — [Co(SCN)4] 2- Выполнению реакции мешают ионы Fe 3+ , образующие с роданид-ионом комплексное соединение кроваво-красного цвета. Поэтому при определении ионов Со 2+ реакцией с роданид-ионом в присутствии Fe 3+ в реакционную смесь добавляют сухую соль фторида натрия (или аммония) для связывания ионов Fe 3+ в прочный бесцветный комплекс [FeF6] 3- . Выполнение реакции: поместить в пробирку 2-3 капли раствора соли кобальта (II), 5-6 капель насыщенного раствора роданида аммония (или калия) и 5-6 капель смеси изоамилового спирта с эфиром. Встряхнуть пробирку. Образующееся комплексное соединение экстрагируется в верхний органический слой и окрашивает его в синий цвет. Записать наблюдение и уравнение реакции в молекулярном и ионно-молекулярном виде. 3.1 Реакция с раствором аммиака. Катионы Ni 2+ с раствором аммиака вначале образуют светло-зеленый осадок основной соли никеля (II), который растворяется в избытке концентрированного раствора аммиака с образованием синего раствора аммиаката никеля [Ni(NH3)6] 2+ : Выполнение реакции: поместить в пробирку 2-3 капли раствора хлорида никеля (II) или другой соли никеля (II) и прибавить по каплям 25% раствор аммиака до образования светло-зеленого осадка основной соли никеля (II), а затем избыток 25% раствора аммиака до растворения осадка. Обратить внимание на цвет образовавшегося раствора. Записать наблюдения и уравнения реакций в молекулярном и ионно-молекулярном виде. 3.2 Реакция с диметилглиоксимом (реактив Чугаева), C4H8N2O2. Катионы Ni 2+ в аммиачной среде (рН = 9) с диметилглиоксимом образуют малорастворимую внутрикомплексную соль ярко-красного цвета: Выполнение реакции: поместить в пробирку 2-3 капли раствора соли никеля (II), прибавить к нему 5-6 капель 25% раствора аммиака и 2-3 капли реактива Чугаева. Встряхнуть пробирку, наблюдается образование ярко-красного осадка. Записать наблюдение и уравнение реакции в молекулярном и ионно-молекулярном виде.
Ионы: Cr 3+ — окрашивают раствор в фиолетовый цвет, Fe 2+ — окрашивают раствор в светло-зеленый цвет, Mn 2+ — окрашивают раствор в светло-розовый цвет, Cu 2+ — окрашивают раствор в голубой цвет, Co 2+ — окрашивают раствор в розовый цвет, Ni 2+ — окрашивают раствор в зеленый цвет. Примечание: в разбавленных растворах окраска ионов Fe 2+ и Mn 2+ не наблюдается. На основании цвета раствора сделать предположение о возможном наличии ионов. 2. С помощью универсального индикатора определить рН раствора. 3. Дробным методом провести открытие ионов, обнаружению которых не мешают другие ионы: Fe 2+ — реакция с гексацианоферратом(III) калия; Fe 3+ — реакция с гексацианоферратом(II) калия и радонидом аммония; Mn 2+ — реакция с висмутатом натрия в присутствии азотной кислоты. 4. Осаждение катионов V и VI аналитических групп Поместить в центрифужную пробирку 2 – 3 мл исследуемого раствора и прилить к нему избыток раствора NaOH (2N). Смесь перемешать стеклянной палочкой. Осадок 1 отделить от раствора центрифугированием. Центрифугат 1 слить в отдельную пробирку и написать на ней номер. 5. Открытие ионов Zn 2+ , Al 3+ , Cr 3+ Поместить в пробирку 2 – 3 мл центрифугата 1 и прибавить к нему для нейтрализации 1 – 2 мл раствора HCl (2N). Из полученного раствора в отдельных пробах дробным методом определить ионы: Zn 2+ — реакция с дитизоном; Al 3+ , — реакция с ализарином; Cr 3+ — реакция с пероксидом водорода в избытке щелочи.
Cu 2+ — реакция с избытком раствора аммиака; Co 2+ — реакция с роданидом аммония или калия; Ni 2+ — реакция с реактивом Чугаева. Оформить результаты анализа в рабочей тетради и показать преподавателю. При анализе анионов смотреть лабораторную работу №10. Форма лабораторного отчета Лабораторная работа № . Дата “Название лабораторной работы” Аналитическая задача №____ В исследуемом растворе найдены следующие ионы:______ (Наличие ионов подтвердить ионными уравнениями с указанием признаков реакции)
Приложения Таблица 1. Стандартные энтальпии образования ΔH o обр., стандартные энергии Гиббса образования ΔG o обр. неорганических веществ и их стандартные энтропии S o при 298 К Рома! Нужно выбрать из таблицы данные для решения задач Качественные реакции на катионыNH Al 3+ ; Cr 3+ ; Ag + ; Pb 2+ ; Cu 2+ ; Cd 2+ . Реакция на ион Na + Ионы натрия образуют с дигидроантимонатом калия в нейтральной или слабощелочной среде белый кристаллический осадок дигидроантимоната натрия: 2Na + + H2SbO Потирание изнутри стенок пробирки стеклянной палочкой и охлаждение пробирки под холодной струей воды ускоряет осаждение. Реакция на ион K + 1. Гидротартрат натрия образует с раствором солей калия белый кристаллический осадок гидротартрата калия: Осадок выпадает при потирании стеклянной палочкой внутренней стенки пробирки и охлаждение пробирки под струей холодной воды. 2. Кобальтинитрит натрия образует с растворами солей калия желтый осадок — кобальтинитрит калия: Реакция на ион NH 1. Едкие щелочи KOH и NaOH при нагревании вытесняют из растворов солей аммония аммиак: NH Выделяющийся аммиак можно обнаружить по запаху или по влажной индикаторной ленте (щелочная реакция). 2. Реактив Неслера (щелочной раствор комплексной соли K2[HgJ4]) образует с раствором соли аммония осадок оранжево-бурого цвета: NH В присутствии очень малых количеств раствор окрашивается или в желтый или в бурый цвет. Реакция на ион Mg 2+ Гидрофосфат натрия образует с солями магния в присутствие NH4OH и NH4Cl белый кристаллический осадок. Поместите в пробирку по 2-3 капли растворов MgCl2 и NH4Cl, прибавьте к полученной смеси 2-3 капли раствора Na2HPO4. Тщательно перемешайте содержимое пробирки стеклянной палочкой и затем добавьте к раствору NH4OH: Mg 2+ + HPO Реакция на ион Ba 2+ 1. Дихромат–ион образует с ионами бария осадок желтого цвета (хромат бария): 2Ba 2+ + Cr2O 2. Сульфат – ион образует с ионами бария осадок белого цвета (сульфат бария), не растворимый в кислотах: Ba 2+ + SO 3. Оксалат – ион образует с ионами бария осадок белого цвета (оксалат бария): Ba 2+ + C2O Реакция на ион Ca 2+ Оксалат-ион образует с ионами кальция белый кристаллический осадок: Ca 2+ + C2O Проведению реакции могут мешать ионы бария. Реакция на ион Fe 2+ Растворы двухвалентного железа окрашены в бледно-зеленный цвет. Гексацианоферрат (III) калия с двухвалентным железом образует синий осадок, называемый турнбулевой синью: Реакция на ион Fe 3+ Растворы трехвалентного железа имеют желтую или красно-бурую окраску. 1. Ионы трехвалентного железа с роданид-ионом образуют соединение, окрашивающее раствор в кроваво-красный цвет: Fe 3+ + 3CNS — = Fe (CNS)3 Fe 3+ + 6CNS — = [Fe (CNS)6 ] 3- 2. Гексацианоферрат (II) калия с трехвалентным железом образует темно-синий осадок, называемый берлинской лазурью: 3. Ионы трехвалентного железа со фторидом натрия в растворе образуют бесцветное комплексное соединение: Fe 3+ + 6NaF = [Fe F6] 3- + 6Na + Реакция на ион Mn 2+ Концентрированные растворы солей марганца имеют бледно-розовый цвет, разбавленные растворы – бесцветны. Ионы двухвалентного марганца в кислой среде окисляются (в данном случае висмутатом натрия) до перманганат–ионов красно-фиолетового цвета: 2Mn 2+ +5BiO Реакция на ион Cr 3+ Растворы солей хрома имеют зеленую или фиолетовую окраску. Ионы трехвалентного хрома окисляются перекисью водорода в щелочной среде до хромат – ионов. Поместить в пробирку 2-3 капли соли хрома (III), прилить раствор щелочи до растворения осадка. К полученному раствору хромита (изумрудно – зеленого цвета) прилить 2-3 капли перекиси водорода и осторожно нагреть пробирку. Зеленая окраска раствора перейдет в желтую: Cr 3+ + 4OH — = CrO 2CrO Реакция на ион Co 2+ Разбавленные растворы солей кобальта имеют розовую окраску. Роданид-ион с ионами кобальта образуют комплексную соль синего цвета. Поместите в пробирку 2-3 капли раствора кобальта (II), насыпьте немного сухой соли роданида аммония и прилейте 5-6 капель амилового или изоамилового спирта. Смесь перемешайте. Наблюдайте расслоение жидкостей и окрашивание верхнего слоя в голубой или синий цвет. Co 2+ + 4CNS — = [Co(CNS)4] 2- Этой реакции мешают ионы железы (III), которые образуют с роданидом соединение кроваво – красного цвета. Поэтому ионы железа (III) предварительно связывают в бесцветный комплекс фторидом натрия или фторидом аммония. Реакция на ион Ni 2+ Растворы солей никеля имеют зеленую окраску. Ионы никеля в аммиачной среде образуют с диметилглиоксимом осадок комплексной соли ало-красного цвета. Этой реакции мешают ионы трехвалентного и двухвалентного железа: Реакция на ион Zn 2+ Растворы солей цинка бесцветны. С гексацианоферратом (II) калия ионы цинка образуют аморфный осадок салатного цвета: Реакция на ион Al 3+ Растворы солей алюминия бесцветны. При осторожном добавлении щелочей (по каплям) образуется осадок белого цвета в виде белых студенистых хлопьев, часто всплывающих на поверхность раствора: Гидроксид алюминия обладает амфотерными свойствами: при действии на Al (OH)3 раствором кислоты или щелочи происходит растворение осадка: Реакция на ион Ag + 1. Хлорид – ион осаждает ионы серебра из раствора в виде белого творожистого осадка: Хлорид серебра нерастворим в азотной кислоте, но растворим в гидроксиде аммония: Если на полученный раствор [Ag(NH3)2]Cl подействовать раствором азотной кислоты, то AgCl снова выпадает в виде творожистого белого осадка: 2. Иодид – ион с ионами серебра образует осадок желтого цвета: Реакция на ион Pb 2+ 1. Хлорид – ион осаждает ионы свинца в виде белого творожистого осадка: Pb 2+ + 2Cl — = PbCl2↓ Хлорид свинца нерастворим в гидроксиде аммония: PbCl2 + NH4OH = реакция не идет. 2. Иодид – ион осаждает ионы свинца в виде осадка желтого цвета: Часть осадка растворите в 5-6 каплях уксусной кислоты при нагревании, а затем осторожно охладите под струей холодной воды. Хлорид свинца из раствора выпадает в виде золотистых хлопьев. Реакция на ион Cu 2+ 1. Гидроксид аммония, добавленный в избытке к солям меди, образует растворимое комплексное соединение василькового цвета: 2. Гексацианоферрат калия осаждает ион меди (II) из раствора в виде осадка красно-коричневого цвета: Реакция на ион Cd 2 + Сульфид – ион в слабокислой среде осаждает ионы кадмия из раствора в виде осадка желтого цвета: Контрольные вопросы 1. Приведите примеры катионов и анионов, которые могут быть обнаружены с помощью окислительно-восстановительных реакций. 2. Какие ионы образуют окрашенные комплексные соединения: Cu 2+ ; Cu + ; Fe 2+ ; Fe 3+ ; Co 3+ ; Zn 2+ ; Ag + ? 3. Присутствие каких ионов может быть обнаружено по образованию летучих веществ: SO 4. Как доказать наличие ионов Сu 2+ и Ag + в одном растворе? Лабораторная работа № 3 (4 ч.) Тема: Карбонаты. Жесткость воды (постоянная и временная). Цель: ознакомиться со способами устранения временной и постоянной жесткости воды. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Присутствие в воде ионов Са 2+ и Мg 2+ обуславливает так называемую жёсткость воды. Жёсткая вода вызывает повышенный расход мыла, поскольку при взаимодействии солей кальция и магния с мылом образуются нерастворимые осадки: На стенках паровых котлов жёсткая вода образует накипь, обладающую плохой теплопроводностью. Кроме того, накипь способствует коррозии стенок котлов. В жёсткой воде плохо разваривается мясо, овощи, плохо заваривается чай. Очень жёсткая вода не пригодна для питья. Условная классификация воды по уровню жёсткости приведена в табл. 3. источники: http://topuch.ru/laboratornie-raboti-po-obshej-i-neorganicheskoj-himii-v2/index12.html http://lektsia.com/1x58ea.html |

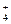 ; Na + ; K + ; Mg 2+ ; Ba 2+ ; Ca 2+ ; Fe 2+ ; Fe 3+ ; Mn 2+ ; Co 2+ ; Ni 2+ ; Zn 2+ ;
; Na + ; K + ; Mg 2+ ; Ba 2+ ; Ca 2+ ; Fe 2+ ; Fe 3+ ; Mn 2+ ; Co 2+ ; Ni 2+ ; Zn 2+ ;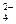 = Na2H2SbO4↓
= Na2H2SbO4↓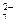 + H2O = 2BaCrO4↓+ 2H + .
+ H2O = 2BaCrO4↓+ 2H + . + 14H + = 2MnO
+ 14H + = 2MnO 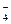 + 5Bi 3+ +7H2O
+ 5Bi 3+ +7H2O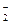 +2H2O
+2H2O

 ; CO
; CO  ; Na + ; NH
; Na + ; NH