Ионные реакции в растворах электролитов
Ионными реакциями (реакциями обмена) называют реакции в растворах электролитов, не сопровождающиеся изменением степеней окисления атомов элементов, входящих в состав реагирующих веществ.
Для выявления сущности процессов, происходящих при ионных реакциях, кроме молекулярных, составляют ионные уравнения реакций.
· При составлении ионных уравнений в виде ионов записывают только растворимые сильные электролиты. Все остальные вещества (неэлектролиты, слабые или малорастворимые электролиты) записывают в молекулярной форме.
Примеры реакций обмена:
· с образованием малорастворимых соединений:
· с образованием слабых электролитов:
· с образованием газообразных веществ:
Диссоциация воды. Водородный показатель
Вода является слабым электролитом. Уравнение диссоциации воды упрощенно записывают следующим образом: H2O Û H + + OH — . Константа диссоциации воды:

· Произведение 

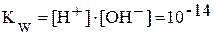
Ионное произведение воды при постоянной температуре постоянно не только для воды, но и для водных растворов. Зная концентрацию ионов H + , можно рассчитать концентрацию OH — , и наоборот. Понятия кислая, нейтральная и щелочная среда можно оценить количественно по концентрации ионов H + или OH — . Более удобно для характеристики среды пользоваться водородным показателем:

| Среда | рН | [H + ], моль/л | [OH — ], моль/л |
| Нейтральная | = 7 | 10 — 7 | 10 — 7 |
| Кислая | 10 — 7 | — 7 | |
| Щелочная | > 7 | — 7 | >10 — 7 |
Гидролиз солей
· Гидролизом солей называют процесс взаимодействия ионов соли с водой, приводящий к смещению ионного равновесия воды и, как правило, изменению рН среды.
Гидролиз солей происходит в тех случаях, когда ионы, образующиеся в результате диссоциации соли, способны образовать с ионами воды малодиссоциирующие частицы. Гидролиз чаще всего является обратимым процессом, так как продукты реакции взаимодействуют между собой с образованием исходных веществ.
Соли, образованные сильной кислотой и сильным основанием, например NaCl, KNO3, CaCl2 и др., гидролизу не подвергаются, их растворы нейтральны.
· Гидролизу подвергаются соли, образованные:
· слабыми основаниями и сильными кислотами (NH4Cl, AlCl3, ZnSO4 и др.);
· слабыми кислотами и слабыми основаниями (NH4CH3COO, NH4CN и др.).
· Гидролиз солей слабых кислот и сильных оснований.
Гидролиз NaNO2.
Диссоциация соли: NaNO2 = Na + + NO2 —
краткое ионное уравнение:
NO2 — + HOH Û HNO2 + OH — (среда щелочная, рН>7);
Гидролиз K2CO3 (гидролиз солей многоосновных кислот преимущественно происходит по первой ступени).
краткое ионное уравнение:
CO3 2 — + HOH Û HCO3 — + OH — (среда щелочная, рН>7);
По второй ступени гидролиз практически не идет.
· Гидролиз солей слабых оснований и сильных кислот.
Диссоциация соли: NH4Cl = NH4 + + Cl —
краткое ионное уравнение:
NH4 + + HOH Û NH4OH + H + (среда кислая, рН 3+ + 3Cl —
Al 3+ + HOH Û AlOH 2+ + H + (среда кислая, рН — и H + из воды, равновесие сильно смещается вправо, гидролиз усиливается. Значение рН раствора зависит от относительной силы кислоты и основания, образующих соль.
Константы диссоциации уксусной кислоты и гидроксида аммония равны: 

Растворимые соли, образованные многоосновными слабыми кислотами и многокислотными слабыми основаниями гидролизованы в растворе практически полностью с образованием кислоты и основания:
Такие соли в водных растворах существовать не могут. В таблице растворимости им соответствует прочерк.
· Совместный гидролиз солей.
Если в растворе одновременно присутствуют две соли, одна из которых содержит катион слабого основания (Al 3+ , Fe 3+ , Cr 3+ , NH4 + ), а другая — анион слабой кислоты (СO3 2— , SO3 2— , S 2— , SiO3 2— ), то гидролиз необратим, идёт с образованием кислоты и основания. Пример реакции совместного гидролиза солей:
Реакция нитрита натрия и соляной кислоты
Возьмите бесцветную бутылку для воды из полиэтилентерефталата (ПЭТФ) объемом 5-7 л. На дно бутылки насыпьте примерно 20-30 см 3 нитрита натрия NaNO2
и добавьте 25-30 мл концентрированной соляной кислоты. Послышится
шипение, произойдет активное выделение бурого газа. Бутылка быстро
заполнится бурыми парами.
При взаимодействии нитрита натрия с раствором соляной или серной кислот образуется азотистая кислота HNO2
Азотистая кислота неустойчива, существует только в разбавленных
растворах и легко распадается с образованием смеси оксидов азота (II) и
(IV)
Закройте бутылку, аккуратно встряхните, откройте. Ничего не произойдет.
Налейте в бутылку примерно 200 мл воды и повторите действия:
быстро закройте бутылку и сильно встряхните содержимое. Бурый газ
побледнеет и почти обесцветится, стенки бутылки сморщатся. Диоксид азота
NO2, который находился в бутылке, прореагировал с водой и кислородом, при этом образовались азотная кислота и монооксид азота.
Если бутылку открыть, ее содержимое станет снова бурым – сначала сверху,
потом по всему объему. Стоит осторожно “распрямить” стенки бутылки, и
такой переход произойдет моментально. Оксид азота (II) NO быстро
окислится кислородом до бурого диоксида NO2.
Снова закройте бутылку и встряхните ее содержимое. Газ внутри
обесцветится, а стенки сморщатся. Если мы откроем крышку, внутри бутылки
моментально появятся бурые пары. Описанную процедуру можно повторять
несколько раз.
После эксперимента у нас осталась бутылка с бурыми парами оксидов азота.
Их можно использовать для другого не менее эффектного опыта. Привяжите к
длинной проволоке ватку и хорошо смочите ее в концентрированном
растворе аммиака. Внесите ватку в бутылку и слегка поводите ней
вверх-вниз и из стороны в сторону. Бутылка быстро заполнится густым
белым дымом: аммиак вступил в реакцию с парами азотной кислоты и
диоксидом азота с образованием нитрата и нитрита аммония.
В бутылке объемом 5-7 л эксперимент выглядит значительно более эффектно, чем в двухлитровой бутылке.
Записи молекулярных и ионно-молекулярных уравнений реакций обмена
Решение задач на составление химических уравнений реакций
Задание 193.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и СаСI2 б) К2CO3 и ВаСl2; в) Zn(OH)2 и КОН.
Решение:
Молекулярные формы реакций:
Отметим, что взаимодействие этих веществ возможно, ибо в результате реакций происходит связывание ионов с образованием осадков Са3(РО4)2 и BaCO3 соответственно в реакциях (а) и (б), а в реакции (в) ионы ОН — связываются с нерастворимым основанием Zn(OH)2 с образованием комплексного иона [Zn(OH)4]2-. Исключив одинаковые ионы из обеих частей равенств [а) Na + , C l- ; б) K + , Cl — ; в) K + ], получим ионно-молекулярные уравнения реакций:
Задание 194.
Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
Fe(OH)3 + 3H + = Fe + 3H2O
Cd 2+ + 2OH — = Cd(OH)2
H + + NO2 — = HNO2
Решение:
В левых частях данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, а в первой реакции ещё и нерастворимое основание Fe(OH)3 следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов и нерастворимого основания. Например:
Задание 195.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) СdS и HCl; б) Сг(ОН)3 и NаОН; в) Ва(ОН)2 и СоСl2.
Решение:
Молекулярные формы уравнений реакций:
Отметим, что взаимодействие этих веществ возможно, ибо в результате реакций происходит связывание ионов с образованием слабого электролита H2S при растворении малорастворимого соединения ) CdS в реакции (а), растворение малорастворимого основания Cr(OH)3 в щёлочи с образованием комплексного иона [Cr(OH)6] 3- в реакции (б) и образование осадка Co(OH)2 в реакции (в). Исключив одинаковые ионы из обеих частей равенств [а) Cl — ; б) Na + ; в) Ba 2+ , Cl — ], получим ионно-молекулярные уравнения реакций:
а) CdS + 2H+ = Cd 2+ + H2S↑;
б) Cr(OH)3 + 3OH- = [Cr(OH)6] 3- ;
в) Co 2+ + 2ОН — = Co(OH) ↓ 2.
Задание 196.
Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Zn 2+ + Н2S = ZnS ↓ + 2H +
б) НСО3 — + H + = Н2O + СО2 ↑;
в) Аg + + Сl — = АgС1 ↓
Решение:
В левых частях данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например:
Задание 197.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Н2SO4 и Ва(ОН)2; б) ЕеСl3 и NH4OH б) ЕеСl3 и NH4OH; в) СH3COONa и HCl.
Решение:
Отметим, что взаимодействие этих веществ возможно, ибо в результате реакций происходит связывание ионов с образованием осадка BaSO4 и слабого электролита Н2О в реакции (а) и осадка Fe(OH)3 в реакции (б), а также образование слабого электролита СH3COOH в реакции (в). Исключив одинаковые ионы из обеих частей равенств [б) NH4 + , Cl — ; в) Na + , Cl — ], получим ионно-молекулярные уравнения реакций:
а) 2H + + SO4 2- + Ba 2+ + 2OH — = BaSO4 ↓ + 2H2O;
б) Ее 3+ + 3OH — = Fe(OH)3 ↓ ;
в) СH3COO — + H + = СH3COOH.
Задание 198.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и КОН; б) NiSO4 и (NH4)2S; в) МgCO3 и HNO3.
Решение:
Молекулярные формы реакций:
Отметим, что взаимодействие этих веществ возможно, ибо в результате реакций происходит связывание ионов с образованием осадков Fe(OH)3 и NiS в реакциях (а) и (б); растворение осадка МgCO3 и выделение газа СО2 и слабого электролита Н2О в реакции (в). Исключив одинаковые ионы из обеих частей равенств [а) K+, Cl — б) NH4 + , SO4 2- ; в) NO3 — ], получим ионно-молекулярные уравнения реакций:
Задание 199.
Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:а) Ве(ОН)2 + 2ОН — = ВеО2 2- + 2Н2О
б) СН3СОО — + Н + = СН3СООН
в)Ва 2+ + SO4 2 — = BaSO4 ↓
Решение:
В левых частях данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, а также растворение осадка Ве(ОН)2, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например:
Задание 200.
Какие из веществ — NaCl, NiSO4, Ве(ОН)2, КНСО3 — взаимодействуют с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
Решение:
а) NaCl и NaOH – сильные электролиты, которые в водных растворах диссоциируют:
NaCl ⇔ Na + + Cl — ; NaOH ⇔ Na + + OH — . При смешении растворов NaCl и NaOH не происходит связывание ионов Na+, Cl — и ОН — друг с другом с образованием осадка, газа или слабого электролита, поэтому реакция не протекает.
б) NiSO4 и NaOH — электролиты, которые в водных растворах диссоциируют:
NiSO4 ⇔ Ni 2+ + SO42-; NaOH ⇔ Na + + ОН — . При смешении растворов NiSO4 и NaOH происходит связывание ионов Ni 2+ и ОН — друг с другом с образованием малорастворимого электролита Ni(OH)2, реакция протекает:
NiSO4 +2NaOH = Ni(OH)2 ↓ + Na2SO4 (молекулярная форма);
Ni 2+ + 2ОН — ⇔ Ni(OH)2↓ (ионно-молекулярная форма).
в) Ве(ОН)2 и NaOH взаимодействуют друг с другом, так как происходит связывание ионов ОН — с молекулами Ве(ОН)2 с образованием комплексного иона [Be(OH)4] 2- , при этом происходит растворение осадка:
г) КНСО3 и NaOH – сильные электролиты, которые в водном растворе диссоциируют:
КНСО3 ⇔ К + + НСО3-; NaOH ⇔ Na + + OH — . Реакция не протекает, потому что при смешении растворов этих соединений связывание ионов с образованием осадка, газа или слабого электролита не происходит.
http://how-make.ru/khimiya/reakcija-nitrita-natrija-i-soljanoj-kisloty/
http://buzani.ru/zadachi/khimiya-shimanovich/930-ionno-molekulyarnye-ionnye-reaktsii-obmena-193-200