HCL+ NaOH
Ионное и молекулярное уравнения
Молекулярное: HCL + NaOH = NaCl + H2O
Полное ионное: H(+) + CL(-) + Na(+) + OH(-) = Na(+) + CL(-) + H2O
Сокращенное ионное: H(+) + OH(-) = H2O
Если ответ по предмету Химия отсутствует или он оказался неправильным, то попробуй воспользоваться поиском других ответов во всей базе сайта.
Ионные уравнения реакций
В качестве примера рассмотрим взаимодействие соляной кислоты и гидроксида натрия в водном растворе:
HCl + NaOH = NaCl + H2O.
Это уравнение написано в молекулярном виде. Молекулярное уравнение данного процесса не отражает реальных явлений, имеющих место при протекании такого взаимодействия, так как в приведенном примере все вещества, кроме воды, являются сильными электролитами и в растворе присутствуют не в виде молекул, а только в виде ионов:
Поэтому уравнение нейтрализации логичнее написать в ионном виде. При переходе от молекулярного к ионному (точнее: полному ионному) уравнению на ионы разбиваются только формулы сильных электролитов, хорошо растворимых в воде:
H + + Cl — + Na + + OH — = Na + + Cl — + H2O.
Полученное выражение можно сократить и получить сокращенное ионное уравнение:
Сокращенное ионное уравнение показывает, что данное взаимодействие сводится к реакции между ионами водорода и гидроксид-анионами с образованием молекул слабого электролита (воды).
Аналогичным образом следует рассматривать и другие процессы, протекающие в растворах с участием электролитов.
CO2 + 2Na + + 2OH — = 2Na + + CO 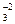
CO2 + 2OH — = CO 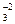
2Ag + + 2NO 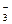
Тема 7. Равновесия в растворах, протолитическое равновесие,
Дата добавления: 2015-04-29 ; просмотров: 1949 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Молекулярное уравнение: naoh + hcl
Молекулярное уравнение: naoh + hcl ? nacl + H2O полное ионное уравнение: na+ + OH- + H+ + cl- ? na+ + cl- + H2O сокращенное ионное уравнение: OH- + H+ ? H2O. 3. Реакции, идущие с образованием малодиссоциирующих веществ – слабых электролитов.
Слайд 43 из презентации «Теория электролитической диссоциации»
Размеры: 720 х 540 пикселей, формат: .jpg. Чтобы бесплатно скачать слайд для использования на уроке, щёлкните на изображении правой кнопкой мышки и нажмите «Сохранить изображение как. ». Скачать всю презентацию «Теория электролитической диссоциации.pptx» можно в zip-архиве размером 1576 КБ.
Диссоциация
«Теория электролитической диссоциации» — Электролиты (водные растворы проводят эл.ток). Типы ионов. I-е положение ТЭД. Вещества с ионной связью: Ориентация диполей воды ? гидратация ? диссоциация. II-е положение ТЭД. Современное содержание ТЭД можно свести к четырем основным положениям. В растворах электролиты диссоциируют ( распадаются ) на положительные и отрицательные ионы.
«Ионные уравнения» — Даны растворы хлорида железа(III) и гидроксида калия. Необходимо учитывать индексы у ионов и коэффициенты в уравнении реакции. 5. Записать уравнение без вычёркнутых ионов. Расставить коэффициенты. Составление ионных уравнений. 2. Подчеркнуть формулы электролитов (формулы кислот, оснований, солей. 1. Записать молекулярное уравнение реакции.
«Реакции ионного обмена» — Взаимодействие ионов в растворе. Электролитом является каждое вещество в ряду. Вода. Оценка. Диссоциация щелочей. Нерастворимые вещества. Реакции обмена. Порядок действий. Реакция. Составить полное ионное уравнение. Укажите уравнение реакции ионного обмена. Взаимодействие ионов. Формулы веществ. Реакция ионного обмена.
«Процесс электролитической диссоциации» — Майкл Фарадей. Распад молекул электролитов. Электрический ток. Масса вещества. Интегрированный урок по химии и физике. Электролитическая диссоциация. Схема диссоциации сульфата меди. Схема электролиза сульфата меди. Масса, выделившегося вещества. Критерии оценивания. Исследование электропроводности жидкостей.
«Электролитическая диссоциация» — Кислоты диссоциируют на ионы водорода и кислотного остатка. — HCI = Н+ + CI -2 H2SO4 = 2H+ + SO4. В одну из пробирок прилить ацетон, в другую – воды. В одну из пробирок прилить воды. Механизм диссоциации веществ. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Основные положения теории: 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные.
«Уравнения реакций ионного обмена» — Реакции ионного обмена в растворах электролитов. Реакции ионного обмена. Реакции в водных растворах. Реакция обмена. Газ. Молекулярное и ионные уравнения реакций. Реакцией нейтрализации. Осадок. Малодиссоциирующее вещество. Алгоритм составления ионных уравнений. Посмотрите опыт.
http://helpiks.org/3-32166.html
http://900igr.net/prezentacija/khimija/teorija-elektroliticheskoj-dissotsiatsii-252190/molekuljarnoe-uravnenie-naoh-hcl-43.html

