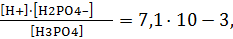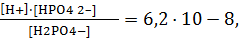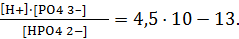Напишите уравнения электролитической диссоциации: а) хлорида калия; б) серной кислоты; в) гидроксида кальция; г) нитрата меди(ii); д) сульфата алюминия
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2073cb68cf2169 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
В растворах, проводящих электрический ток, происходит самопроизвольный распад (электролитическая диссоциация) молекул на ионы.
Было установлено, что диссоциации подвергаются вещества с ионной или полярной связями при растворении их в растворителях с большой диэлектрической проницаемостью. К таким растворителям в первую очередь относится вода.
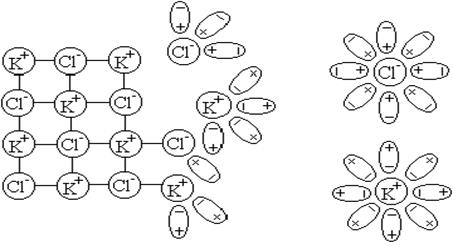
Механизм электролитической диссоциации хлорида калия в воде приведен на рисунке 4.1. Из данной схемы видно, что продукты диссоциации электролита (ионы) в результате электростатического взаимодействия с растворителем образуют сольваты или в случае воды – гидраты.
Рисунок 4.1 – Схема растворения и диссоциации хлорида калия.
Электролитическая диссоциация – это распад вещества на ионы под действием полярных молекул растворителя.
По способности распадаться на ионы электролиты делятся на сильные и слабые. Для описания ряда свойств сильных и слабых электролитов применяются различные математические зависимости.
Сильные электролиты диссоциируют необратимо и практически полностью. В уравнении диссоциации ставят знак «®» (односторонний процесс). Примеры диссоциации основных классов неорганических соединений:
Концентрации ионов в растворах сильных электролитов можно рассчитывать по уравнениям их диссоциации.
В соответствии с положением в периодической таблице элемента, образующего соответствующий электролит, к сильным электролитам относятся:
1) Основания – I-группа, II-группа начиная с Са(ОН)2 и III-я ТlОН;
2) Кислоты – V-группа НNО3, VI-группа Н2SО4 и Н2SеО4, VII-я НСl, НСlО4, НСlО3 и соответствующие кислоты для брома и йода;
3) Соли – все хорошо растворимые.
Остальные электролиты, за немногим исключениям, относятся к слабым.
Слабые электролиты диссоциируют обратимо и ступенчато.
Для характеристики диссоциации слабых электролитов применяется степень диссоциации (α) и константа диссоциации (Кд).
Степень диссоциации (α) показывает, какая часть электролита распалась на ионы.
Данные равновесия подчиняются закону действующих масс и количественно выражаются через Кд. Например, для диссоциации водного раствора аммиака:
NH4ОH«NH4 + + OH – , Kд = 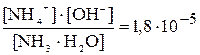
Константа диссоциации количественно характеризует силу электролита, чем меньше значение константы диссоциации, тем слабее электролит.
В случае многозарядных слабых электролитов диссоциация протекает ступенчато. Например, для ортофосфорной кислоты:
I-ступень – H3PO4 « H + + H2PO4 – Кд1 = 7,11·10 -3 ,
II-ступень – H2PO4 – « H + + HPO4 2– Кд2 = 6,34·10 -8 ,
III-ступень – HPO4 2– « H + + PO4 3– Кд3 = 1,26·10 -12 .
Из приведенных значений Kд видно, что каждая последующая ступень диссоциации примерно на пять порядков меньше.
5. pH водных растворов
Ионное произведение воды.
В чистой воде [H + ] = 10 –7 моль/л, в кислой среде [H + ] > 10 –7 моль/л, в щелочной среде [H + ] –7 моль/л.
Концентрации ионов H + и OH – могут меняться в очень широких пределах, поэтому в расчетах удобнее использовать не значения концентраций, а их логарифмы (lg). Отсюда получаем:
| рН = -lg[H + ]. | (3.17) |
Значок «p» обозначает математическую операцию «-lg», а [H + ] – молярную концентрацию ионов водорода.
рН – это отрицательный десятичный логарифм из молярной концентрации ионов водорода.
Шкала рН имеет следующий вид:
кислая нейтральная щелочная среды.
Примеры расчетов рН в растворах сильных и слабых кислот и оснований:
1) Рассчитать pH 0,1М раствора серной кислоты.
рH = -lg[H + ] = -lg 2 ·10 – 1 = -lg2 — lg10 – 1 = -0,3 + 1 = 0,7.
2) Рассчитать pH в 0,1М растворе Н2СО3.
Напишем уравнения диссоциации угольной кислоты:
Расчет концентрации ионов водорода проведем только по первой ступени диссоциации:
[H + ] = [НСО3 – ] = 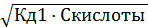
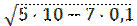
Отсюда, рН = -lg 2,2·10 -4 = -0,34 + 4 = 3,64.
Из приведенных значений видно, что при одинаковой молярной концентрации сильные электролиты изменяют рН в значительно большей степени. При смешивании сильного и слабого электролитов рН практически определяется диссоциацией сильного электролита.
Буферные растворы – это растворы при добавлении к которым кислот или щелочей их pH меняется незначительно.
Буферными свойствами обладают:
1) Растворы слабых кислот и их солей. Например:
СН3СООН + СН3СООNа – ацетатный буферный раствор.
2) Растворы слабых оснований и их солей. Например:
NН4ОН + NН4Сl– аммонийный буферный раствор.
3) Растворы кислых солей слабых кислот. Например, NаН2РО4.
http://gomolog.ru/reshebniki/9-klass/eremin-2019/10/11.html
http://helpiks.org/4-97918.html