Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
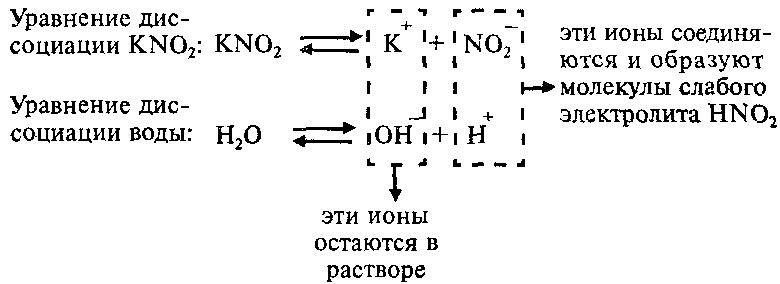
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
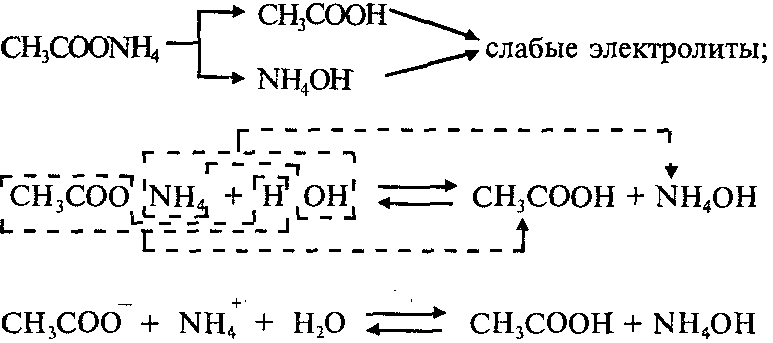
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
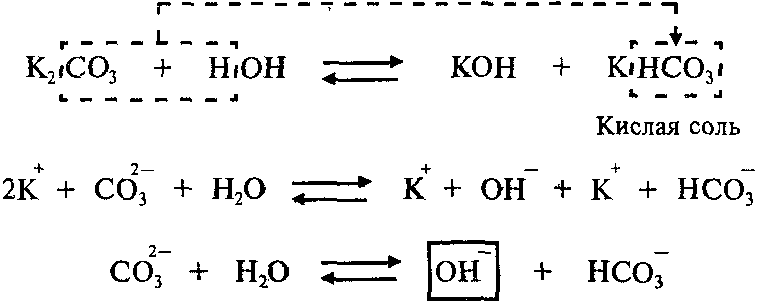
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Написать уравнение гидролиза сульфида алюминия
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Что называется гидролизом? Объясните этимологию термина. Гидролиз (от греч. hydor ― вода и lysis ― разложение, распад) ― реакции обменного взаимодействия веществ с водой, приводящие к их разложению.
Задание 2
Какие типы гидролиза различают? Обратимый и необратимый гидролиз.
Гидролиз каких солей является необратимым? Солей, образованных слабыми летучими кислотами и слабыми нерастворимыми основаниями.
Почему? Потому, что продукты гидролиза уходят из зоны реакции в виде осадка или газа.
Как, используя таблицу растворимости, определить соль, подвергающуюся такому типу гидролиза? Такие соли обозначаются прочерком «#» в таблице растворимости.
Задание 3
Какие соли подвергаются гидролизу: KCl, K2S , ZnCl2, Pb(NO3)2, Ca3(PO4)2, LiNO2, Cs2SiO3, AlBr 3 , Na2SO4? Запишите уравнения гидролиза в ионном и молекулярном виде. Укажите среду растворов, окраску лакмуса и универсального индикатора в них.
K2S
Cоль диссоциирует в растворе K2S ⇄ 2K + + S 2- , где
S 2- ― анион слабой кислоты и гидролизирует по схеме (вторая стадия практически не происходит):
S 2- + H2O ⇄ HS — + OH —
S 2- + 2K + + H2O ⇄ HS — + 2K + + OH —
K2S + H2O ⇄ KHS + KOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
ZnCl2
Cоль диссоциирует в растворе ZnCl2 ⇄ Zn 2+ + 2Cl — , где
Zn 2+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Zn 2+ + HOH ⇄ ZnOH + + H +
Zn 2+ + 2Cl — + HOH ⇄ ZnOH + + Cl — + H + + Cl —
ZnCl2 + HOH ⇄ ZnOHCl + HCl Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
Pb(NO3)2
Cоль диссоциирует в растворе Pb(NO3)2 ⇄ Pb 2+ + 2NO3 — , где
Pb 2+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Pb 2+ + HOH ⇄ PbOH + + H +
Pb 2+ + 2NO3 — + HOH ⇄ PbOH + + NO3 — + H + + NO3 —
Pb(NO3)2 + HOH ⇄ PbOHNO3 + HNO3 Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
Ca3(PO4)2
Cоль диссоциирует в растворе Ca3(PO4)2 ⇄ 3Ca 2 + + 2PO4 3- , где
PO4 3- ― анион слабой кислоты и гидролизуется по схеме (вторая стадия практически не происходит) :
PO4 3 — + HOH ⇄ HPO4 2- + OH —
3Ca 2+ + 2PO4 3 — + 2HOH ⇄ 2Ca 2+ + 2HPO4 2- + Ca 2+ + 2OH —
Ca3(PO4)2 + 2HOH ⇄ 2CaHPO4 + Ca(OH)2 Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
LiNO2
Cоль диссоциирует в растворе LiNO2 ⇄ Li + + NO2 — , где
NO2 — ― анион слабой кислоты и гидролизуется по схеме:
NO2 — + HOH ⇄ HNO2 + OH —
Li + + NO2 — + HOH ⇄ HNO2 + Li + + OH —
LiNO2 + HOH ⇄ HNO2 + LiOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
Cs2SiO3
Cоль диссоциирует в растворе Cs2SiO3 ⇄ 2Cs + + SiO3 2 — , где
SiO3 2- ― анион слабой кислоты и гидролизуется по схеме (вторая стадия практически не происходит) :
SiO3 2- + HOH ⇄ HSiO3 — + OH —
2Cs + + SiO3 2- + HOH ⇄ Cs + + HSiO3 — + Cs + + OH —
Cs2SiO3 + HOH ⇄ CsHSiO3 + CsOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
AlBr3
Cоль диссоциирует в растворе AlBr3 ⇄ Al 3+ + 3Br — , где
Al 3+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Al 3+ + HOH ⇄ AlOH 2+ + H +
Al 3+ + 3Br — + HOH ⇄ AlOH 2+ + 2Br — + H + + Br —
AlBr3 + HOH ⇄ AlOHBr2 + HBr Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
Задание 4
Запишите уравнение гидролиза ацетата алюминия и сульфита хрома (III). Какому гидролизу подвергаются эти соли?
Ацетата алюминия и сульфита хрома (III) подвергаются необратимому гидролизу:
(CH3COO)3Al + 3H2O ⟶ 3CH3COOH + Al(OH)3↓
Cr2(SO3)3 + 3H2O ⟶ 2Cr(OH)3↓ + 3SO2↑
Задание 5
Даны растворы трёх солей. Как при помощи индикатора распознать их? Для солей, подвергающихся гидролизу, запишите уравнения соответствующих реакций.
а) нитрат цинка, сульфат натрия, силикат калия;
Нитрат цинка ― соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону:
Zn 2+ + HOH ⇄ ZnOH + + H +
Zn 2+ + 2NO3 — + HOH ⇄ ZnOH + + NO3 — + H + + NO3 —
Zn(NO3)2 + HOH ⇄ ZnOHNO3 + HNO3 Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
Сульфат натрия ― соль, образованная сильным основанием и сильной кислотой, не подвергается гидролизу, раствор имеет нейтральную среду, поэтому лакмус не изменит свою окраску.
Силикат калия ― соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону:
SiO3 2- + HOH ⇄ HSiO3 — + OH —
2K + + SiO3 2- + HOH ⇄ K + + HSiO3 — + K + + OH —
K2SiO3 + HOH ⇄ KHSiO3 + KOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
б) хлорид лития, сульфид натрия, бромид алюминия;
Хлорид лития ― соль, образованная сильным основанием и сильной кислотой, не подвергается гидролизу, раствор имеет нейтральную среду, поэтому лакмус не изменит свою окраску.
Сульфид натрия ― соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону:
S 2- + HOH ⇄ HS — + OH —
2Na + + S 2- + HOH ⇄ Na + + HS — + Na + + OH —
Na2S + HOH ⇄ NaHS + NaOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
Бромид алюминия ― соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону:
Al 3+ + HOH ⇄ AlOH 2+ + H +
Al 3+ + 3Br — + HOH ⇄ AlOH 2+ + 2Br — + H + + Br —
AlBr3 + HOH ⇄ AlOHBr2 + HBr Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
в) нитрит натрия, цианид калия, иодид бария.
Нирит натрия ― соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону:
NO 2- + HOH ⇄ HNO2 + OH —
Na + + NO 2- + HOH ⇄ HNO2 + Na + + OH —
NaNO2 + HOH ⇄ HNO2 + NaOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
Цианид калия ― соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону:
CN — + HOH ⇄ HCN + OH —
K + + CN — + HOH ⇄ HCN + K + + OH —
KCN + HOH ⇄ HCN + KOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
Иодид бария ― соль, образованная сильным основанием и сильной кислотой, не подвергается гидролизу, раствор имеет нейтральную среду, поэтому лакмус не изменит свою окраску.
Задание 6
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
карбид алюминия ⟶ метан ⟶ ацетилен ⟶ ацетальдегид ⟶ этановая кислота ⟶ этилацетат ⟶ этиловый спирт. Какие из превращений являются реакциями гидролиза?
Al4C3 + 12H2O ⟶ 4Al(OH)3 ↓ + 3CH4↑ — реакция гидролиза.
2CH4 t ⟶ C2H2 + 3H2 ↑
2C2H2 + O2 ⟶ 2CH3 —C HO
2CH3 —C HO + O2 ⟶ 2CH3 —C OOH
CH3 —C OOH + C2H5 —O H t, H₂SO₄(конц.) ⟶ CH3 —C OO — C2H5 + H2O
CH3 —C OO — C2H5 + H2O ⟶ CH3 —C OOH + C2H5 —O H — реакция гидролиза.
Задание 7
Испытайте в домашних условиях растворы пищевой и технической соды (NaHCO3 и Na2CO3) индикаторной бумагой. В каком растворе среда будет более щелочной? В растворе технической соды среда будет более щелочной, т.к. СО3 2- гидролизуется по аниону, а анион Н СО3 — практически не гидролизуется.
Cоль Na2CO3 диссоциирует в растворе Na2CO3 ⇄ 2Na + + CO3 2- , где
CO3 2- ― анион слабой кислоты и гидролизуется по схеме:
I стадия: CO3 2- + HOH ⇄ HCO3 — + OH —
II стадия: HCO3 — + HOH ⇄ H2CO3 + OH — (практически не происходит)
2Na + + CO3 2- + 2HOH ⇄ 2Na + + 2OH — + H2CO3
Na2CO3 + 2HOH ⇄ 2NaOH + H2CO3
Задание 8
Испытайте растворы мыла и стирального порошка индикаторной бумагой. Раствор мыла имеет щелочную среду.
Объясните, почему стиральные порошки предпочтительнее мыла? Стиральные порошки пенятся в воде любой жесткости и не разрушают структуру ткани, в то время, как мыла имеют плохую моющую способность в жесткой воде.
Почему не рекомендуется стирка шерстяных изделий порошками, предназначенными для стирки хлопчатобумажных тканей? Такие порошки имеют сильнощелочную среду, в присутствии которой белки гидролизуются и шерстяные изделия будут разрушаться.
Напишите уравнения гидролиза следующих солей и укажите среду раствора: (NH4)2SO4;Cs2SO4;MgS;K2SO3;Al2S3
Гидролиз сульфата аммония: (NH4)2SO4 + H2O = NH4HSO4 + NH4OH
Полное ионное уравнение: 2NH4(+) + SO4(2-) + 2H2O = 2NH4OH + SO4(2-) + 2OH(-)
Краткое ионное уравнение: NH4(+) + H2O = NH4OH + OH(-) гидролиз по катиону, среда кислая
———————————————
Гидролиз сульфида алюминия: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S (осадок и газ)
Полное ионное уравнение: 2Al(3+) + 3S(2-) + 6H2O = 2Al(OH)3 + 3H2S
Гидролиз протекает сразу и по катиону, и по аниону, поэтому реакция идёт до конца, с выпадением осадка гидроксида алюминия и образованием газообразного сероводорода
——————————-
Гидролиз сульфита калия: K2SO3 + H2O = KHSO3 + KOH
полное ионное уравнение: 2K(+) + SO3(2-) + 2H2O = 2K(+) + H2SO3
Краткое ионное уравнение: SO3(2-) + 2H2O = H2SO3 + 2OH(-) гидролиз по аниону, среда щелочная
Запишите уравнения гидролиза следующих солей, укажите тип гидролиза и среду раствора. а) фосфат меди
http://gdz.cool/h11_gos_2019/1242-h11_gos_2019_13____.html
http://sprashivalka.com/tqa/q/5051072