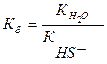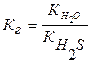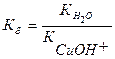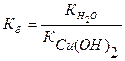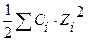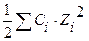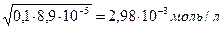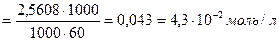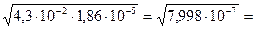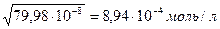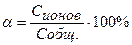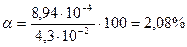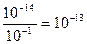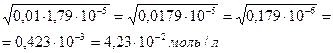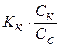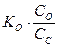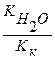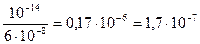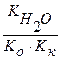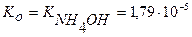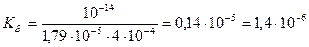Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6deee0b5082f1ea1 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Гидролиз сульфида натрия
Na2S — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
Na2S + HOH ⇄ NaHS + NaOH
Полное ионное уравнение
2Na + + S 2- + HOH ⇄ Na + + HS — + Na + + OH —
Сокращенное (краткое) ионное уравнение
S 2- + HOH ⇄ HS — + OH —
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
NaHS + HOH ⇄ H2S + NaOH
Полное ионное уравнение
Na + + HS — + HOH ⇄ H2S + Na + + OH —
Сокращенное (краткое) ионное уравнение
HS — + HOH ⇄ H2S + OH —
Среда и pH раствора сульфида натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Гидролиз солей
Под гидролизом соли понимают взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Так как при этом ионы соли взаимодействуют с ионами Н + или ОН — воды, гидролиз солей сопровождается изменением рН раствора.
Гидролиз солей многоосновных кислот или многокислотных оснований идет по ступеням. В зависимости от типа соли различают гидролиз по аниону, катиону, по катиону и аниону.
Количественно гидролиз характеризуется степенью гидролиза h и константой гидролиза:
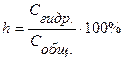
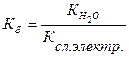
Между степенью гидролиза и константой гидролиза существует взаимосвязь:
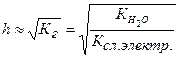
Гидролизу по аниону подвергаются соли, образованные слабой кислотой и сильным основанием.
Например, сульфид натрия Na2S (NaOH – сильное основание, Н2S – слабая кислота).
I.S 2- + H2O ↔ HS — + OH — pH > 7
2Na + + S 2- + H2O ↔ 2Na + + HS — + OH —
II. HS — + Н2О ↔ Н2S + OH — pH > 7
Na + + HS — + H2O ↔ Na + + Н2S + OH —
Гидролизу по катиону подвергаются соли, образованные сильной кислотой и слабым основанием.
Например, хлорид меди СuCI2 (Cu(OH)2 – слабое основание, HCI – сильная кислота).
I. Сu 2+ + H2O ↔ CuOH + + H + pH 2+ + 2CI — + H2O ↔ CuOH + + 2CI — + H +
II. CuOH + + H2O ↔ Cu(OH)2 + H + pH + + CI — + H2O ↔ Cu(OH)2 + CI — + H +
Гидролизу по катиону и аниону подвергаются соли, образованные слабым основанием и слабой кислотой.
Например, цианид аммония NH4CN (NH4OH – слабое основание, HCN – слабая кислота)
NH4 + + CN — + H2O ↔ NH4OH + HCN pH > 7, т.к. Кк-ты + ] = 0,0000386 моль/лВыразим концентрацию ионов водорода в виде

степени, состоящей из такого числа отрицательных единиц, сколько нулей предшествует первой значащей цифре, включая нуль целых, т.е в нашем примере [H + ] = 3,86·10 -5 моль/л.
Зная, что логарифм произведения равен сумме логарифмов запишем:
рН = — lg [H + ] = — (lg 3,86∙10 -5 ) = — (lg 3,86 + lg 10 -5 ) = = — (0,5866 + (-5)) = — (- 4,4134) = 4,41
Значение lg 3,86 определяем по таблице логарифмов (см. Приложение IX, Х).
Определить концентрацию ионов [H + ], если рН = 6,32.

рН = 6,32 [H + ] = 10 – рН

[H + ] — ? Значение 10 0,68 находим по таблице антилогарифмов (см. Приложение X, ХI).
Ответ:[H + ] = 4,786·10 – 7 моль/л.
Вычислить ионную силу 0,05М раствора Na2SO4.


μ = 
= 
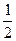
Чему равна ионная сила раствора, содержащего в 1л 0,01 моль КСI и 0,1 моль Ва(NO3)2?

С(КСI) = 0,01 моль/л μ =

µ — ? μ = 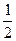
= 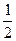
= 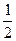
Вычислить концентрацию ионов Н + в 0,1М растворе Н2S (без учета второй ступени диссоциации кислоты).

С(Н2S) = 0,1М Н2S ↔ H + + HS — (слабая кислота)

[H + ] — ? Кк = 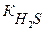
[H + ] =
Ответ:[H + ] = 2,98∙10 -3 моль/л.
Вычислить концентрацию ионов Н + и степень диссоциации уксусной кислоты, если известно, что в 1л её раствора содержится 2,5608г уксусной кислоты.( 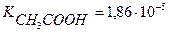

m (CH3COOH) = 2,5608г СН3СООН – слабая кислота
V = 1л = 1000мл [H + ] = 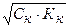
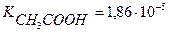


[H + ] — ? См
α — ? [H + ] =
=
М(СН3СООН) = 60г/моль
Ответ:[H + ] = 8,94∙10 -4 моль/л, α = 2,08%.
Вычислить концентрацию ионов Н + в 0,05М растворе соляной кислоты.


[H + ] — ? [H + ] = Cк = 0,05 = 5 · 10 -2 моль/л
Ответ:[H + ] = 5 ∙ 10 -2 моль/л.
Вычислить рН 0,01М раствора Н2SO4.


рН — ? [H + ] = 2∙Ск=2 ∙0,01=2∙10 -2
рН = — lg [H + ] = — lg 2∙10 -2 = — (lg 2 + lg 10 -2 ) =
= — (0,3010 – 2) = 1,699 ≈ 1,7
Вычислить рН 0,1М раствора КОН.


рН — ? [OH — ] = Cщ = 0,1 = 10 -1 моль/л
рОН = — lg [OH — ] = — lg 10 -1 = 1
pH = 14 – pOH = 14 – 1 = 13
Можно при решении этой задачи пойти другим путем:
[H + ] = 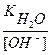
[H + ] =
рН = — lg [H + ] = — lg 10 -13 = 13
Вычислить концентрацию гидроксид-ионов и рОН в 0,01М растворе гидроксида аммония.


[OH — ] — ? [OH — ] =
рОН — ? Ко = 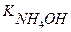
[OH — ] =
рОН = -lg [OH — ] = -lg 4,23 ·10 -2 = -(lg 4,23 + lg 10 -2 ) = = — (0,6263 – 2) = 1,37
Ответ:[OH — ] = 4,23∙10 -2 моль/л, рОН = 1,37.
Вычислить рН раствора, содержащего 0,01М СН3СООН и 0,05М СН3СООNa.

С(СН3СООН)=0,01моль/л Данный раствор представляет собой

кислоту и её соль.
рН — ? [H + ] =
Kк = 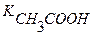
[H + ] = 1,86∙10 -5 ∙ 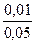
рН = — lg [H + ] = — lg 3,72∙10 -6 = — (lg 3,72 +
+ lg 10 -6 ) = — (0,5705 – 6) = 5,43
Вычислить рН раствора, содержащего в 1л 0,056 моль NH4OH и 0,1 моль NH4CI.

С(NH4OH)=0,056 моль/л Данный раствор представляет собой
С(NH4CI)=0,1 моль/л буферную смесь, содержащую слабое

рН — ? [OH — ] =
рОН = — lg [OH — ], pH = 14 – pOH
Ko = 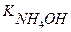
[OH — ] = 1,79∙10 -5 ∙ 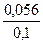
рН = 14 – рОН = 14 – 5 = 9
Вычислить константу гидролиза сульфита натрия по I ступени.
Na2SO3 – соль образована сильным основанием и слабой кислотой, следовательно, гидролизуется по аниону.
Кг =
Кг = 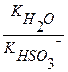
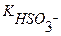
Кг =
Вычислить константу гидролиза нитрита аммония.
NH4NO2 – соль образована слабым основанием и слабой кислотой, следовательно, гидролизуется по катиону и аниону.
Кг =
▼ Задачи для самостоятельного решения
1. Вычислить ионную силу:
а) 0,03М раствора ВаСI2; б) 0,01М раствора НСI; в) 0,02М раствора К2SO4.
Ответ: а) 0,09; б) 0,01; в) 0,06.
2. Чему равна ионная сила раствора, содержащего в 1л:
а) 0,1 моль НСI и 0,2 моль СаСI2; б) 0,02 моль NaCI и 0,1 моль Ca(NO3)2.
Ответ: а) 0,7; б) 0,32.
3. Вычислить концентрацию ионов Н + в 0,01М растворе угольной кислоты (без учета второй ступени диссоциации кислоты).
Ответ: 6,57∙10 -5 моль/л.
4. Вычислить концентрацию ионов Н + в 0,025М растворе Н2S (без учета второй ступени диссоциации).
Ответ: 4,7∙10 -5 моль/л.
5. Вычислить концентрацию ионов Н + и степень диссоциации уксусной кислоты, если известно, что в 300 мл её раствора содержится 0,8508г СН3СООН. 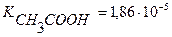
Ответ: [H + ] = 9,35 10 -4 моль/л; α = 1,99%.
6. Вычислить концентрацию гидроксид-ионов в растворах:
а) 0,05М NaOH; б) 0,025М NH4OH.
Ответ: а) 5∙10 -2 моль/л; б) 6,69∙10 -4 моль/л.
7. Вычислить концентрацию ионов Н + в растворах:
Ответ: а) 10 -1 моль/л; б) 1,77 10 -13 моль/л.
а) 0,005М раствора НСI; б) 0,015М раствора КОН; в) 0,01М раствора СН3СООН; г) 0,001М раствора NH4OH.
Ответ: а) 2,3; б) 12,18; в) 3,37; г) 10,13.
9. Вычислить рН раствора, содержащего в 1л:
а) 0,06 моль уксусной кислоты и 0,02 моль ацетата натрия;
б) 0,045 моль гидроксида аммония и 0,15 моль хлорида аммония;
в) 0,01 моль бензойной кислоты и 0,02 моль бензоата натрия;
г) 0,025 моль муравьиной кислоты и 0,015моль формиата натрия.
Ответ: а) 4,25; б) 8,73; в) 4,49; г) 3,53.
10. Вычислить рН буферных смесей, содержащих:
а) 0,01М СН3СООН и 0,01М СН3СООNa;
б) 0,5М СН3СООН и 0,01М СН3СООNa;
в) 0,1М НСООН и 0,05М НСООNa;
Ответ: а) 4,73; б) 3,03; в) 3,45; г) 8,55; д) 9,55
11. Вычислить константу гидролиза следующих солей:
а) хлорида аммония; б) ацетата аммония; в) ацетата калия; г) карбоната калия по I ступени; д) нитрита натрия.
Ответ: а) 5,6∙10 -10 ; б) 3∙10 -5 ; в) 5,4∙10 -10 ; г) 1,8∙10 -4 ; д) 2,5∙10 -11 .
? Контрольные вопросы
1. Буферные растворы. Буферное действие растворов. Механизм действия ацетатного и аммонийного буферных растворов.
2. Приведите примеры слабых кислот (не менее 2-х) и слабых оснований (не менее 2-х). Напишите для них уравнения диссоциации, выражения констант диссоциации. Приведите формулу зависимости между константой диссоциации и степенью диссоциации.
3. Гидролиз. Определите тип гидролиза следующих солей ZnSO4, Na2CO3, NH4CN. Напишите уравнения гидролиза данных солей в ионном и молекулярном виде.
4. Значение гидролиза в аналитической практике. Как сказывается на гидролизе сульфида аммония добавление к раствору гидроксида аммония (напишите уравнение гидролиза и объясните).
Дата добавления: 2015-02-13 ; просмотров: 8431 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://chemer.ru/services/hydrolysis/salts/Na2S
http://helpiks.org/2-59383.html