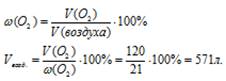Строение, свойства углерода и кремния
Задача 965.
Написать уравнение гидролиза Na 2 SiO 3 . Как изменится степень гидролиза Na 2 SiO 3 при добавлении к раствору хлорида аммония?
Решение :
Na 2 SiO 3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
SiO3 2- двухзарядный ион, значит, гидролизуется по двум ступеням. Гидролиз обычно протекает только по первой ступени:
SiO 3 2- + H2O ↔ HSiO3 – + OH – (ионно-молекулярная форма);
Na2SiO3 + Н2О ↔ NaHSiO3 + NaOH (молекулярная форма).
Образующийся избыток ионов OH – придаёт раствору щелочную среду, рН > 7.
б) При добавлении к раствору Na2SiO3 хлорида аммония, как соли, гидролизующейся по катиону, будет наблюдаться избыток ионов водорода Н + :
Образуемый при гидролизе обеих солей избыток ионов Н + и ОН¯ провзаимодействует между собой с образованием молекул Н2О (Н+ + ОН¯ ? Н2О). Дополнительное образование Н2О, согласно принципу Ле Шателье, сместит равновесие системы вправо, в сторону усиления гидролиза обеих солей.
Задача 966.
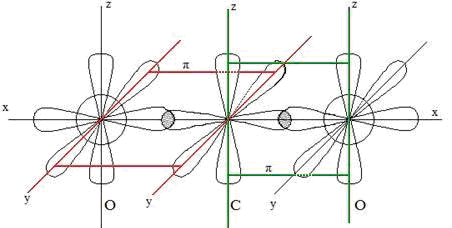
Каким типом гибридизации АО углерода можно описать строение молекулы СО2: а) sр; б) sp 2 ; в) sp 3 ; г) гибридизации не происходит?
Потому что: 1) ковалентность углерода в этом соединении равна четырем; 2) молекула неполярна; З) кратность связи углерод — кислород больше единицы.
Решение:
Установлено, что молекула СО2 имеет линейное строение О = С = О или :O:: С::O: Молекула неполярна. Атом углерода соединён с двумя атомами кислорода двойными связями. Такое возможно, если атом углерода находится в состоянии sp-гибридизации. Два образующихся sp-гибридных облака имеют ассиметричную форму, которая обеспечивает большее перекрывание с электронными облаками атомов кислорода. Поскольку два гибридных облака в результате взаимного отталкивания располагаются относительно ядра атома углерода таким образом, что угол между ними составляет 180 0 (рис. 1.):
Рис. 1. Схема строения молекулы СО2
(По материалам Российского химико-технологического университета
им. Д.И. Менделеева http://olimp.distant.ru/2013/otvety-13.htm).
В результате такого расположения гибридных электронных облаков молекула СО2 имеет линейное строение, т. е. ядра атомов кислорода и углерода располагаются на одной прямой. Получается, что в молекуле СО2 атом углерода соединён с двумя атомами кислорода с помощью двойных связей. Между центральным атомом углерода и двумя атомами кислорода образуются σ — связи за счёт sp- гибридных облаков атома углерода и р-облаков атомов кислорода, а π -связи образуются за счёт перекрывания р-облаков атома углерода и р-облаков атомов кислорода.
Задача 967.
Какие из перечисленных газов при пропускании их через раствор щелочи вступают с ней в реакцию: а) СО; б) СО2; в) НСN; г) СF4?
Решение:
а) Едкие щёлочи и монооксид углерода взаимодействуют друг с другом с образованием соли муравьиной кислоты:
CO + NaOH = HCООNa.
формиат
натрия
б) Действием диоксида углерода на растворы щелочей получают соли угольной кислоты:
Здесь проявляются кислотные свойства СО2, как кислотного оксида.
в) Как кислота НСN реагирует с NaOH (реакция нейтрализация):
HCN + NaOH = NaCN + H2O.
г) Фторид углерода не реагирует с гидроксидом натрия, реакция не протекает.
Гидролиз метасиликата натрия
Na2SiO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
Na2SiO3 + HOH ⇄ NaHSiO3 + NaOH
Полное ионное уравнение
2Na + + SiO3 2- + HOH ⇄ Na + + HSiO3 — + Na + + OH —
Сокращенное (краткое) ионное уравнение
SiO3 2- + HOH ⇄ HSiO3 — + OH —
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
NaHSiO3 + HOH ⇄ H2SiO3 + NaOH
Полное ионное уравнение
Na + + HSiO3 — + HOH ⇄ H2SiO3 + Na + + OH —
Сокращенное (краткое) ионное уравнение
HSiO3 — + HOH ⇄ H2SiO3 + OH —
Среда и pH раствора метасиликата натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Написать уравнение гидролиза Na 2 Si0 3 . Как изменится степень гидролиза Na 2 SiО 3 при добавлении к раствору хлорида аммония?
Na2SiO3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
SiO3 2- двухзарядный ион, значит, гидролизуется по двум ступеням. Гидролиз обычно протекает только по первой ступени:
SiO3 2- + H2O ↔ HSiO3 – + OH – (ионно-молекулярная форма);
Na2SiO3 + Н2О ↔ NaHSiO3 + NaOH (молекулярная форма).
Образующийся избыток ионов OH – придаёт раствору щелочную среду, рН > 7.
б) При добавлении к раствору Na2SiO3 хлорида аммония, как соли, гидролизующейся по катиону, будет наблюдаться избыток ионов водорода Н + :
Образуемый при гидролизе обеих солей избыток ионов Н + и ОН¯ провзаимодействует между собой с образованием молекул Н2О (Н+ + ОН¯ ? Н2О). Дополнительное образование Н2О, согласно принципу Ле Шателье, сместит равновесие системы вправо, в сторону усиления гидролиза обеих солей.
7. Определить количественный состав смеси кремния, алюминия и карбоната кальция, если известно, что при обработке этой смеси раствором щелочи выделяется 8,96 л газа, а при обработке такой же навески исходной смеси раствором НСl также выделяется 8,96 л газа, пропускание которого через раствор Са(ОН)2 приводит к образованию 8,1 г Са(НСОз)2 .
Со щелочью будут реагировать кремний и алюминий:
2) 2Al + 2NaOH + 6H2O = 2Na[Al (OH) 4] + 3H2 (реакция пойдет именно так, потому что добавляем раствор щелочи, а не сплавляем с чистой щелочью).
С соляной кислотой будут реагировать алюминий и карбонат кальция:
4) CaCO3 + 2HCl = CaCl2 + CO2 + H2O.
В случае обработки кислотой имеем газовую смесь. Однако дальнейшее пропускание ее через раствор гидроксида кальция позволяет узнать, сколько в ней углекислого газа:
Переходим к уравнению 4) .
V (CO2) = n (CO2) * Vm = 0,2*22,4 = 4,48 л. Тогда водорода при обработке смеси соляной кислотой выделяется: 8,96 — 4,48 = 4,48 л.
n (Al) = (n (H2) / 3) * 2 = (0,2/3) * 2 = 0,13 моль.
Переходим к уравнению 2):
Всего при обработке смеси раствором щелочи выделилось 8,96 л водорода. Сколько выделилось при реакции с алюминием, выяснили. Значит при реакции с кремнием:
n (Si) = n (H2) / 2 = 0,2/2 = 0,1 моль.
n (Si) = 0,1 моль. = > m (Si) = M (Si) * n (Si) = 28*0,1 = 2,8 г.
n (Al) = 0,4 моль. = > m (Al) = M (Al) * n (Al) = 27*0,4 = 10,8 г.
n (CaCO3) = 0,2 моль. = > m (CaCO3) = M (CaCO3) * n (CaCO3) = 100*0,2 = 20 г.
8. Сколько миллилитров 28%-ного раствора NаОН (р = 1,31 г/см ) потребуется для растворения кремния, образовавшегося при прокаливании 6г магния с 6г SiO2
1) n(Mg)= 6г/24г/моль= 0.25 моль
2) n(SiO2)= 6г/60г/моль= 0.1 моль
6) 2n(NaOH)= n(Si)==0.2 моль
7) m (NaOH) = n*Mr/u=0.2 моль *40 г/моль/ 28%= 28.5 г
8) V=m/p = 28.5 г/1.31 г/см = 21.75 мл
9. Определите объем воздуха (н.у.) необходимый для полного сгорания 60 л (н.у.) метана (СН4).
Дано:
объем (н.у.) сгоревшего метана: V(СН4) = 60 л.
Найти:
объем (н.у.) расходовавшегося воздуха: Vвозд. =?
Решение:
Данных, представленных в условии, явно недостаточно для решения задачи. Нам необходимо дополнительно знать количественный состав воздух.
В данном случае в реакции горения метана принимает участие только кислород. Все остальные компоненты представляют собой неактивные примеси. Записываем уравнение реакции:
Алгоритм решения можно представить следующим образом:
1. По уравнению горения определим объем кислорода, необходимого для сгорания 60 л метана.
Составим пропорцию:
для сгорания 60 л (СН4) необходимо х л (О2) (по условию)
для сгорания 22,4 л (СН4) необходимо 44,8 л (О2) (по уравнению)
Можно было также найти объем кислорода по закону объемных отношений.
2. Используя дополнительную информацию о содержании кислорода в воздухе, определяем объем воздуха:
Ответ: 571 л воздуха (н.у.) потребуется для полного сгорания 60 л (н.у.) метана.
http://chemer.ru/services/hydrolysis/salts/Na2SiO3
http://poisk-ru.ru/s56815t21.html