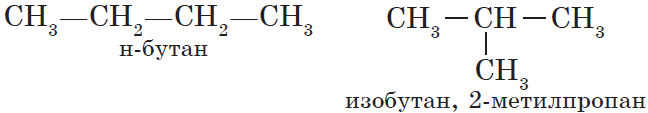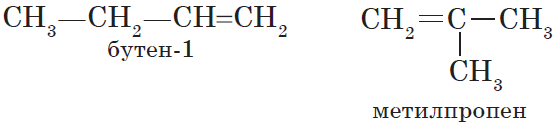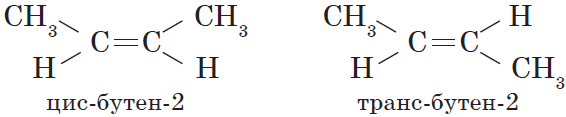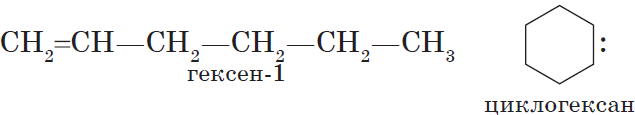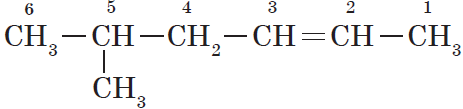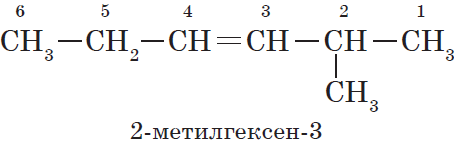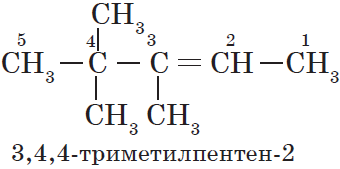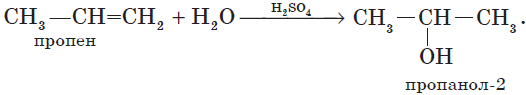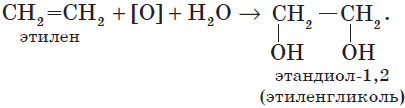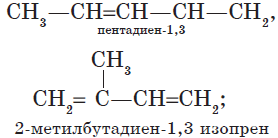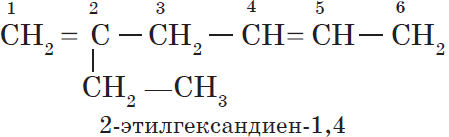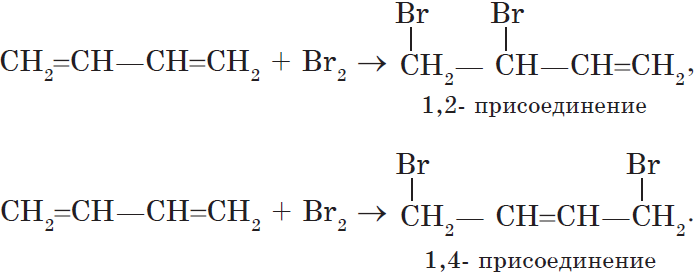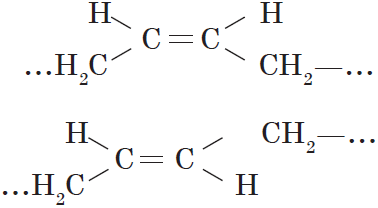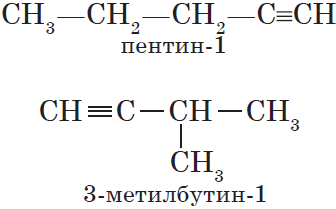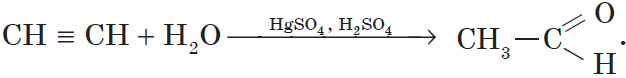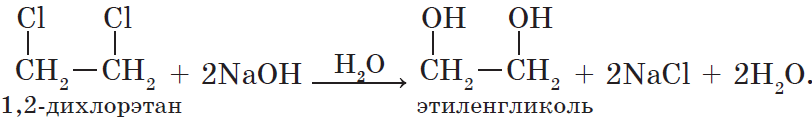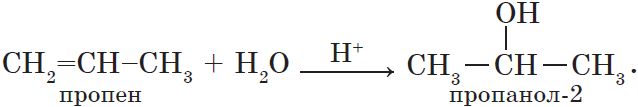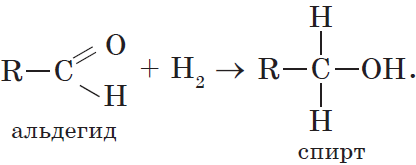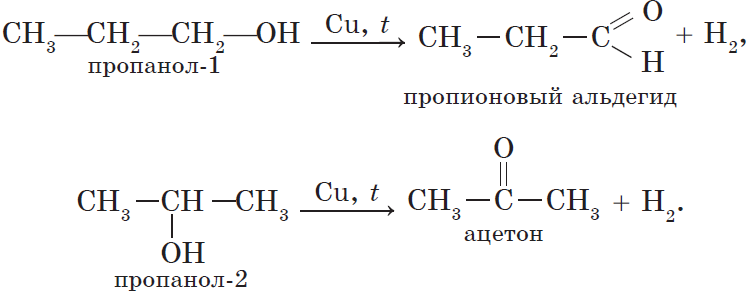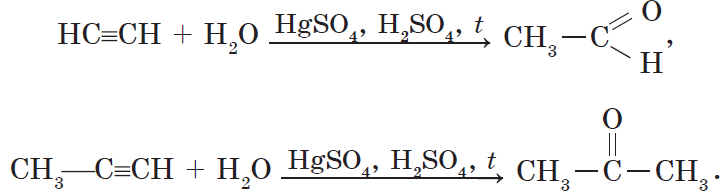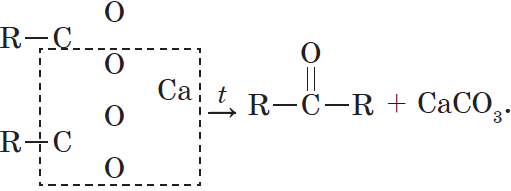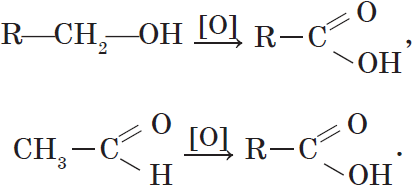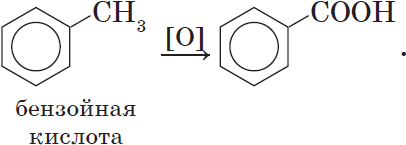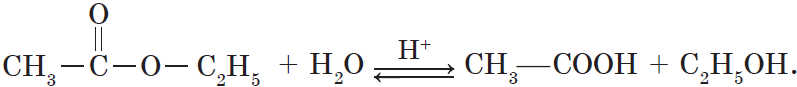Свойства углеводородов. Получение углеводородов
Теория к заданию 13 из ЕГЭ по химии
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов, ароматических углеводородов
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
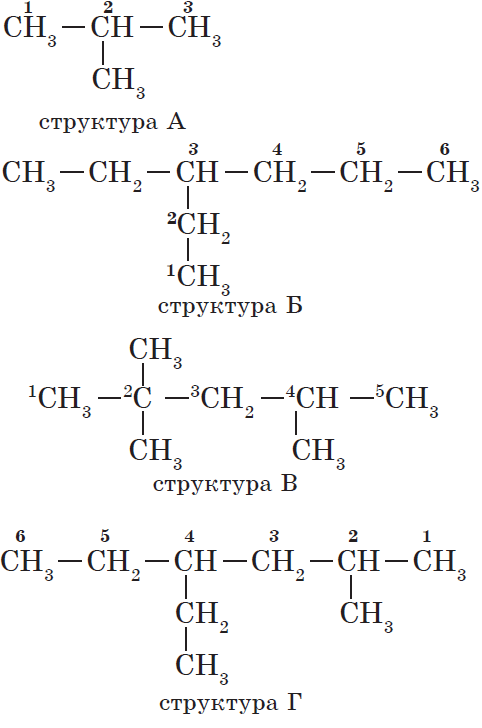
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_<12>$ до $С_<15>Н_<32>$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
Термическое расщепление углеводородов:
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
При нагревании до температуры $1500°С$ возможно образование ацетилена:
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
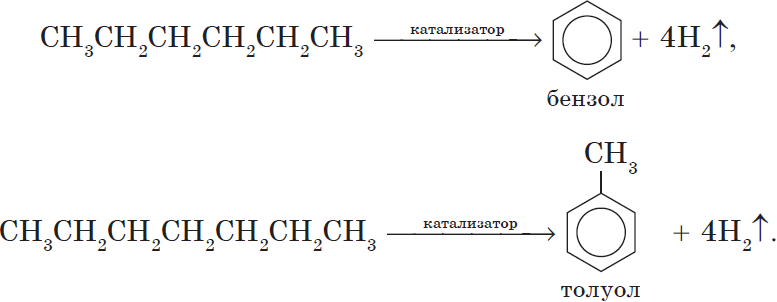
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_<10>$ — пентен, $С_6Н_<12>$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_<10>$ – $С_<16>Н_<32>$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
3. Гидрогалогенирование (присоединение галогеноводорода).
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
— алкадиены с сопряженными двойными связями;
— алкадиены с изолированными двойными связями
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
Цис-, транс-изомерия (пространственная и геометрическая)
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Физические и химические свойства алкадиенов
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_<10>$ — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_<10>$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
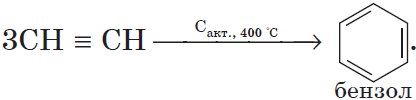
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
Это вещество используется для получения хлоропрена:
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(. -H_2C-CCl=CH-CH_2-. )_n$
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Реакции, характеризующие основные способы получения кислородсодержащих соединений
1. Гидролиз галогеналканов. Вы уже знаете, что образование галокеналканов при взаимодействии спиртов с галогеноводородами — обратимая реакция. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой:
Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле. Например:
2. Гидратация алкенов — присоединение воды по $π$-связи молекулы алкена — уже знакома вам, например:
Гидратация пропена приводит, в соответствии с правилом Марковникова, к образованию вторичного спирта — пропанола-2:
3. Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов:
4. Окисление алкенов. Гликоли, как уже отмечалось, могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена):
5. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода (II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка):
Необходимую для этой реакции смесь угарного газа и водорода, называемую также синтез-газом ($СО + nН_2О$), получают при пропускании паров воды над раскаленным углем:
6. Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времен:
Способы получения альдегидов и кетонов
Альдегиды и кетоны могут быть получены окислением или дегидрированием спиртов. Еще раз отметим, что при окислении или дегидрировании первичных спиртов могут быть получены альдегиды, а вторичных спиртов — кетоны:
Реакция Кучерова. Из ацетилена в результате реакции гидратации получается уксусный альдегид, из гомологов ацетилена — кетоны:
При нагревании кальциевых или бариевых солей карбоновых кислот образуются кетон и карбонат металла:
Способы получения карбоновых кислот
Карбоновые кислоты могут быть получены окислением первичных спиртов альдегидов:
Ароматические карбоновые кислоты образуются при окислении гомологов бензола:
Гидролиз различных производных карбоновых кислот также приводит к получению кислот. Так, при гидролизе сложного эфира образуются спирт и карбоновая кислота. Как уже говорилось выше, реакции этерификации и гидролиза, катализируемые кислотой, обратимы:
Гидролиз сложного эфира под действием водного раствора щелочи протекает необратимо, в этом случае из сложного эфира образуется не кислота, а ее соль:
Способы получения аренов
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
| Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород |
| Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород |
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Углеводороды
Содержание:
Углеводороды органические соединения, в состав которых входят только два элемента: углерод и водород.
Например: CH4, C2H6, C3H6, C6H6, C8H10 и т. п. В общем виде СxHy.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Углеводороды
Углеводороды имеют важное научное и практическое значение. Вопервых, представления о строении и свойствах этих веществ служат основой для изучения органических соединений других классов, т. к. молекулы любых органических веществ содержат углеводородные фрагменты. Во-вторых, знание свойств углеводородов позволяет понять исключительную ценность этих соединений как исходного сырья для синтеза самых разнообразных органических веществ, широко используемых человеком.
Углеводороды содержатся в земной коре в составе нефти, каменного и бурого углей, природного и попутного газов, сланцев и торфа. Запасы этих полезных ископаемых на Земле не безграничны. Однако до настоящего времени они расходуются главным образом в качестве топлива (двигатели внутреннего сгорания, тепловые электростанции, котельные) и лишь незначительная часть используется как сырье в химической промышленности. Так, до 85% всей добываемой нефти идет на получение горюче-смазочных материалов и лишь около 15% применяется как химическое сырье. Поэтому важнейшей задачей является поиск и разработка альтернативных источников энергии, которые позволят более рационально использовать углеводородное сырье.
Предельные углеводороды (алканы)
Углеводороды — простейшие органические соединения, состоящие из двух элементов: углерода и водорода. Предельными углеводородами, или алканами (международное название), называются соединения, состав которых выражается общей формулой СnН2n+2, где n — число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Алканы называют также насыщенными углеводородами или парафинами.
Первым членом гомологического ряда алканов является метан СН4. Окончание —ан является характерным для названий предельных углеводородов. Далее следует этан С2Н6, пропан С3Н8, бутан С4Н10. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания —ан. Это пентан С5Н12, гексан С6Н14, гептан С7Н16, октан C8H18, нонан С9Н20, декан С10Н22 и т. д.
В гомологическом ряду наблюдается постепенное изменение физических свойств углеводородов: повышаются температуры кипения и плавления, возрастает плотность. При обычных условиях (температура
22°С) первые четыре члена ряда (метан, этан, пропан, бутан) — газы, с С5Н12 до С16Н34 — жидкости, а с С17Н36 — твердые вещества.
Алканы, начиная с четвертого члена ряда (бутана), имеют изомеры (см. § 15.3).
Все алканы насыщены водородом до предела (максимально). Их атомы углерода находятся в состоянии sp 3 -гибридизации, а значит, имеют простые (одинарные) связи.
Номенклатура алканов и их производных
Названия первых десяти членов ряда предельных углеводородов уже даны. Чтобы подчеркнуть, что алкан имеет неразветвленную углеродную цепь, часто к названию добавляют слово нормальный (н-), например:
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, называемые углеводородными радикалами (сокращенно обозначаются буквой R). Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания —ан на —ил. Вот соответствующие примеры:
Радикалы образуются не только органическими, но и неорганическими соединениями. Так, если от азотной кислоты отнять гидроксильную группу ОН, то получится одновалентный радикал — NO2, называемый нитрогруппой, и т. д.
При отнятии от молекулы углеводорода двух атомов водорода получаются двухвалентные радикалы. Их названия также производятся от названий соответствующих предельных углеводородов с заменой окончания —ан на —илиден (если атомы водорода оторваны от одного атома углерода) или —илен (если атомы водорода оторваны от двух соседних атомов углерода). Радикал СН2= имеет название метилен.
Названия радикалов используются в номенклатуре многих производных углеводородов. Например; СН3I — йодистый метил, С4Н9Сl — хлористый бутил, СН2Сl2 — хлористый метилен, С2Н4Вг2—бромистый этилен (если атомы брома связаны с разными атомами углерода) или бромистый этилиден (если атомы брома связаны с одним атомом углерода).
Для названия изомеров широко применяют две номенклатуры: старую — рациональную и современную — заместительную, которую также называют систематической или международной (предложена Международным союзом теоретической и прикладной химии ИЮПАК).
По рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы. Если в формуле одинаковые радикалы повторяются несколько раз, то их указывают греческими числительными: ди — два, три — три, тетра — четыре, пента — пять, гекса — шесть и т. д. Например:
Рациональная номенклатура удобна для не очень сложных соединений.
По заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители. В этом случае выбирают наиболее длинную цепь углеродных атомов и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал (начиная с простейшего радикала); 2) углеводород, которому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми. Вот как по этой номенклатуре следует назвать изомеры гексана:
А вот более сложный пример:
Как заместительная, так и рациональная номенклатура применяются не только для углеводородов, но и для других классов органических соединений. Для некоторых органических соединений используются исторически сложившиеся (эмпирические) или так называемые тривиальные названия (муравьиная кислота, серный эфир, мочевина и др.).
При написании формул изомеров легко заметить, что атомы углерода занимают в них неодинаковое положение. Атом углерода, который связан только с одним атомом углерода в цепи, называется первичным, с двумя — вторичным, с тремя — третичным, с четырьмя — четвертичным. Так, например, в последнем примере атомы углерода 1 и 7 — первичные, 4 и 6 — вторичные, 2 и 3 — третичные, 5 — четвертичный. Свойства атомов водорода, других атомов и функциональных групп зависят от того, с каким углеродным атомом они связаны: о первичным, вторичным или третичным. Это всегда надо учитывать.
Химические свойства метана и его гомологов
Члены гомологического ряда алканов имеют общие химические свойства. Это — малоактивные вещества. Все реакции с их участием можно подразделить на два типа: реакции с разрывом связей С — Н (например, реакции замещения) и реакции с разрывом связей С — С при котором происходит расщепление молекул на отдельные осколки (крекинг).
Радикалы существуют ничтожные доли секунды и очень активны в момент образования. Так, они легко взаимодействуют между собой, образуя из неспаренных электронов новую ковалентную связь. Например:
Они легко реагируют и с молекулами органических веществ, присоединяясь к ним или отрывая от них атом с неспаренным электроном. В результате образуются новые радикалы, которые могут реагировать с другими молекулами. Примером может служить радикальная полимеризация непредельных соединений:
В ходе такой цепной реакции образуются макромолекулы (см. § 16.7), рост которых продолжается до тех пор, пока не оборвется цепь, например при соединении двух радикалов.
Как отмечалось ранее, реакциями свободных радикалов объясняются многие важные химические процессы — окисление, взрывы, полимеризация непредельных соединений, крекинг нефти и др.
Химические свойства алканов подробнее рассматриваются на примере метана.
Строение молекулы и свойства метана. Электронное строение молекулы метана рассмотрено в § 3.2. Атом углерода в молекуле метана находится в состоянии sр 3 -гибридизации. В результате перекрывания четырех гибридных орбиталей атома углерода с s-орбиталями атомов водорода образуется весьма прочная молекула метана. Электронное строение молекулы метана см. рис. 3.11.
Метан — газ без цвета и запаха, легче воздуха, мало растворим в воде. Предельные углеводороды способны гореть, образуя оксид углерода (IV) и воду. Метан горит бледным синеватым пламенем:
В смеси с воздухом (или с кислородом, особенно в соотношении по объему 1:2, что видно из уравнения реакции) метан образует взрывчатые смеси. Поэтому он опасен как в быту (утечка газа через краны), так и в шахтах. При неполном сгорании метана образуется сажа.Так ее получают в промышленных условиях. В присутствии катализаторов при окислении метана получают метиловый спирт и формальдегид (см. § 17.2 и 17.6).
При сильном нагревании метан распадается по уравнению
В печах специальной конструкции распад метана может быть осуществлен до промежуточного продукта — ацетилена:
Себестоимость такого ацетилена почти в два раза ниже себестоимости ацетилена, полученного из карбида кальция.
Конверсией метана с водяным паром получают водород (см. § 8.2).
Для метана характерны реакции замещения. На свету при обычной температуре галогены — хлор и бром — постепенно (по стадиям) вытесняют из молекулы метана водород, образуя так называемые галогенопроизводные. Атомы хлора замещают атомы водорода в ней с образованием смеси различных соединений: СН3Сl — хлорметана (хлористого метила), СН2Сl2— дихлорметана (хлористого метилена), СНСl3 — трихлорметана (хлороформа), ССl4 — тетрахлорметана (четыреххлористого углерода). Из этой смеси каждое соединение может быть выделено. Важное значение имеют хлороформ и тетрахлорметан как растворители смол, жиров, каучука и других органических веществ.
Образование галогенопроизводных метана протекает по цепному свободнорадикальному механизму. Под действием света молекулы хлора распадаются на неорганические радикалы:
Неорганический радикал 
Свободный радикал взаимодействуете молекулой хлора Сl2, образуя галогенопроизводное и радикал хлора:
Радикал хлора снова продолжает цепь превращений и т. д.
Метан при обычной температуре обладает большой стойкостью к кислотам, щелочам и многим окислителям. Однако он вступает в реакцию с азотной кислотой:
Метан не способен к реакциям присоединения, поскольку в его молекуле все валентности насыщены.
Приведенные реакции замещения сопровождаются разрывом связей С — Н. Однако известны процессы, при которых происходит не только расщепление связей С — Н, но и разрыв цепи углеродных атомов (у гомологов метана). Эти реакции протекают при высоких температурах и в присутствии катализаторов. Например:
Процесс (а) называется дегидрогенизацией, процесс (б) — крееингом.
Окислением предельных углеводородов получают кислоты: уксусную кислоту из бутана (см. § 17.12) и жирные кислоты с большой молекулярной массой из парафина (см. § 17.15).
Получение алканов. Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (90—98%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дна болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным газом или рудничным газом.
В лабораторных условиях метан получают при нагревании смеси ацетата натрия с гидроксидом натрия:
или при взаимодействии карбида алюминия с водой:
В последнем случае метан получается весьма чистым.
Метан может быть получен из простых веществ при нагревании в присутствии катализатора:
а также синтезом на основе водяного газа
Этот способ имеет промышленное значение. Однако используют обычно метан природных газов или газов, образующихся при коксовании каменных углей и при переработке нефти.
Гомологи метана, как и метан, в лабораторных условиях получают прокаливанием солей соответствующих органических кислот с щелочами. Другой способ — реакция Вюрца, т. е. нагревание моногалогенопроизводных с металлическим натрием, например:
В технике для получения синтетического бензина (смесь углеводородов, содержащих 6—10 атомов углерода) применяют синтез из оксида углерода (II) и водорода в присутствии катализатора (соединения кобальта) и при повышенном давлении. Процесс можно выразить уравнением
Применение алканов. Зная свойства метана, можно составить представление о его применении. Оно весьма разнообразно. Благодаря большой теплотворной способности метан в больших количествах расходуется в качестве топлива (в быту — бытовой газ и в промышленности). Широко применяются получаемые из него вещества: водород, ацетилен, сажа. Он служит исходным сырьем для получения формальдегида, метилового спирта, а также различных синтетических продуктов.
Большое промышленное значение имеет окисление высших предельных углеводородов — парафинов с числом углеродных атомов 20 — 25. Этим путем получают синтетические жирные кислоты с различной длиной цепи, которые используются для производства мыл, различных моющих средств, смазочных материалов, лаков и эмалей.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко, используются в органическом синтезе.
Циклоалканы
Помимо предельных углеводородов с открытой цепью, имеются предельные углеводороды с замкнутой (циклической) цепью. Они имеют несколько названий: циклоалканы, циклопарафины, нафтены, циклоны, полиметилены. Примеры таких соединений:
Молекулы циклоалканов содержат на два атома водорода меньше, чем соответствующие алканы (за счет их отщепления замыкается углеродное кольцо). Поэтому общая формула циклоалканов СnН2n.
Циклоалканы были выделены из бакинской нефти и подробно изучены В. В. Марковниковым. По химическим свойствам они близки к алканам: горючи, химически малоактивны, атомы водорода замещаются галогенами. Трех- и четырехчленные циклоалканы менее прочны, чем пяти- и шестичленные. Из химических свойств циклоалканов выделим очень важную реакцию дегидрогенизации циклогексана (отщепления водорода) с образованием бензола (см. § 16.12):
Циклоалканы и их гомологи относятся к карбоциклическим соединениям.
Непредельные углеводороды
Непредельными называются углеводороды, в молекулах которых имеются атомы углерода, связанные между собой двойными или тройными связями. Их также называют ненасыщенными углеводородами, так как их молекулы имеют меньшее число атомов водорода, чем насыщенные.
Первыми представителями гомологических рядов непредельных углеводородов являются этилен (с двойной связью) и ацетилен (о тройной связью):
Электронная природа двойных и тройных связей рассмотрена в § 3.2 и 10.2.
Двойная связь состоит из одной 




Тройная связь состоит из одной 

Как следует из электронного строения, кратные связи (двойные и тройные) сравнительно легко (легче, чем одинарные) разрываются при химическом взаимодействии.
Гомологические ряды непредельных углеводородов. Соединения гомологического ряда этилена изображаются общей формулой СnН2n. Названия гомологов по рациональной номенклатуре производятся от названий соответствующих предельных углеводородов путем замены окончания —ан на —илен. Например: этан С2Н6 — этилен С2Н4, пропан С3Н8 — пропилен С3Н6 и т. д.
По заместительной номенклатуре названия этиленовых углеводородов производят от названий предельных углеводородов, заменяя окончание —ан на —ен (ен — двойная связь) с указанием номера атома углерода при двойной связи (главную цепь нумеруют с того конца, к которому ближе расположена двойная связь). Например:
Общее международное название этиленовых углеводородов — алкены. Непредельные углеводороды ряда этилена, содержащие одну двойную связь, называются олефинами.
Радикал этилена СН2=СН—, называемый винилом, является составной частью ряда молекул. Например:
Гомологический ряд ацетилена выражается формулой СnН2n-2. Гомологи рассматривают как производные ацетилена и называются метилацетилен (С3Н4), этилацетилен (С4Н6) и т. д.
Названия ацетиленовых углеводородов по заместительной номенклатуре производят от названий предельных углеводородов, заменяя окончание —ан на —ин. Главную цепь нумеруют с того конца, к которому ближе расположена тройная связь. Например:
Общее название ацетиленовых углеводородов по заместительной номенклатуре — алкины.
Химические свойства непредельных углеводородов рассматриваются на примерах этилена и ацетилена.
Этилен и его гомологи
Свойства. Этилен — первый член гомологического ряда — бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, мало растворим в воде.
По химическим свойствам этилен резко отличается от метана, что обусловлено электронным строением его молекулы. Имея в молекуле двойную связь, состоящую из 


Способность к реакциям присоединения характерна для всех алкенов. Рассмотрим наиболее типичные из них.
1. Присоединение водорода. Эта реакция протекает в присутствии катализатора — мелко раздробленного никеля, платины или палладия — при комнатной температуре:
Присоединение водорода к веществу называется реакцией гидрирования или гидрогенизации.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Присоединение галогенов. Реакция протекает при обычных условиях. Например:
Дихлорэтан—жидкость, хорошо растворяет органические вещества.
Реакция присоединения брома служит качественной реакцией на непредельные углеводороды. О наличии последних судят по обесцвечиванию красно-бурой окраски бромной воды.
3. Присоединение галогеноводородов:
Легко сделать вывод, что галогенопроизводные углеводородов, например хлористый этил СН3—СН2Сl, можно получить двумя путями: или присоединением к этилену хлороводорода, или замещением водорода в этане на хлор.
Присоединение галогеноводородов к гомологам этилена происходит по правилу В. В. Марковникова: атом водорода становится к наиболее гидрогенизованному атому углерода, а атом галогена — к наименее гидрогенизованному. Например:
4. Присоединение воды (реакция гидратации). Реакция протекает в присутствии катализатора — серной кислоты:
Это суммарное уравнение реакции. В действительности реакция протекает в две стадии. Сначала происходит присоединение серной кислоты к этилену по месту разрыва двойной связи с образованием этилсерной кислоты:
Затем этилсерная кислота, взаимодействуя с водой, образует спирт и кислоту:
В настоящее время реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, содержащихся в газах крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством этилена и его гомологов является способность легко окисляться уже при обычной температуре. При этом окислению подвергаются оба атома углерода, соединенные двойной связью. Если этилен пропускать через водный раствор перманганата калия КМnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена перманганатом калия:
Эта реакция используется для установления непредельности органического вещества — наличия в нем двойных или тройных связей.
Этилен горит светящимся пламенем с образованием оксида углерода (IV) и воды:
Для этилена, как и для всех непредельных углеводородов, характерны реакции полимеризации (см. § 16.7).
Получение. В лабораторных условиях этилен получают при нагревании этилового спирта с водоотнимающими веществами [концентрированной серной кислотой, оксидом фосфора (V) и др.]:
Это процесс, обратный получению спирта из этилена (см. выше). Его можно представить так. Сначала спирт взаимодействует с серной кислотой, образуя этилсерную кислоту и воду:
Затем этилсерная кислота при температуре 180—200°С распадается на серную кислоту и этилен:
Олефины получают также при нагревании галогенопроизводных с концентрированным спиртовым раствором щелочи:
В промышленных условиях этилен и его гомологи выделяют из газов крекинга нефти. Весьма важный способ их получения — дегидрирование соответствующих предельных углеводородов над никелевым катализатором:
Применение. Этилен применяется для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов (помидоров, цитрусовых и др.) при введении небольших количеств его в воздух теплиц. Этилен и его гомологи используются как химическое сырье для синтеза многих органических веществ.
Реакции полимеризации. Полиэтилен
Полимеризация—это последовательное соединение одинаковых молекул в более крупные. Простой случай реакции полимеризации рассмотрен на примере оксида азота (IV) (см. § 10.6).
Реакции полимеризации особенно характерны для непредельных соединений. Так, например, из этилена образуется высокомолекулярное вещество — полиэтилен. Соединение молекул этилена происходит по месту разрыва двойной связи:
Сокращенно уравнение этой реакции записывается так:
К концам таких молекул (макромолекул) присоединяются какие-нибудь свободные атомы или радикалы (например, атомы водорода из этилена). Продукт реакции полимеризации называется полимером (от греческого поли — много, мерос — часть), а исходное вещество, вступающее в реакцию полимеризации, называется мономером.
Полимер — вещество с очень высокой молекулярной массой, молекула которого состоит из большого числа повторяющихся группировок, имеющих одинаковое строение. Эти группировки называют элементарными звеньями или структурными единицами. Например, элементарным звеном полиэтилена является группировка атомов —СН2—СН2—.
Число элементарных звеньев, повторяющихся в макромолекуле, называется степенью полимеризации (обозначается n). В зависимости от степени полимеризации из одних и тех же мономеров можно получать вещества с различными свойствами. Так, полиэтилен с короткими цепями (n=20) является жидкостью, обладающей смазочными свойствами. Полиэтилен с длиной цепи в 1500 — 2000 звеньев представляет собой твердый, но гибкий пластический материал, из которого можно получать пленки, изготовлять бутылки и другую посуду, эластичные трубы и т. д. Наконец, полиэтилен с длиной цепи в 5 — 6 тыс. звеньев является твердым веществом, из которого можно готовить литые изделия, жесткие трубы, прочные нити.
Если в реакции полимеризации принимает участие небольшое число молекул, то образуются низкомолекулярные вещества, например димеры, тримеры и т. д. Условия протекания реакций полимеризации весьма различные. В некоторых случаях необходимы катализаторы и высокое давление. Но главным фактором является строение молекулы мономера. В реакцию полимеризации вступают непредельные (ненасыщенные) соединения за счет разрыва кратных связей.
Структурные формулы полимеров кратко записывают так: формулу элементарного звена заключают в скобки и справа внизу ставят букву n. Например, структурная формула полиэтилена (—СН2—СН2—)n. Легко заключить, что название полимера слагается из названия мономера и приставки поли-, например полиэтилен, поливинилхлорид, полистирол и т. д.
С помощью реакций полимеризации получают высокомолекулярные синтетические вещества, например полиэтилен, политетрафторэтилен (тефлон), полистирол, синтетические каучуки и др. Они имеют огромное народнохозяйственное значение.
Поливинилхлорид — продукт полимеризации хлористого винила (винилхлорида) СН2=СНСl. Структурная формула 
Тефлон — продукт полимеризации тетрафторэтилена:
Это самое инертное органическое вещество (на него оказывают воздействие только расплавленные калий и натрий). Обладает высокой морозо- и теплоустойчивостью.
Полистирол — твердое прозрачное упругое вещество. Получается полимеризацией стирола (см. § 16.11). Структурная формула 
Наряду с реакциями полимеризации для получения высокомолекулярных соединений широко используются реакции поликонденсации (§ 17.8).
Ацетилен и его гомологи
Свойства. Ацетилен — первый член гомологического ряда ацетиленовых углеводородов — бесцветный газ, легче воздуха, мало растворим в воде. Как уже отмечалось, его углеродные атомы, связанные тройной связью, находятся в состоянии sp-гибридизации (см. § 3.2 и рис. 3.6). Молекула ацетилена имеет линейное строение, а атомы углерода в ней соединены одной 


По химическим свойствам ацетилен во многом аналогичен этилену. Для него характерны реакции присоединения, окисления и полимеризации.
Реакции присоединения протекают аналогично соответствующим реакциям олефинов. Они протекают в две стадии: сначала идет присоединение по месту одной 

1. Присоединение водорода происходит при нагревании в присутствии никелевого катализатора. Реакция протекает в две стадии: сначала образуется этилен, затем — этан:
2. Присоединение галогенов протекает очень легко (также в две стадии):
Бромная вода при этом обесцвечивается. Обесцвечивание бромной воды служит качественной реакцией на ацетилен, как и на все непредельные углеводороды.
3. Присоединение галогеноводородов. Важное значение имеет реакция присоединения хлороводорода:
Получаемый продукт — хлористый винил (или винилхлорид) — подобно этилену легко полимеризуется, а потому широко применяется в производстве поливинилхлоридных смол.
Присоединение галогеноводородов к гомологам ацетилена осуществляется по правилу Марковникова:
4. Присоединение воды протекает в присутствии солей ртути (II) — HgSO4, Hg (NO3)2 — с образованием уксусного альдегида (при обычных условиях ацетилен с водой не взаимодействует):
Как видно из уравнения, промежуточным продуктом является непредельный спирт. Спирты, у которых группа ОН находится при углероде с двойной связью, неустойчивы, водород гидроксильной группы переходит к соседнему углероду (показано стрелкой), в результате изомеризации (самопроизвольного изменения строения) образуется устойчивое соединение — альдегид. Эта реакция получила название реакции Кучерова в честь русского ученого М. Г. Кучерова, открывшего ее в 1881 г. Этой реакцией в промышленности из ацетилена получают уксусный альдегид, а из него при восстановлении — этиловый спирт (а), при окислении — уксусную кислоту (б):
Ацетилен очень чувствителен к окислителям. При пропускании через раствор перманганата калия он легко окисляется, а раствор КМnO4 обесцвечивается:
Обесцвечивание перманганата может быть использовано как качественная реакция на тройную связь.
Под влиянием тройной связи водород в молекуле ацетилена становится весьма подвижным н способен замещаться металлами. Так, если пропускать ацетилен через растворы солей серебра или меди (I), то образуются ацетилениды — металлические производные ацетилена:
Ацетилениды серебра и меди в сухом виде взрываются от удара. Однако карбид кальция, который также является ацетиленидом, весьма устойчив к удару. Он широко используется для получения ацетилена.
Ацетилен горит на воздухе сильно коптящим пламенем, а в кислороде ослепительно белым с выделением большого количества тепловой энергии. При сгорании ацетилена в смеси с кислородом температура достигает 3500°С. Смеси ацетилена с воздухом и кислородом весьма взрывоопасны (взрываются от искры).
Получение. В промышленности и в лаборатории ацетилен получают из карбида кальция при взаимодействии последнего с водой:
В больших количествах его получают из метана:
Применение. Ацетилен применяется в качестве исходного сырья для многих промышленных химических синтезов. Из него получают уксусную кислоту, синтетический каучук, поливинилхлоридные смолы. Тетрахлорэтан СНСl2—СНСl2— продукт присоединения хлора к ацетилену — служит хорошим растворителем жиров и многих органических веществ и, что очень важно, безопасен в пожарном отношении. Ацетилен используют для автогенной сварки металлов.
Диеновые углеводороды
Углеводороды, содержащие в углеродной цепи две двойные связи, называются диеновыми. Их состав может быть выражен общей формулой СnН2n-2. Они изомерны ацетиленовым углеводородам.
Названия диеновых углеводородов производят от предельных углеводородов, в которых последняя буква заменяется окончанием —диен. Цифрами указывается место расположения двойных связей в цепи. Например (в скобках даны тривиальные названия):
Общее международное название диеновых углеводородов — алкадиены. Для алкадиенов возможна изомерия углеродной цепи и положения двойных связей.
Большое применение имеют алкадиены, в молекулах которых двойные связи разделены простой связью, это — дивинил, или бутадиен-1,3 (легко сжижающийся газ), и изопрен, или 2-метилбутадиен-1,3 (жидкость с низкой температурой кипения).
По химическим свойствам бутадиен и изопрен аналогичны непредельным углеводородам — для них характерны реакции присоединения. Обычно присоединение происходит по концам молекулы этих диенов. Так, при взаимодействии с бромом двойные связи разрываются, к крайним атомам углерода присоединяются атомы брома, а свободные валентности образуют двойную связь, т. е. в результате присоединения происходит перемещение двойной связи:
При избытке брома может быть присоединена еще одна молекула его по месту оставшейся двойной связи.
Бутадиен получают при пропускании паров этилового спирта над катализатором (способ С. В. Лебедева):
Но наиболее перспективным промышленным способом получения бутадиена является каталитическое дегидрирование бутана, содержащегося в газах нефтепереработки и в попутных газах:
Каталитическим дегидрированием изопентана (2-метилбутана) получается изопрен:
Бутадиен и изопрен легко полимеризуются и сополимеризуются, т. е. совместно полимеризуются с другими непредельными соединениями, образуя каучуки.
Природный и синтетический каучуки
Каучуки — это эластичные материалы, из которых методом вулканизации (нагреванием с серой) получают резину. Из каучуков изготовляются покрышки и камеры для колес самолетов, автомобилей и велосипедов. Они применяются для электроизолядии, производства промышленных товаров и медицинских приборов.
Натуральный (природный) каучук по химическому составу представляет собой высокомолекулярный непредельный углеводород состава (C5H8)n, где п составляет от 1000 до 3000. Натуральный каучук — полимер изопрена:
Его получают из млечного сока каучуконосных растений, главным образом из гевеи (Бразилия). Бразилия — родина каучука.
Синтетический каучук в промышленном масштабе впервые получен в 1932 г. в СССР по способу С. В. Лебедева. Его получают полимеризацией дивинила. Процесс полимеризации, протекающий в присутствии катализатора (металлического натрия), можно выразить схемой
Сырьем для получения синтетического каучука по способу Лебедева служит этиловый спирт. Теперь разработано получение бутадиена из бутана через каталитическое дегидрирование последнего.
Однако бутадиеновый каучук уступает натуральному как по эластичности, так и по износостойкости. В настоящее время освоено производство изопренового каучука стереорегулярного строения (в нем метальные группы расположены в строго определенном порядке), аналогичного по структуре натуральному каучуку. Получен также и бутадиеновый каучук стереорегулярного строения, это так называемый дивиниловый каучук. Каучуки стереорегулярного строения — изопреновый и дивиниловый — близки по свойствам к натуральному каучуку, а дивиниловый по стойкости к истиранию даже его превосходит.
Для улучшения качества натуральных и синтетических каучуков их превращают в резину. Резина — это вулканизированный каучук. Сущность вулканизации состоит в том, что атомы серы присоединяются к линейным (нитевидным) молекулам каучука по месту двойных связей и как бы сшивают эти молекулы друг с другом. В результате вулканизации липкий и непрочный каучук превращается в упругую и эластичную резину. Резина прочнее каучука и более устойчива к изменению температуры.
Ароматические углеводороды (арены)
Ароматическими называются соединения, в молекуле которых имеется циклическая группа атомов с особым характером связи — ядро бензола. Международное название ароматических углеводородов — арены.
Простейшим представителем аренов является бензол С6Н6. Формула, отражающая строение молекулы бензола, была впервые предложена немецким химиком Кекуле (1865):
Атомы углерода в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно его рисуют вытянутым.
Окончательно строение молекулы бензола подтверждено реакцией образования его из ацетилена (см. § 16.12). В структурной формуле изображается потри одинарных и три двойных чередующихся углерод-углеродных связей. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны, и они обладают свойствами, не похожими на свойства ни одинарных, ни двойных связей. Эти особенности объясняются электронным строением молекулы бензола.
Электронное строение бензола. Каждый атом углерода в молекуле бензола находится в состоянии sp 2 -гибридизации (см. § 3.2). Он связан с двумя соседними атомами углерода и атомом водорода тремя 


Рис. 16.1. Схема образования 

Гомологический ряд бензола. Гомологический ряд бензола имеет общую формулу СnН2n-6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замощены различными углеводородными радикалами. Например, С6Н5—СН3 — метилбензол или толуол, С6Н4(СН3)2 — диметилбензол или ксилол, С6Н5—С2Н5 — этилбензол и т. д.
Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога — толуола — изомеры отсутствуют. У второго гомолога — диметилбензола — имеются три изомера, отличающиеся взаимным расположением метальных групп (заместителей). Это орто-(сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета— (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то это пара— (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.
Рис. 16.2. Схема образования 
Рис. 16.3. 

Стирол. При замещении в молекуле бензола одного атома водорода на радикал винил образуется винилбензол, или стирол: С6Н5—СН=СН2.
Стирол — бесцветная жидкость с приятным запахом, легче воды, кипит при 145°С. Сохраняет свойства непредельных углеводородов: обесцвечивает бромную воду и раствор перманганата калия (за счет двойной связи в винильном радикале).
Стирол очень легко полимеризуется, образуя полистирол (§ 16.7). Особенно ценна его способность к совместной полимеризации с бутадиеном, в результате которой получают различные сорта бутадиенстирольных каучуков (жаро- и морозоустойчивые, прочные на износ, высокоэластичные, устойчивые к маслам). Из них изготовляют шины, ленты для транспортеров, эскалаторов, облегченную микропористую подошву и др.
Бензол и его гомологи
Свойства. Бензол — бесцветная, летучая, огнеопасная жидкость со своеобразным запахом. В воде практически нерастворим. Горит сильно коптящим пламенем. Пары бензола с воздухом образуют взрывчатую смесь. Жидкий бензол и пары бензола ядовиты. При обычных условиях большинство ароматических углеводородов также представляют собой бесцветные жидкости, нерастворимые в воде, обладающие характерным запахом.
По химическим свойствам бензол и другие ароматические углеводороды отличаются от предельных и непредельных углеводородов. Наиболее характерны для них реакции замещения атомов водорода бензольного ядра. Они протекают легче, чем у предельных углеводородов. Таким путем получают множество органических соединений. Так, при взаимодействии бензола с бромом (в присутствии катализатора FeBr3) атом водорода замещается атомом брома:
Бромбензол — бесцветная жидкость, нерастворимая в воде.
При другом катализаторе можно все атомы водорода в бензоле заместить на галоген. Это происходит, например, при пропускании в бензол хлора в присутствии хлорида алюминия:
Гексахлорбензол — бесцветное кристаллическое вещество, применяемое для протравливания семян и консервирования древесины.
Если на бензол действовать смесью концентрированных азотной и серной кислот (нитрующей смесью), то атом водорода замещается нитрогруппой — NO2:
Это реакция нитрования бензола. Нитробензол — бледно-желтая маслянистая жидкость с запахом горького миндаля, нерастворима в воде, применяется в качестве растворителя, а также для получения анилина.
В молекуле бензола можно заместить атом водорода на алкильный радикал действием галогенопроизводных углеводородов в присутствии хлорида алюминия:
Реакции присоединения к бензолу протекают с большим трудом. Для их протекания необходимы особые условия: повышение температуры и давления, подбор катализатора, световое облучение и др. Так, в присутствии катализатора — никеля или платины — бензол гидрируется, т. е. присоединяет водород, образуя циклогексан:
Циклогексан — бесцветная летучая жидкость с запахом бензина, в воде нерастворим.
При ультрафиолетовом облучении бензол присоединяет хлор:
Гексахлорциклогексан или гексахлоран — кристаллическое вещество, применяется как сильное средство для уничтожения насекомых.
Бензол не присоединяет галогеноводороды и воду. Он очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор КМnO4. В обычных условиях бензольное кольцо не разрушается и при действии многих других окислителей. Однако гомологи бензола подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом:
Таким образом, ароматические углеводороды могут вступать как в реакции замещения, так и в реакции присоединения, однако условия этих превращений значительно отличаются от аналогичных превращений предельных и непредельных углеводородов.
Получение. Бензол и его гомологи в больших количествах получают из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании). Сухая перегонка производится на коксохимических и газовых заводах.
Реакция превращения циклогексана в бензол (дегидрогенизация или дегидрирование) протекает при пропускании его над катализатором (платиновой чернью) при 300°С (§ 16.4). Предельные углеводороды реакцией дегидрогенизации также можно превращать в ароматические. Например:
Реакции дегидрирования позволяют использовать углеводороды нефти для получения углеводородов ряда бензола. Они указывают на связь между различными группами углеводородов и на взаимное превращение их друг в друга.
По способу Н. Д. Зелинского и Б. А. Казанского бензол можно получить, пропуская ацетилен через нагретую до 600°С трубку с активированным углем. Весь процесс полимеризации трех молекул ацетилена можно изобразить схемой
Применение. Бензол и его гомологи применяются как химическое сырье для производства лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. Широко используются как растворители. Бензол в качестве добавки улучшает качество моторного топлива.
Нефть я ее переработка
Нефть — маслянистая жидкость темно-бурого или почти черного цвета с характерным запахом. Она легче воды (пл. 0,73—0,97 г/см 3 ), в воде практически нерастворима.
По разведанным запасам нефти Советский Союз занимает первое место в мире.
По составу нефть — сложная смесь углеводородов различной молекулярной массы, главным образом жидких (в них растворены твердые и газообразные углеводороды). Обычно это углеводороды парафиновые, циклоалканы, ароматические, соотношение которых в нефтях различных месторождений колеблется в широких пределах. Бакинекая и эмбинская нефти содержат больше циклоалканов (с пяти- и шестичленными кольцами), грозненская и западноу край некая — парафиновых, уральская — ароматических. Кроме углеводородов нефть содержит кислородные, сернистые и азотистые органические соединения.
Сырая нефть обычно не применяется. Для получения из нефти технически ценных продуктов ее подвергают переработке.
Первичная переработка нефти заключается в ее перегонке. Перегонку производят на нефтеперерабатывающих заводах после отделения попутных газов. При перегонке нефти получают светлые нефтепродукты: бензин (т. кип. от 40 до 150—200°С), лигроин (т. кип. 120—240°С), керосин (т. кип. 150—300°С), газойль — соляровое масло (т. кип. выше 300°С), а в остатке — вязкую черную жидкость — мазут. Мазут подвергают дальнейшей переработке. Его перегоняют под уменьшенным давлением (чтобы предупредить разложение) и выделяют смазочные масла: веретенное, машинное, цилиндровое и др. Из мазута некоторых сортов нефти выделяют вазелин и парафин. Остаток мазута после отгонки называют нефтяным пеком или гудроном.
Продукты перегонки нефти имеют различное применение. Бензин в больших количествах используется как авиационное и автомобильное топливо. Он состоит обычно из углеводородов, содержащих в молекулах в среднем от 5 до 9 атомов углерода.
Лигроин служит топливом для дизельных двигателей, а также растворителем в лакокрасочной промышленности. Большие количества его перерабатывают в бензин.
Керосин применяется как горючее для реактивных и тракторных двигателей, а также для бытовых нужд. Он состоит из углеводородов, содержащих в молекулах в среднем от 9 до 16 атомов углерода.
Соляровое масло используется как моторное топливо, а смазочные масла — для смазки механизмов.
Вазелин используется в медицине. Он состоит из смеси жидких и твердых углеводородов.
Парафин применяется для получения высших карбоновых кислот (см. § 17.15), для пропитки древесины в производстве спичек и карандашей, для изготовления свечей, гуталина и т. д. Он состоит из смеси твердых углеводородов.
Гудрон — нелетучая темная масса, после частичного окисления применяется для получения асфальта.
Мазут помимо переработки на смазочные масла и бензин используется в качестве котельного жидкого топлива.
При вторичных методах переработки нефти происходит изменение структуры углеводородов, входящих в ее состав. Среди этих методов большое значение имеет крекинг (расщепление) углеводородов нефти, проводимый с целью повышения выхода бензина.
Термический крекинг проводится при нагревании исходного сырья (мазута и др.) при температуре 450—550°С и давлении 2—7 МПа. При этом молекулы углеводородов с большим числом атомов углерода расщепляются на молекулы с меньшим числом атомов как предельных, так и непредельных углеводородов. Например:
Таким способом получают главным образом автомобильный бензин. Выход его из нефти достигает 70%. Термический крекинг открыт русским инженером В. Г. Шуховым в 1891 г.
Каталитический крекинг производится в присутствии катализаторов (обычно алюмосиликатов) при 450°С и атмосферном давлении. Этим способом получается авиационный бензин с выходом до 80%. Такому виду крекинга подвергается преимущественно керосиновая и газойлевая фракции нефти. При каталитическом крекинге наряду с реакциями расщепления протекают реакции изомеризации. В результате последних образуются предельные углеводороды с разветвленным углеродным скелетом молекул, что улучшает качество бензина.
Важным каталитическим процессом является ароматизация углеводородов, т. е. превращение парафинов и циклопарафинов в ароматические углеводороды. При нагревании тяжелых фракций нефтепродуктов в присутствии катализатора (платины или молибдена) углеводороды, содержащие 6—8 атомов углерода в молекуле, превращаются в ароматические углеводороды. Эти процессы протекают при риформинге (облагораживании бензинов).
При крекинг-процессах образуется большое количество газов (газы крекинга), которые содержат главным образом предельные и непредельные углеводороды. Эти газы используются в качестве сырья для химической промышленности.
В последние годы (наряду с увеличением выработки топлива и масел) углеводороды нефти широко используются как источник химического сырья. Различными способами из них получают вещества, необходимые для производства пластмасс, синтетического текстильного волокна, синтетического каучука, спиртов, кислот, синтетических моющих средств, взрывчатых веществ, ядохимикатов, синтетических жиров и т. д.
Природные газы и их использование
Природные газы, нефть и каменный уголь — основные источники углеводородов. По запасам природного газа первое место в мире принадлежит СССР, где известно более 200 месторождений.
В природном газе содержатся углеводороды с низкой молекулярной массой. Он имеет следующий примерный состав (по объему): 80—98% метана, 2—3% его ближайших гомологов — этана, пропана, бутана и небольшое количество примесей — сероводорода, азота, благородных газов, оксида углерода (IV) и паров воды. Так, например, газ Ставропольского месторождения содержит 97,7% метана и 2,3% прочих газов, газ Саратовского месторождения — 93,4% метана, 3,6% этана, пропана, бутана и 3% негорючих газов.
К природным газам относятся и так называемые попутные газы, которые обычно растворены в нефти и выделяются при ее добыче. В попутных газах содержится меньше метана, но больше этана, пропана, бутана и высших углеводородов. Кроме того, в них присутствуют в основном те же примеси, что и в других природных газах, не связанных с залежами нефти, а именно: сероводород, азот, благородные газы, пары воды, углекислый газ.
Раньше попутные газы не находили применения и при добыче нефти сжигались факельным способом. В настоящее время их стремятся улавливать и использовать как в качестве топлива, так и, главным образом, в качестве ценного химического сырья. Из попутных газов, а также газов крекинга нефти путем перегонки при низких температурах получают индивидуальные углеводороды. Из пропана и бутана путем дегидрирования получают непредельные углеводороды — пропилен, бутилен и бутадиен, из которых затем синтезируют каучуки и пластмассы.
Природный газ широко используется как дешевое топливо с высокой теплотворной способностью (при сжигании 1 м 3 выделяется до 54 400 кДж). Это один из лучших видов топлива для бытовых и промышленных нужд. Кроме того, природный газ служит денным сырьем для химической промышленности.
Разработано много способов переработки природных газов. Главная задача этой переработки — превращение предельных углеводородов в более активные — непредельные, которые затем переводят в синтетические полимеры (каучук, пластмассы). Кроме того, окислением углеводородов получают органические кислоты, спирты и другие продукты.
В последние годы значительно возросло производство газов путем переработки каменных углей, торфа и сланцев. Уголь, так же как и природные газы и нефть, является источником энергии и ценным химическим сырьем.
Основной метод переработки каменного угля — коксование (сухая перегонка). При коксовании (нагревании до 1000—1200°С без доступа воздуха) получаются различные продукты: кокс, каменноугольная смола, аммиачная вода и коксовый газ. Примерный состав коксового газа: 60% водорода, 25% метана, 5% оксида углерода (II), 4% азота, 2% оксида азота (IV), 2% этилена и 2% прочих газов.
Коксовый газ применяют для обогревания коксовых печей (при сгорании 1 м 3 выделяется около 18 000 кДж), но в основном его подвергают химической переработке. Так, из него выделяют водород для синтеза аммиака, используемого затем для получения азотных удобрений.
Каменноугольная смола служит источником ароматических углеводородов. Ее подвергают ректификационной перегонке и получают бензол, толуол, ксилол, нафталин, а также фенолы, азотсодержащие соединения и др. Пек — густая черная масса, оставшаяся после перегонки смолы, используется для приготовления электродов и кровельного толя.
Предельные углеводороды (алканы или парафины)
В молекулах предельных углеводородов каждый атом углерода затрачивает на соединение с соседним углеродным атомом по одной валентности, образуя простую (одинарную) ковалентную неполярную связь. Все оставшиеся свободные валентности углерода заполняют (насыщают) атомы водорода, поэтому предельные углеводороды содержат максимальное количество атомов водорода. Отсюда и их название — предельные, или насыщенные углеводороды.
Предельные углеводороды с открытой цепью называются алканами, или парафинами (от лат. parrum affinis — ‘‘малоактивный»).
С гомологическим рядом предельных углеводородов вы уже знакомы. Простейшим представителем алканов является метан
Метан — бесцветный, лишенный запаха газ, в воде практически не растворяется,
сжижается при температуре — 
Метан 
Рассмотрим строение молекулы метана (рис. 86). Так как атом углерода имеет большую электроотрицательность, чем водород, то в молекуле метана происходит незначительное смещение общих электронных пар в сторону атома углерода. Между атомами углерода и водорода возникает ковалентная связь.
Рис. 86. Масштабная и шаростержневая модели молекулы метана
На основании графических и электронных формул может сложиться представление, что все атомы в молекуле метана расположены в одной плоскости, как это изображено на бумаге. В действительности молекулы метана имеют не плоское, а объемное строение.
Пространственное строение метана и остальных алканов можно показать с помощью объемных (масштабных) и шаро стержневых моделей (рис. 87).
Рис. 87. Шаростержневые модели молекулы этана и пентана
Изомерия и номенклатура алканов
Согласно Международной номенклатуре (по правилам ГОРАС), изомеры с разветвленной цепью уг ле родных атомов следует рассматривать как производные алкана с самой длинной неразветвленной углеродной цепью. В таблице 34
приведены названия первых десяти алканов неразветвленного строения, которые следует заучить.
Вам известно, как образуется общее название одновалентных радикалов алканов — алкилы (R-). Общая формула алкилов:
Теперь рассмотрим алгоритм составления названий алканов по Международной номенклатуре:
1. Найти в формуле наиболее длинную (главную) неразветвленную цепь углеродных атомов.
Таким образом, в данном соединении главная цепь содержит шесть углеродных атомов.
2. Пронумеровать атомы углерода главной цепи, начиная с того конца цепи, к которому ближе разветвление.
3. Указать положение заместителя (номер атома углерода, у которого находится алкильный радикал), к которому ближе разветвление.
4. Назвать алкильный радикал.
5. Назвать алкан, соответствующий главной цепи.
В молекуле с несколькими одинаковыми заместителями нужно указать положение каждого заместителя. Число одинаковых заместителей обозначают греческими числительными: ди- (два), три-(три), тетра- (четыре), пента- (пять) и т. д.
Разные заместители называют в алфавитном порядке. Сумма номеров положений заместителей должна быть минимальной.
Нахождение в природе. Алканы достаточно широко представлены в природе. Основными природными источниками алканов являются природный, попутный нефтяной газ, нефть, бурый и каменный уголь, горючие сланцы и, вероятно, в будущем — газовые гидраты (найдены в областях вечной мерзлоты и под океанами). Также метан содержится в биогазе.
Химические свойства. Алканы обладают низкой реакционной способностью. Это обусловлено прочностью и очень малой полярностью связей С-С и С-Н. Однако в определенных условиях алканы вступают в реакцию замещения, отщепления и окисления.
Реакции замещения. Для алканов характерны реакции замещения водорода галогенами. Так, например, при освещении метан реагирует с хлором, в результате образуются хлорпроизводные метана и хлороводород:
В уравнениях реакций с участием органических соединений (органических реакциях) знак равенства ( = ) заменяется стрелкой 
Рис. 88. Использование фреонов
Галоген алканы могут быть очень полезны, например, хлороформ применяется в медицине, тетрахлорметан используется при тушении пожаров и т. и., но в то же время данные соединения могут быть очень опасны, так как являются токсичными. К примеру, фреоны (хладоны) — это фтор, или полифтор углеводороды, часто содержащие атомы хлора, реже — атомы брома. Они используются как хладоагенты, но в то же время разрушают озоновый слой, поэтому очень важно правильно использовать данные вещества (рис. 88).
Реакции разложения. При нагревании около 
При нагревании до температуры 
Реакции окисления. В определенных условиях алканы могут окисляться. В зависимости от условий окисление может быть полным или частичным.
Полное окисление. Все предельные углеводороды — горючие вещества. Именно поэтому метан как основная часть природного газа используется в качестве топлива. Метан горит синеватым или почти бесцветным пламенем, выделяя большое количество теплоты:
Смеси газообразных алканов с кислородом или воздухом взрывоопасны, поэтому очень опасна как утечка газов, так и накопление метана в шахтах или котельных. Например, если объемное соотношение метана и кислорода соответствует 1:2, то происходит очень сильный взрыв. Нередко это является причиной аварии и несчастных случаев в шахтах.
Частичное окисление. Важное практическое значение имеет частичное окисление метана с образованием смеси оксида углерода (II) и водорода, называемой синтез-газом:
Синтез-газ является ценным сырьем для получения высших алканов и метанола, спирта. Водород используется также в производстве аммиака.
Применение алканов. Алканы используются в качестве топлива. Велико значение в медицине, парфюмерии и косметике (вазелин); галогенопроизводные применяются в качестве растворителей и хладоагентов. В нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ (рис. 89).
Алканы являются предельными углеводородами. Их общая формула 
Рис. 89. Применение алканов:
1 — природный газ; 2 — смазочные материалы; 3 — бутам; 4 — Горючие;
5 — пластмассы; 6 — моющие средства; 7 — лекарственные препараты;
8 — растворители; 9 — парафин; 10 — пропан
Алкены
Непредельные углеводороды, содержащие в молекуле помимо одинарных связей одну двойную связь между атомами углерода» называются алкенами.
Первый представитель алкенов — этен 
Как видите, этен несколько беднее водородом, чем соответствующий ему предельный углеводород этан 
В молекуле этена и других алкенов атомы углерода образуют двойную связь. Одна из них 

Структурная и электронная формулы и модели молекулы этена изображены на рисунке 90.
Для удобства вторая связь отмечается черточкой над одной связью С-С. Например, формула этена может быть записана следующим образом:
Изомерия и номенклатура. Гомологический ряд алкенов начинается с этена (этилена). Последующие члены ряда образуются прибавлением к этену гомологической разности 
Рис. 90. Модели молекулы этилена
Таблица 35 Номенклатура алкенов 
Одновалентный радикал этилена 
Общая формула алкенов
Алкены, так же как и алканы, имеют изомеры. Изомерия алкенов существенно богаче, чем алканов. Изомеры начинаются с четвертого члена ряда алкенов
Ниже приведены изомеры бутена 
Таблица 36 Изомеры бутена
Алгоритм составления названий алкенов по Междунардной номенклатуре:
Найти наиболее длинную (главную) цепь углеродных атомов, в которую входит двойная связь, и пронумеровать цепь, начиная с того конца, к которому ближе двойная связь.
Цифрой указать положение двойной связи после названия главной цепи.
Назвать заместители (алкильные радикалы) в алфавитном порядке и алкен, соответствующий главной цепи.
Получение. Алкены не встречаются в природе в свободном состоянии. Их можно получить лишь в результате химических превращений.
Дегидрирование алканов в присутствии катализаторов:
Физические свойства. Этилен — бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
Химические свойства углеводородов ряда этилена. Алкены обладают большей реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. Одна из связей 
Гидрирование. Реакция гидрирования — это присоединение водорода к ненасыщенным углеводородам. В результате гидрирования алкенов происходит полное насыщение атомов углерода атомами водорода и образуются предельные углеводороды:
Реакция галогенирования. Галогены легко присоединяются к алкенам по месту разрыва 
Эта реакция является качественной реакцией для непредельных соединений:
Реакция гидрогалогенирования. Алкены легко присоединяют галогеноводороды (HF, HCI, НВr, НI), в результате образуются галоген алканы.
Например:
Хлорэтан — жидкость, легко превращающаяся в газ. Если налить хлорэтан на руку, он быстро испаряется, и можно почувствовать сильное охлаждение. Его применяют в медицине для местной анестезии.
Гидратация. Присоединение воды к этену с образованием этилового спирта имеет важное промышленное значение. Реакция протекает в присутствии кислотных катализаторов
Окисление. Алкены легко окисляются. Например, при пропускании этилена через разбавленный раствор перманганата калия 

Рис. 92. Горение этилена

Рис. 91. Обесцвечивание перманганата калия этиленом
В результате этой реакции фиолетовая окраска раствора 
Горение — процесс полного окисления. Этилен горит подобно этану и метану:
В отличие от метана этилен горит светящимся пламенем (рис. 92).
Применение. Алкены являются важнейшими исходными веществами в современном органическом синтезе. Области применения этилена представлены на рисунке 93. Он используется в производстве полиэтилена, этилового спирта, этиленгликоля, дихлорэтана. Этен ускоряет созревание овощей и фруктов.
Алкены — это непредельные углеводороды, имеющие одну двойную связь. Они могут вступать в реакцию присоединения и окисления. Качественной реакцией на алкены является реакция с бромной водой и перманганатом калия.
Рис. 93. Применение этилена.
Реакция полимеризации
Полимеризацией называется процесс соединения многих одинаковых молекул с образованием высокомолекулярного соединения (полимера).
В реакции полимеризации легко вступают непредельные соединения, например, этичен. При повышенной температуре, давлении и в присутствии катализаторов молекулы эти
лена соединяются путем расщепления внутримолекулярных связей и образования новых межмолекулярных связей (многоточие показывает, что в реакцию вступает большое число молекул):
Сокращенно уравнение этой реакции записывается так:
Молекулы полимеров называют макромолекулами. В результате полимеризации этилена образуются гигантские макромолекулы с молекулярной массой от 20 тыс. до 3 млн. (рис. 94).
Рис. 94. Фрагмент макромолекулы полиэтилена
Исходное вещество, вступающее в реакцию полимеризации, называется мономером, а продукт этой реакции — полимером. Полимер состоит из большого числа повторяющихся групп атомов, имеющих одинаковое строение. Эти группировки называют структурными звеньями. Например, структурным звеном полиэтилена является группировка атомов:
Число структурных звеньев, повторяющихся в макромолекуле, называется степенью полимеризации (обозначается буквой n).
Если кусочек полиэтилена нагреть, то при температуре 
Сведения о физических свойствах и применении полиэтилена приведены на рисунке 95.
Рис. 95. Полиэтилен и его применение
Химические свойства. Полиэтилен обладает свойствами предельных углеводородов. При обычных условиях полиэтилен и подобные полимеры не реагируют ни с серной кислотой, ни со щелочами (конц. азотная кислота разрушает полиэтилен, особенно при нагревании). Они не обесцвечивают бромную воду и раствор перманганата калия.
Проблемы использования полимеров. Синтетические полимеры, например полиэтилен, совершили революцию в нашей жизни, но их применение создает ряд проблем. Во-первых, синтетические полимеры получают из невозобновляемых ресурсов; во-вторых, применение неразрушаемых в природной среде пластиков и их накопление ведут к загрязнению окружающей среды и создают глобальную экологическую проблему. Объемы выпуска неразрушаемых в природной среде синтетических пластмасс, главным образом полиэтиленов и полипропиленов, получаемых в процессах нефтеоргсинтеза, огромны, к настоящему моменту они достигли 180 млн. т в год и ежегодно возрастают примерно на 25 млн. При этом основная их часть в отходах на свалках, так как повторной переработке в развитых странах подвергается не более 16—20%.
В настоящее время для очистки окружающей среды от пластмассовых отходов активно разрабатываются два основных подхода: захоронение и утилизация. Захоронение пластмассовых отходов — это “бомба замедленного действия” и перекладывание сегодняшних проблем на плечи будущих поколений. Кроме того, под полигоны и свалки твердых бытовых отходов ежегодно отчуждается до 10 тыс. га земель, в том числе и плодородных, изымаемых из сельскохозяйственного оборота. Возможные пути сокращения гигантских отходов синтетических пластиков — это утилизация, которую можно разделить на ряд главных направлений: сжигание, рециклизация и переработка. Однако сжигание отходов тары и упаковки и вообще пластмасс кардинально не улучшает экологическую обстановку. Повторная переработка пластмасс в определенной степени решает этот вопрос, но это требует значительных трудовых и энергетических затрат, так как для этого необходимы следующие действия: отбор из бытового мусора пластической тары и упаковки, разделение собранных отходов по виду пластиков, мойка, сушка, измельчение и только затем переработка в новое полимерное изделие. Необходимость проведения мероприятий для рециклизации пластмассовых отходов, в особенности из тары и упаковки, в ряде стран закреплена законодательно (рис. 96).
Рис. 96. Переработка пластика
Полимеризацией называется процесс соединения многих одинаковых молекул с образованием высокомолекулярного соединения (полимера).
Исходное вещество, вступающее в реакцию полимеризации, называется мономером, а продукт этой реакции — полимером. Полимер состоит из большого числа повторяющихся группировок, имеющих одинаковое строение. Эти группировки называют структурными звеньями.
Число структурных звеньев, повторяющихся в макромолекуле, называется степенью полимеризации.
Полиэтилен — один из важнейших полимеров, но существует проблема его утилизации и переработки.
Алкины
Алкины — непредельные углеводороды, содержащие в молекуле» помимо одинарных связей» одну тройную связь между атомами углерода и соответствующие общей формуле
Строение молекулы ацетилена. Ацетилен — основной представитель алкинов. Его относительная молекулярная масса равна 26, следовательно, его молекулярная формула 
Пространственное расположение атомов в молекуле ацетилена представлено на рисунке 97.
Гомологический ряд алкинов. По названию первого представителя алкиновых углеводородов — ацетилена эти углеводороды называют ацетиленовыми.

Рис. 97. Модели молекулы ацетилена: я) масштабная модель; б) шаростержневая модель
В систематической номенклатуре ацетиленовые углеводороды называют, заменяя в названиях соответствующих алканов суффикс -ан на -ин: этан-этин, пропан-пропин и т. д. (табл. 37).
Таблица 37 Названия алкинов
Номенклатура и изомерия алкинов. По систематической номенклатуре главная цепь углеродных атомов должна обязательно включать тройную связь. Нумерацию углеродной цепи начинают с той стороны, где ближе тройная связь и разветвления. Для алкинов возможна изомерия:
1) положения тройной связи:
2) углеродного скелета:
Рис. 98. Баллоны с ацетиленом
Физические свойства ацетилена. Ацетилен — бесцветный газ, легче воздуха. В химически чистом виде ацетилен обладает слабым эфирным запахом и способен растворяться во многих жидкостях. Его хранят в стальных баллонах (рис. 98).
Получение
1. В промышленности ацетилен по.пуча ют высокотемпературным разложением природного газа метана:
2. В технике ацетилен получают из карбида кальция, разлагая его водой:
Химические свойства ацетилена. Ацетилен и его гомологи — химически активные вещества. Причина этой активности связана с тройной связью, поэтому для алкинов, как и для алкенов, характерны реакции присоединения. Кроме реакций присоединения, ацетиленовые углеводороды вступают в реакции полимеризации и окисления.
1. Гидрирование. Реакция протекает в присутствии катализатора. При гидрировании ацетилена вначале образуется этилен (разрывается первая связь), а затем этан (разрывается вторая связь), в итоге остается всего одна связь:
2. Галогенирование. Аналогично происходит присоединение галогенов. Вначале образуется дигалогенопроизводное, а затем тетрагалогенопроизводное. Например,
Реакция бромной водой для алкинов (как и для алкенов) — качественная реакция (рис. 99).
3. Гидрогалогенирование. Ацетилен реагирует с галогеноводородами:

4. Гидратация. В присутствии катализатора (сульфата ртути) ацетилен реагирует с водой. В результате образуется уксусный альдегид:
Эта реакция носит имя ученого М. Г. Кучерова.
Казахстанский ученый профессор А. Ш. Шарифканов предложил во избежание образования паров ртути проводить эту реакцию в присутствии солей трехвалентного железа.
5. Реакции полимеризации. Ацетилен, в зависимости от условий реакции, способен образовывать различные продукты полимеризации — линейные и циклические. Наиболее важная реакция — тримеризация ацетилена, в которой получается бензол:
6. Реакция окисления. Ацетилен легко окисляется. Реакцию окисления легко наблюдать, если ацетилен пропускать через водный раствор перманганата калия — 
Эта реакция, как мы знаем, является качественной на кратные связи.
При полном сгорании ацетилена на воздухе образуются углекислый газ и вода:

Рис. 99. Реакция а) бромной воды; б) перманганата калия с ацетиленом
Когда ацетилен сгорает, температура повышается до 
Рис. 100. Ацетиленовая горелка
Изучением алкинов занимался выдающийся казахстанский химик И. Н. Азербаев. Его работы внесли огромный вклад в изучение ацетиленовых углеводородов.
Применение. Ацетилен используют для сварки и резки тугоплавких металлов, применяют в органическом синтезе разнообразных веществ — уксусного альдегида и уксусной кислоты, синтетических каучуков и других полимеров (рис. 101).
Рис. 101. Применение ацетилена:
1 — для сварки и резки металла; для получения: 2 — поливинилхлорида; 3 — клея ПВА; 4, 6 — синтетического волокна; 5 — полимеров
Алкины — непредельные углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле 
углеродного скелета.
Алкины — химические активные вещества. Они вступают в реакции присоединения, полимеризации и окисления.
Ароматические углеводороды. Бензол
Ароматическими углеводородами (аренами) называют вещества, в молекулах которых содержится бензольное кольцо. Общая формула аренов 

ароматические углеводороды, так как первые известные углеводороды этого класса обладали приятным запахом.
Строение. В молекуле бензола шесть атомов углерода образуют замкнутый шестичленный цикл. Каждый атом углерода соединяется с одним атомом водорода и двумя соседними атомами углерода. Кроме того, все углеродные атомы, входящие в молекулу бензола, соединяясь, образуют кольцо, в котором все связи равноценны. В структурной формуле бензола равноценность связей изображают кружком внутри правильного шестиугольника:
Шаростержневая модель бензола приведена на рисунке 102.
Рис. 102. Объемная и шаростержневая модели молекулы бензола
Получение. Синтез из ацетилена называется тримеризацией. Эта реакция имеет такое название из-за того, что в этом процессе участвуют три молекулы ацетилена:
Физические свойства. Бензол — это жидкое вещество (растворитель со своеобразным запахом), нерастворимое в воде, но хорошо растворимое во многих органических соединениях. Огнеопасное и ядовитое. В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжелых случаях отравление может повлечь смертельный исход. Пары бензола могут проникать через неповрежденную кожу. Хроническое отравление бензолом и толуолом может стать причиной лейкемии и анемии. Сильный канцероген вызывает образование и рост раковых опухолей.
Химические свойства. Бензол и его гомологи могут вступать в характерные всем органическим веществам реакции горения и разложения, но наиболее характерна для
них реакция замещения, иногда при определенных условиях — реакции присоединения. Мы рассмотрим пока реакцию горения.
Рис. 103. Горение бензола
Реакции горения. Бензол и его гомологи могут гореть на воздухе, при этом выделяя большое количество копоти (образуется сажа) (рис. 103):
При горении в чистом кислороде арены сгорают полностью:
Эта реакция происходит при горении высококачественного бензина.
Применение ароматических углеводородов. Значительная часть получаемого бензола используется для синтеза растворителей, лекарств, взрывчатых веществ, красителей и др. (рис. 104).
Рис. 104. Применение бензола: 1) волокно; 2) пластмассы; 3)резина; 4)лекарства; 5) растворители; 6) красители
Изредка и в крайних случаях ввиду высокой токсичности бензол используется в качестве растворителя. Кроме того, бензол входит в состав бензина. Из-за высокой токсичности его содержание новыми стандартами ограничено введением до 1%.
Ароматическими углеводородами (аренами) называют вещества, в молекулах которых содержится бензольное кольцо. Общая формула аренов
Бензол является простейшим представителем ароматических углеводородов.
Бензол и его гомологи могут вступать в характерные всем органическим веществам реакции горения и разложения. но наиболее присуща для них реакция замещения, иногда при определенных условиях — реакция присоединения.
Углеводородное топливо
Химическое производство основано на использовании в качестве сырья доступных, относительно дешевых, широко распространенных или возобновляющихся материалов. Наиболее важными природными источниками углеводородов являются природный и попутный нефтяные газы, нефть и каменный уголь (схема 9).
Еще наши далекие пещерные предки обогревались у костров. Пламя служило также для освещения и приготовления пищи. Огонь поддерживали дровами, и именно они, эти куски дерева, долгое время были основным видом топлива для человечества.
Но проходили столетия, людей на планете становилось все больше, а лесов — меньше. Нужно было искать им замену. Это была, конечно же, нефть, а в последующем и газ. В 70-е годы прошлого века первое место в топливном балансе уверен но заняла нефть — около 35%. Доля каменного угля снизилась до 30% . На третьем месте оказался природный газ — около 20% (рис. 105).
Рис. 105. Топливный баланс
В наши дни первые места занимают нефть и газ — они обеспечивают более двух третей топливного баланса.
И такая тенденция, по всей вероятности, сохранится еще долго, потому что нефть с газом горят лучше любого другого топлива. Так, при сгорании 1 кг нефти выделяется 4 6 тыс. кДж, при сгорании 

Рис. 106. Теплотворная способность различных видов топлива

Рис. 107. Карта полезных ископаемых Казахстана
В настоящее время ежегодно человечество расходует 7,5 млрд, т углеводородов в качестве источников получения энергии. Из них 95% — в качестве топлива, причем в основном нефть и каменный уголь, а природный и попутный газы расходуются в два раза меньше.
Казахстан богат топливными источниками углеводородов. В нашей стране есть ресурсы нефти, газа и угля (рис. 107).
Наиболее важными природными источниками углеводородов являются природный и попутный нефтяные газы, нефть и каменный уголь.
В наши дни первые места занимают нефть и газ — они обеспечивают более двух третей топливного баланса.
Природный и попутный нефтяные газы
О природном газе мы уже многое знаем, метан — основная составная часть этого газа. Кроме метана, в природном газе присутствуют ближайшие гомологи его — этан, пропан, бутан. Чем выше молекулярная масса углеводорода, тем обычно меньше его содержится в природном газе (рис. 108).
Рис. 108. Состав природного газа
Дело в том, что основательно стали искать и разрабатывать месторождения природного газа в 20-х годах XX в. (рис. 109).
Рис. 109. Природный газ
Как газообразное топливо природный газ имеет большие преимущества.
Он широко применяется сейчас в промышленных печах — стекловаренных, доменных, мартеновских и т. д. Сжигание природного газа в доменных печах позволяет сократить расход кокса, снизить содержание серы в чугуне и значительно повысить производительность печи (рис. 110).
Рис. 110. Применение природного газа
Природный газ транспортируют по специальным трубопроводам и хранят в газгольдерах (рис. 111).
Рис. 111. Транспортировка природного газа
Казахстан богат природным газом. Основные его месторождения сконцентрированы в Западном Казахстане. Крупные запасы находятся близ Каспия, на Мангышлаке, возвышенностях Устюрта, возле Уральска, на месторождениях Карачаганак, Жетыбай, Каламкас.
Доля природного газа превысила 60% -ный рубеж в энергетике производства цемента, стекла, керамики, других строительных материалов, приближается к 50% в металлургии и машиностроении.
Рис. 112. Состав попутного нефтяного газа
Попутный нефтяной газ. При выкачивании из земли нефти вместе с каждой ее тонной выделяется несколько тысяч кубических метров попутных углеводородных газов. Они содержат метан, этан, пропан, бутан, которые легко можно превратить в этилен, пропилен и бутилен (рис. 112). Полное их использование в качестве сырья современной химической промышленности — задача большой экономической важности.
Попутный нефтяной газ по своему происхождению является тоже природным газом. Особое название он получил потому, что находится в залежах вместе с нефтью — растворен в ней и находится над нефтью, образуя газовую “шапку”.
Наиболее важными природными источниками углеводородов являются природный и попутный нефтяные газы, нефть и каменный уголь. Природный газ — важный источник сырья для химической промышленности, так как из метана получают водород, ацетилен, сажу, различные хлор-производные. Используются и другие углеводороды. содержащиеся в нефтяном попутном газе.
Нефть
В древности нефть не имела такого важного значения, какое она имеет сейчас. Сведения о нефти дошли до нас с Ближнего Востока. Археологические раскопки свидетельствуют о том, что в долине реки Евфрат нефть добывали и перерабатывали восемь тысячелетии назад. Битумом покрывали дно бассейнов, применяли его для предохранения от гниения деревянных балок. Асфальтом бальзамировали мумии. Нефть применялась в медицине для заживления ран, язв и лечения глазных болезней.
Рис. 113. Карта трубопроводов и нефтеперерабатывающих заводов в Казахстане
В современном обществе роль нефти возросла. Военная техника, мирный транспорт, электростанции, оборудование на заводах и фабриках, системы отопления — все это приводится в действие за счет нефти и газа.
Запасы нефти, выявленные специалистами к настоящему времени, составляют порядка 230 млрд. тонн. Наиболее богата нефтью Саудовская Аравия, на ее долю приходится чуть меньше половины всех запасов Аравийского полуострова. За ней идут Кувейт, Иран, Ирак, ОАЭ. В Казахстане также много нефти. Основные месторождения нефти находятся в районах Эмба, Доссор, Мак ат, Узень, Жетибай.
Ежегодно в мире добывается порядка 8 млрд, тонн нефти. Растет потребление нефти и ее нефтепродуктов.
Ежегодно и в Казахстане добывается более 50 млн. т нефти, но это количество неизменно растет. В стране есть нефтеперерабатывающие заводы и трубопроводы (рис. 113).
Добыча нефти. Нефть добывается наземным способом и на воде. Для этого устанавливают специальные приспособления доя выкачивания нефти (рис. 114).
Рис. 114. Добыча нефти: а) наземным способом; б) на воде
Как же образуется нефть и каково ее происхождение?
Нефть, добытая из земных недр, называется сырой нефтью. Данная смесь образовалась из осадочного материала животного и растительного происхождения, в течение продолжительного времени находившегося в земной коре. Для образования нефти требуется длительное время (многие миллионы лет), поэтому она называется невозобновляемым ресурсом. Сырую нефть практически не применяют.
Чтобы смесь углеводородов приобрела действительно большое экономическое значение, ее надо очистить (рафинировать), т. е. освободить от примесей и ненужных компонентов. Таким способом сырую нефть очищают от воды, примесей и превращают в товарную нефть. Процесс очистки происходит на нефтеочистительном заводе, где производят очищенные смеси и отдельные соединения, которые используются для получения бензина, а также сырья для нефтехимической промышленности. Очистка включает в себя несколько процессов.
Нефть разных месторождений неодинакова по составу, но любая из них в разных соотношениях содержит четыре главных класса углеводородов: парафины, циклические углеводороды с пяти- и шестичленными циклами и ароматические углеводороды. Кроме уг ле водородов, в нефти почти всегда присутствуют соединения, содержащие серу, кислород и азот, но главную массу любой нефти всегда составляют углеводороды.
Казахстанская нефть богата парафинами (Эмба), циклическими углеводородами (Жетибай) и ароматическими углеводородами (Прорва).
Физические свойства нефти. Нефть представляет собой маслянистую вязкую жидкость, от черного до светло-желтого цвета (зависит от содержания серы), со своеобразным запахом. Нефть не растворяется в воде, легче ее и растекается по поверхности воды (10 л нефти — на 10 
Переработка нефти. Существует несколько способов переработки нефти: первичная (перегонка), вторичная (крекинг и др.). Мы рассмотрим пока первичную переработку нефти.
Какие же фракции получают из нефти путем перегонки?
Первичная переработка нефти — это перегонка, в результате которой нефтепродукты разделяются на составные части (их называют фракциями): сжиженный газ, бензины (автомобильный и авиационный), реактивное топливо, керосин, дизельное топливо (солярка), мазут.
Первые пять видов нефтепродуктов являются топливом. Наиболее летучей частью нефти являются метан и его ближайшие гомологи: этан, пропан, бутан и пентаны. Все они используются как сырье для нефтехимической промышленности, а также в качестве газообразного горючего.
Мазут перерабатывают для получения парафина, битума, жидкого котельного топлива, масел. При смешивании битума с минеральными веществами получается асфальт (асфальтобетон), используемый в качестве дорожного покрытия. Жидкое котельное топливо используют для обогрева домов.
Рис. 116. Трубчатая печь и ректификационная колонна
Перегонка нефти (ректификация). Перегонка (фракционирование) — это процесс физического разделения нефти и газов на фракции (компоненты), отличающиеся друг от друга и от исходной смеси по температурным пределам или температурам кипения. Перегонку осуществляют в установке, которая состоит из трубчатой печи, ректификационной колонны и холодильника (рис. 116). В печи находится змеевик (трубопровод), по которому непрерывно подается нефть. Здесь она нагревается до 320—350°С и в виде смеси жидкости и пара поступает в ректификационную колонну (стальной цилиндрический аппарат высотой 40 м).
Рис. 117. Тарелки в ректификационной колонне
Внутри она имеет горизонтальные перегородки с отверстиями, называемыми тарелками (рис. 117).
Пары нефти подаются в колонну и через отверстия поднимаются вверх, при этом они постепенно охлаждаются и сжижаются. На соответствующих тарелках скапливаются фракции. Менее летучие углеводороды конденсируются уже на первых тарелках, образуя газойлевую фракцию. Выше собирается керосин, а затем лигроин. Наиболее летучие углеводороды выходят в виде паров из колонны и сжижаются, образуя бензин. Часть бензина подается обратно в колонну для орошения поднимающихся паров. Это способствует охлаждению и конденсации соответствующих углеводородов. Главный недостаток перегонки нефти — малый выход бензина (не более 20%) и его невысокое качество. Кроме бензина получают 75% мазута и остальные фракции, всего 5%. С целью дополнительного получения бензина мазут вторично перегоняют под вакуумом в аналогичных ректификационных колоннах. На выходе получают гудрон и бензин.
Из нефти выпускают широкий ассортимент материалов: смазочное масло, электроизоляционное масло, гидравлическое масло, пластичную смазку, смазочно-охлаждающую жидкость; вазелин и др.
При последующей переработке нефти можно получить: синтетические каучуки и резины, синтетические ткани, пластмассы, полимерные пленки (полиэтилен, полипропилен), моющие средства, растворители, краски и лаки, красители, удобрения, ядохимикаты, воск и многое другое.
Рис. 118. Продукты вторичной переработки нефти
Даже отходы переработки нефти имеют практическую ценность. Из отходов перегонки нефти производится кокс. Его используют в производстве электродов и металлургии. А сера, которую извлекают из нефти в процессе переработки, идет на производство серной кислоты (рис. 118).
Подводя итог, можно сказать, повторив слова Д. И. Менделеева: “Топить нефтью — все равно что топить ассигнациями». И хотя 90% нефти все-таки тратится как топливо, все же из нее можно получить огромное количество продуктов.
Рис. 119. Разливы нефти на воде
Рис. 120. Авария танкера
Экологические последствия разлива нефти. Иногда из-за неправильного использования установок по добыче или эксплуатации нефтеперерабатывающих заводов могут происходить разливы нефти. Это очень опасно, потому что нефть нерастворима в воде и растекается по ней очень тонким слоем, через который не проходит кислород воздуха. Такая авария опасна и для флоры, и для фауны водных источников. Ежегодно в Мировой океан попадает от 2 до 10 млн. т нефти. Часть поверхности воды уже покрыта тончайшей радужной пленкой нефти (рис. 119).
Наибольшее количество разлитой нефти приносят танкеры, перевозящие нефть (рис. 120). Общее количество нефти, разлитое танкерами за период с 1970 по 2017 г., составляет более 5 млн. т.
Методы борьбы с разлитием нефти в водных источниках: а) самоликвидация; б) химическое рассеивание; в) поглощение; г) ограждение; д) биологическая очистка.
Чтобы уменьшить вред, наносимый природе, необходимо: совершенствовать способы и технологии добычи, хранения, транспортировки нефти и обеспечивать безопасность производства.
Нефть — это сложная смесь органических веществ. Нефть добывается бурением скважин в земле и на воде. Нефть перегоняют и получают различные фракции, различающиеся по температурам кипения. Одна из наиболее важных фракций нефти — бензин.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://chemege.ru/sposoby-polucheniya-arenov/
http://natalibrilenova.ru/uglevodorodyi/