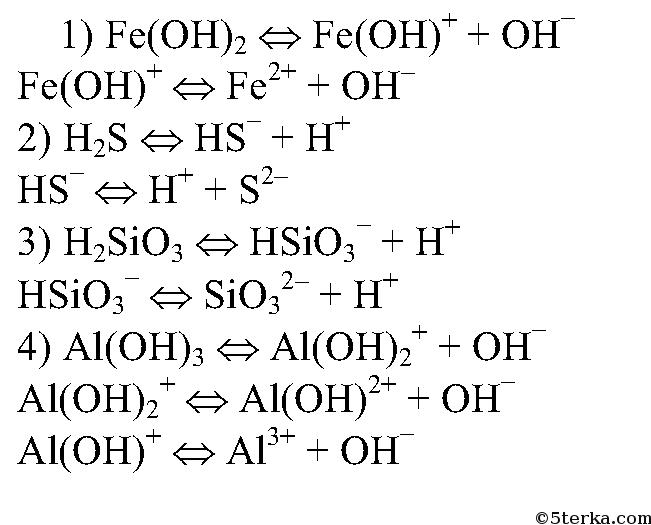Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + . Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н + ):
Константа диссоциации по первой ступени:
Вторая ступень диссоциации (отщепление иона водорода Н + от сложного иона НСО3 — ):
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н + (Н3О + ).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — .
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН — ):
Вторая ступень диссоциации (отщепляется гидроксид-ион ОН — от сложного катиона FeOH + ):
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН — .
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н + или ОН — от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н + и гидроксид-анионы ОН — , т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н + и анионы ОН — .
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.
Сложный анион НСО3 — (гидрокарбонат-ион) частично диссоциирует по уравнению:
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН — .
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Сложный катион частично диссоциирует по уравнениям:
Для обеих ступеней диссоциации Fe(OH)2 + .
Написать уравнение ступенчатой диссоциации :Сернистая кислотаГидроксид магнияХлорид железа 3Гидросиликат калияГидроксонитрат свинца?
Химия | 5 — 9 классы
Написать уравнение ступенчатой диссоциации :
Хлорид железа 3
H2SO3 = H( + ) + HSO3( — )
HSO3( — ) = H( + ) + SO3(2 — )
Mg(OH)2 = (MgOH)( + ) + OH( — )
MgOH( + ) = Mg(2 + ) + OH( — )
FeCl3 = Fe(3 + ) + 3Cl( — )
KHSiO3 = K( + ) + HSiO3( — )
HSiO3( — ) = H( + ) + SiO3(2 — )
PbOHNO3 = PbOH( + ) + NO3( — )
PbOH( + ) = Pb(2 + ) + OH( — ).
Дайте мне, правильную формулу, хлорид меди + гидроксид калия — — — — > ; хлорид калия + вода?
Дайте мне, правильную формулу, хлорид меди + гидроксид калия — — — — > ; хлорид калия + вода.
Гидроксид магния + сернистая кислота — — — — — > ; cульфат магния + вода Пожалуйста.
Составьте уравнение ступенчатой диссоциации сернистой кислоты?
Составьте уравнение ступенчатой диссоциации сернистой кислоты?
Написать формулы веществ?
Написать формулы веществ.
Написать уравнения электролитической диссоциации водных растворов электролитов : сернистая кислота, сульфад магния, оксид кальция, сера, гидроксид ртути.
Составьте формулы и напишите уравнения диссоциации : Гидроксида натрия, Азотной кислоты, Хлорида магния, Карбоната калия, Нитрата железа(3)?
Составьте формулы и напишите уравнения диссоциации : Гидроксида натрия, Азотной кислоты, Хлорида магния, Карбоната калия, Нитрата железа(3).
Написать уравнения ступенчатой диссоциации гидроксида кальция, борной кислоты?
Написать уравнения ступенчатой диссоциации гидроксида кальция, борной кислоты.
1. Напишите уравнения электролитической диссоциации : а) хлорида железа (III) ; б) сульфата калия ; в) нитрата бария ; г) фосфорной кислоты ; д) гидроксида натрия?
1. Напишите уравнения электролитической диссоциации : а) хлорида железа (III) ; б) сульфата калия ; в) нитрата бария ; г) фосфорной кислоты ; д) гидроксида натрия.
2. Напишите молекулярные ионные уравненияреакций между растворами : а) серной кислоты и хлорида бария ; б) гидроксида калия и фосфорной кислоты ; в) карбоната натрия и нитрата свинца (II).
Напишите уравнения электролитической диссоциации : а) гидроксида натрия ; б) азотной кислоты ; в) хлорида магния ; г) карбоната калия ; д) нитрата железа(Ш)?
Напишите уравнения электролитической диссоциации : а) гидроксида натрия ; б) азотной кислоты ; в) хлорида магния ; г) карбоната калия ; д) нитрата железа(Ш).
Закончите уравнения реакций и приведите их в молекулярном и ионном виде 1) сернистая кислота + гидроксид калия = 2) сернистая кислота + оксид калия = 3) сернистая кислота + магний =?
Закончите уравнения реакций и приведите их в молекулярном и ионном виде 1) сернистая кислота + гидроксид калия = 2) сернистая кислота + оксид калия = 3) сернистая кислота + магний =.
Даны следующие вещества : оксид магния, хлорид калия, железо, нитрат свинца(II), сульфат меди(II), серная кислота, гидроксид железа(III), оксид углерода(IV)?
Даны следующие вещества : оксид магния, хлорид калия, железо, нитрат свинца(II), сульфат меди(II), серная кислота, гидроксид железа(III), оксид углерода(IV).
С какими из них реагирует гидроксид калия?
Напишите уравнения реакций.
Напишите уравнения диссоциации сульфат калия и нитрад аллюминия?
Напишите уравнения диссоциации сульфат калия и нитрад аллюминия.
Хлорид железа 3 и гидроксид калия Карбонад натрия и серная кислота.
Вы находитесь на странице вопроса Написать уравнение ступенчатой диссоциации :Сернистая кислотаГидроксид магнияХлорид железа 3Гидросиликат калияГидроксонитрат свинца? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 — 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
2. Напишите уравнения электролитической диссоциации слабых электролитов: Fe(OH)2, H2S, H2SiO3, Al(ОН)3.

задача №2
к главе «Глава 17. Электролиты. §17.4 Сильные и слабые электролиты».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
http://himia.my-dict.ru/q/2113780_napisat-uravnenie-stupencatoj-dissociacii-sernistaa-kislotagidroksid/
http://5terka.com/node/9523