Составление химических реакций согласно приведенной схемы
Цепочка химических превращений
Задача 4.
С помощью каких химических реакций можно осуществить следующие цепочки превращений (напишите уравнения реакций, укажите условия их протекания и название продуктов): СаС2 → С2Н2 → С6Н6 → С6Н5-СН3 → С6Н5-СООН.
Решение:
1. СаС2 + 2Н2О = Са(ОН)2 + С2Н2↑
Карбид кальция очень энергично взаимодействует с водой с образованием газообразного ацетилена (С2Н2) и гидроксида кальция (Са(ОН)2).
2. 3С2Н2 = С6Н6
При температуре красного каления ацетилен превращается в бензол.
3. С6Н6 + СН3Сl = С6Н5-СН3 + HCl
В присутствии катализаторов — галогенидов алюминия ( AlCl3, AlBr3 и т.д.) из бензола и хлорметила можно получить гомолог бензола — метилбензол или толуол (С6Н5-СН3) и хлороводород HCl. Это реакция алкилирования.
4. С6Н5-СН3 + [O] ⇔ C6H5-COOH
При окислении метилбензола (толуола) получается бензойная кислота (C6H5-COOH). Реакция окисления характерная для алкилбензолов и не характерная для самого бензола. В качестве окислителя применяется раствор перманганата калия.
Написать уравнения реакций по схемам указать тип реакций
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Можно ли записать реакцию в виде Сu(NO3)2=CuO+N2O5
Нет, потому что разложение нитрата меди выглядит так
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для второго превращения:
4)
Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Напишем уравнения реакции, соответствующие схеме превращений:
1)
2)
3)
Составим сокращённое ионное уравнение для третьего превращения:
4)
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А12 теста ЕГЭ по химии — «Взаимосвязь неорганических веществ»
Если посмотрите это задание в вариантах ЕГЭ, то там дана схема превращений неорганических веществ и в ответах даны варианты реагентов. Как решать такие задачи?
Темы, которые нужно знать:
Составить уравнения реакций по схеме превращений
На самом деле это не так и сложно. Для этого необходимо знать типы реакций и основные условия их протекания.
1. Химические реакции соединения
- Реакция горения — одна из самых распространенных химических реакций соединения — все вещества горят — и металлы, и неметаллы:
- Химические реакции соединения металла и неметалла — приводят к образованию солей:
(а вот этот момент надо запомнить (или выучить) — железо при взаимодействии с соляной кислотой дает хлорид железа (II), а с хлором — простым веществом — хлорид железа (III))
- Неметаллы также могут взаимодействовать между собой:
2. Составление уравнений реакций по схеме — реакции разложения
- Обычно уравнения реакций разложения солей дают соответствующие основные и кислотные оксиды:
Исключения:
- по-другому разлагаются нитраты — в зависимости от металла, входящего в состав соли. Это можно прочитать >;
- хлорид аммония — NH4Cl — разлагается до аммиака и соляной кислоты: NH4Cl = NH3 + HCl;
- не разлагаются сульфаты
- соли, образованные сильными окислителями:
- Разлагаются некоторые основания:
3. Составление уравнений реакций по схеме — п римеры реакций замещения
- реакция замещения водорода в кислотах:
когда нам дана реакция замещения металлом водорода в кислотах, нужно учитывать электрохимический ряд напряжений металлов: металлы, находящиеся в ряду ДО водорода, вытесняют его из кислот:
2Na + 2HCl = 2NaCl + H2
- реакции замещения в солях:
Ca + 2NaCl = CaCl2 +2 Na
Правило: предыдущий металл вытесняет последующий из его солей
(т.е. реакция Na + CaCl2 не будет идти)
4. Составление уравнений реакций по схеме — р еакции обмена веществ
Здесь следующие правила — обменные реакции идут в сторону образования продуктов при:
- выпадении осадка: NaCl + AgNO3 = AgCl↓ + NaNO3
- выделении газа: Na2CO3 + HCl = NaCl + CO2 + H2O ;
- образовании малодиссоциирующего вещества (H2O, NH4OH, органические кислоты и соли и т.д.): NaOH + H2SO3 = Na2SO3 + H2O
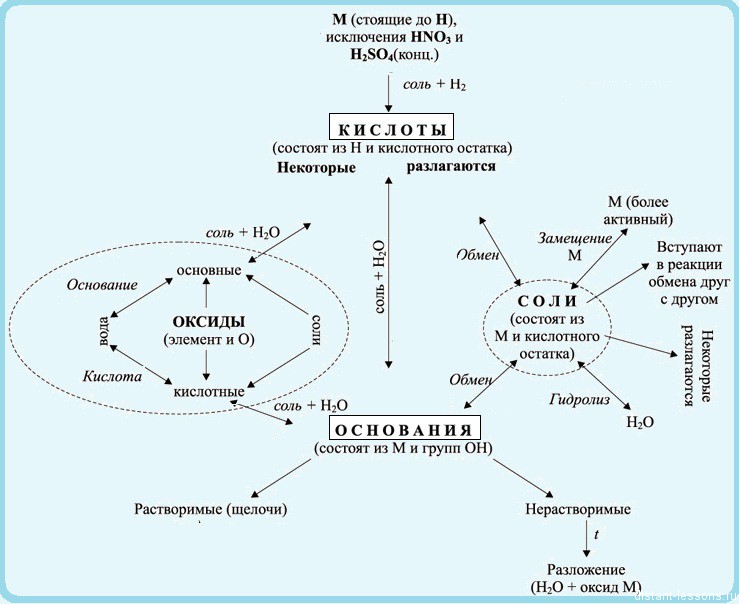
Взаимосвязь неорганических веществ можно отобразить такой таблицей:
Теория, это, конечно, хорошо, но давайте попрактикуемся — попробуем составить уравнения реакций по схемам превращений
В первой реакции к меди можно прибавить либо AgNO3, либо HNO3 — в ряду напряжений медь стоит до серебра, а азотная кислота будет давать окислительно-восстановительную реакцию.
Во второй части схемы нам подходит K2S или H2S, т.к. сульфид меди — осадок.
Ответ: 1)
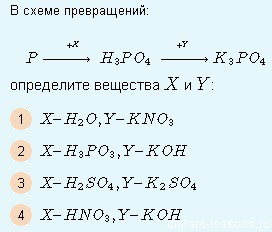
Составим уравнения реакций для данной схемы превращений:
Первая реакция — переход фосфора в фосфорную кислоту — такое под силу только мощным окислителям — либо серной, либо азотной кислоте.
Вторая реакция — обменная — K2SO4 даст растворимые продукты, а вот KOH — в самый раз! Получится вода — малодиссоциирующее вещество.
http://chem-oge.sdamgia.ru/test?theme=25
http://distant-lessons.ru/sostavit-uravneniya-reakcij-po-sxeme-prevrashhenij.html