Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de3c1767ebb1ffc • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Химическая кинетика. Химическое равновесие
4. Напишите кинетические уравнения следующих реакций:
б) 2NOCl(г) = 2NO(г) + Cl2(г)
Объясните причину несовпадения молекулярности и порядка реакции.
Решение.
Кинетические уравнения отражают взаимосвязь между концентрациями исходных веществ, находящихся в одной фазе, и скоростью реакции. Теоретической основой для написания кинетических уравнений является закон действующих масс (ЗДМ), согласно которому скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях, равных их стехиометрическим коэффициентам. В соответствии с ЗДМ кинетические уравнения рассматриваемых реакций выглядят следующим образом:
V=k*C(O2), где V – скорость реакции, k – константа скорости реакции, C(O2) – концентрация кислорода, моль/л
V=k*C(NOCl) 2 , где V – скорость реакции, k – константа скорости реакции, C(NOCl) – концентрация NOCl, моль/л
V=k*C(C12H22O11)*C(H2O), где V – скорость реакции, k – константа скорости гидролиза сахарозы C12H22O11, C(C12H22O11) – концентрация сахарозы в водном растворе ,моль/л, С (Н2О) –концентрация воды, моль/л.
V=k*C(NO) 2 *C(H2), где V – скорость реакции, k – константа скорости, C(NO) – концентрацияNO,моль/л, С (Н2) –концентрация водорода, моль/л.
1.Причина несовпадения молекулярности и порядка реакции
Молекулярность реакции определяется числом частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) реакции и превращающихся в продукты.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Основными причинами несовпадения молекулярности и порядка реакции могут являться: простое несовпадение ( поскольку молекулярность- характеризует механизм, а порядок — кинетику реакции),
наличие избытка одного из исходных веществ, гетерогенность реакции, ее ступенчатый характер.
5. Установите, как изменится скорость химической реакции
а) уменьшить объем реакционной смеси в 2 раза;
б) уменьшить давление в 2 раза;
в) увеличить концентрации исходных веществ в 2 раза.
Решение.
Составим кинетическое уравнение реакции:
2.После уменьшения объема реакционной смеси в 2 раза концентрации реагентов увеличатся тоже в два раза. Тогда кинетическое уравнение примет вид:
Как видно из расчетов, после уменьшения объема реакционной смеси в 2 раза скорость реакции возрастет в 8 раз.
Уменьшение давления в 2 раза приведет к соответствующему уменьшению концентраций реагентов. Кинетическое уравнение примет вид:
Из расчетов следует, что после уменьшения давления реакционной смеси в 2 раза скорость реакции уменьшится в 8 раз.
Увеличение концентраций исходных веществ в 2 раза приведет к эффекту, аналогичному при соответствующем уменьшении объема системы:
Т.о, после увеличения концентраций исходных веществ в 2 раза скорость реакции возрастет в 8 раз
6. Объясните, как влияет повышение температуры, давления и концентрации исходных веществ на экзотермическую реакцию синтеза аммиака из простых веществ.
Запишем уравнение реакции синтеза аммиака из простых веществ:
N2 (г)+3H2(г)=2NH3(г) 
Данная реакция является обратимой, гомогенной (все реагенты – газы,), протекает с уменьшением объема (в реакцию вступает 4 объема исходных газов-реагентов, получается 2 объема газообразного продукта).
Повышение температуры, давления и концентрации исходных веществ будет влиять на рассматриваемую реакцию в соответствии с законом Ле-Шателье:
Если на систему, находящуюся в химическом равновесии, подействовать извне, то равновесие сместится в сторону реакции, компенсирующей внешнее воздействие.
Повышение температуры будет смещать равновесие в сторону обратной эндотермической реакции, протекающей с поглощением тепла.
Повышение давления будет смещать равновесие в сторону прямой реакции, протекающей с уменьшением объема реакционной смеси, т.е., с уменьшением давления.
1. Повышение концентраций исходных веществ(азота и водорода) будет смещать равновесие в сторону прямой реакции, ведущей к уменьшению этих концентраций.
6.Таким образом, из рассмотренных факторов повышение давления и концентраций исходных веществ будет благоприятно влиять на экзотермическую реакцию синтеза аммиака из простых веществ, способствовать увеличению ее выхода. Напротив, повышение температуры будет способствовать уменьшению выхода прямой реакции.
7. В биологическом полимере (белке) имеет место следующее превращение:
нативное состояние ↔ денатурированное состояние,
Причем при повышении температуры равновесие сдвигается вправо.
Сделайте вывод об энтальпии реакции (принцип Ле-Шателье).
Решение.
1.Принцип Ле-Шателье гласит: Если на систему, находящуюся в химическом равновесии, подействовать извне, то равновесие сместится в сторону реакции, компенсирующей внешнее воздействие.
2. В соответствии с этим принципом при повышении температуры равновесие сдвигается в сторону эндотермической реакции, протекающей с поглощением тепла, т.е., с увеличением энтальпии реакции.
3. Поскольку, согласно условию, при повышении температуры равновесие сдвигается вправо , то прямая реакция (идущая вправо) – эндотермическая:
нативное состояние ↔ денатурированное состояние, 
Растворы
8. Раствор содержит 20 г глюкозы в 100 г воды.
Вычислите давление насыщенного пара растворителя над раствором при температуре 15 о С, если давление пара чистой воды при этой же температуре равно 23,75 мм рт. ст.
Рассчитайте молярную долю растворителя.
Решение
Рассчитаем молярные доли растворенного вещества и растворителя:
1.1.

Где 


Тогда 
1.2.Молярную долю растворителя, 

тогда 
Согласно закону Рауля, давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя:

где 


9. Водный раствор одноатомного спирта, содержащий 0,874 г вещества в 100 мл воды, замерзает при температуре -0,354 о С.
Рассчитайте относительную молекулярную массу спирта и установите его формулу.
Решение.
1. Согласно закону Рауля понижение температуры кристаллизации раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества:
ΔТзам.= Тзам (растворителя)- Тзам (раствора)=KСm (1)
где Сm– моляльная концентрация раствора; К – криоскопическая постоянная. Для воды К=1,86° .
В соответствии с условием задачи ΔТзам.=0 о С-(-0,354 о С)=0,354 о С.
2. Из выражения (1) найдем моляльную концентрацию растворенного вещества:
Сm= ΔТзам/К=0,354/1,86=0,19 моль/кг
3.Согласно определению для моляльной концентрации:

Отсюда 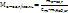
3. Общая формула предельных одноатомных спиртов –СnH2n+1OH. ., тогда молярную массу спирта можно выразить следующим образом:
М(R-OH)=14n+18=46, 14n=28, n =2. Следовательно, формула спирта – С2H5OH- этанол.
10. Осмотическое давление раствора объемом 250 мл, в котором содержится 20 г гемоглобина, равно 2855 Па (при 4 о Сили 277 К).
Установите молярную массу гемоглобина.
Решение.
1. Согласно закону Вант-Гоффа осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества:
Из выражения (1) найдем величину См:
См= Росм/(1000*R*T)=2855/(1000*8,314*277)=0,00124 моль/л
2. Согласно определению молярная концентрация находится по формуле(2):
, отсюда 
11.Водный раствор NaOH кипит при температуре 102,65 о С. Кажущаяся степень ионизации электролита равна 70%.
Определите массу NaOH, растворённую в 100 г воды.
Решение
1.Согласно закону Рауля повышение температуры кипения раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1):
ΔТкип. = i*Кэ*Сm, ( 1)
где i – поправочный изотонический коэффициент, Кэ – эбуллиоскопическая постоянная растворителя; для воды Кэ =0,52°; Сm –моляльная концентрация раствора; ΔТкип. = Ткип р-ра – Ткип.р-рителя. Согласно условию задачи ΔТкип=2,65°
Найдем величину i:
где α- кажущаяся степень ионизации электролита, согласно условию равна 0,7
n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Т.О., для гидроксида натрия n=2. Тогда :
Из выражения (1) найдем величину Сm :
Сm= ΔТкип/( i*Кэ)=2,65/(1,7*0,52)=3 моль/кг
Масса NaOH, растворённая в 100 г воды, определяется по формуле (2):
m(NaOH)= Сm*M(NaOH)*100/1000 (2),
где M(NaOH)=40 г/моль.
Подставляя результаты расчетов в формулу (2), получаем:
11. Раствор, содержащий 2,1 г КОН в 250 мл воды, замерзает при -0,514 о С.
Рассчитайте изотонический коэффициент и кажущуюся степень диссоциации.
Решение
Согласно закону Рауля понижение температуры замерзания раствора по отношению к чистому растворителю прямо пропорционально моляльной концентрации растворенного вещества. Для растворов электролитов закон Рауля выглядит следующим образом (1):
где i – поправочный изотонический коэффициент; К – криоскопическая постоянная растворителя; для воды К =1,86°; Сm –моляльная концентрация раствора; ΔТзам. = Тзам.р-рителя –Тзам. р-ра . Согласно условию задачи ΔТзам=0,514°
Найдем величину Сm. Согласно определению для моляльной концентрации:

2.Из выражения (1) найдем величину изотонического коэффициента:
I = ΔТзам./( К*Сm)= 0,514/(1,86*0,15)=1,84
3.Изотонический коэффициент и кажущаяся степень диссоциации связаны соотношением (2):
где α- кажущаяся степень ионизации электролита, n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Для гидроксида калия n=2.
Выразим величину α:
12. Осмотическое давление 0,5 М раствора карбоната калия равно 2726 кПа при 0 о С.
Вычислите кажущуюся степень диссоциации K2CO3 в растворе.
Решение
1.Согласно закону Вант-Гоффа для электролитов осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества:
где i – изотонический коэффициент
Найдем величину i:
Изотонический коэффициент связан с кажущейся степенью ионизации соотношением :
где α- кажущаяся степень ионизации электролита,
n – количество ионов, на которые распадается в растворе 1 молекула электролита:
Для карбоната калия n=3.
Выразим величину α:
Буферные системы
13. В состав крови входит буферная система, состоящая из двух анионов.
Приведите формулы её составных частей.
Назовите эту буферную систему.
Классифицируйте её по составу и природе компонентов.
Укажите зону буферного действия.
Напишите уравнения реакций, отражающих механизм действия (ионная форма).
Ответ
1. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая. Из этих систем только фосфатная состоит из двух анионов: Н2РО4 – (донор протонов) и НРО4 2– (акцептор протонов). Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных.
2. Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4.
3. Зона буферного действия буферной пары (Н2РО4 – –НРО4 2– )находится в интервале от 6,2 до 8,2.
4. Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО4 2– с образованием Н2РО4 – :
а также ионов ОН – с ионами Н2РО4 – :
14. Аммиачная буферная система состоит из двух составных частей.
Классифицируйте её по составу и природе компонентов.
Укажите интервал значений рН, внутри которого эта система обладает буферной емкостью.
Напишите уравнения реакций, отражающих механизм её действия (ионная форма).
Объясните, почему аммиачная буферная система не входит в состав крови.
Решение
1.Состав и природа компонентов:
А)NН4ОН (NН3 х Н2О)-гидроксид аммония, слабый электролит
Б) NН4С1 – соль, хлорид аммония, сильный электролит.
Гидроксид аммония — слабый электролит, в растворе частично диссоциирует на ионы:
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы:
и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции.
Интервал значений рН, внутри которого рассматриваемая система обладает буферной емкостью,рассчитывается по формуле:

где Кв – константа диссоциации NН4ОН=1,8*10 -5 , С0-концентрация основания, Сс-концентрация соли.
рН=14-4,74+lg(C0/Cc)=9,26+lg(C0/Cc). В зависимости от соотношения C0/Cc интервал значений рН составляет 8,26-10,26.
Способность аммиачного буфера поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора:
При добавлении щелочи ионы ОН — будут связывать ионы NН4 + , образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора:
Аммиачная буферная система не входит в состав крови, поскольку интервал значений рН, внутри которого она будет обладать буферной емкостью, находится в щелочной области (рН больше 8). Нормальное значение рН плазмы крови составляет 7,40 ± 0,05, т.е ниже области буферирования.
15. В 200 мл фосфатного буферного раствора содержится 0,8 моль кислотного компонента (Н2РО4 — ) и 1,6 моль солевого компонента (НРО4 2– ).
Установите рН буферного раствора.
Объясните, входит ли рассчитанное значение рН в ЗБД (рН: 6,2 – 8,2).
Ки (Н2РО4 — ) = 6,2×10 -8 моль/л; lg 2 = 0,3; lg 6,2 = 0,79.
Классифицируйте буферную систему по составу и природе компонентов.
Решение.
Подставим данные задачи в формулу для расчета рН фосфатного буфера:
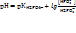
Рассчитанное значение рН входит в зону буферного действия( ЗБД) рН: 6,2 – 8,2
Фосфатная буферная система является кислотно-основной буферной системой, образованной анионами двух кислых солей
16. Концентрация ионов водорода в крови больного равняется 2,46∙10 -8 моль/л.
Рассчитайте рН крови (lg 2,46 = 0,39).
Назовите состояние, возникающее при данном нарушении КОС.
Укажите, чем характеризуется это состояние с точки зрения протолитического гомеостаза.
2. При данном нарушении КОС (рН> 7,4) возникает алкалоз
3. Под протолитическим гомеостазом принято понимать относительное постоянство соотношения кислота-основание внутренней среды живого организма. С точки зрения протолитического гомеостаза алкалоз — увеличение рН в крови (и других тканях организма) за счёт накопления щелочных веществ. Алкалоз может возникать вследствие гипервентиляции лёгких, приводящей к избыточному выведению СО2 из организма, вследствие больших потерь кислого желудочного сока при желудочных свищах, при длительном приёме диуретиков, при избыточном введении бикарбоната натрия с целью коррекции метаболического ацидоза или нейтрализации повышенной кислотности желудочного сока. При алкалозе уменьшается мозговой и коронарный кровоток, снижаются артериальное давление и минутный объем крови. Возрастает нервно-мышечная возбудимость, возникает мышечный гипертонус вплоть до развития судорог и тетании. Нередко наблюдается угнетение моторики кишечника и развитие запоров; снижается активность дыхательного центра. Для алкалоза характерно снижение умственной работоспособности, головокружение, могут возникать обморочные состояния.
Комплексные соединения
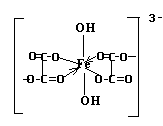
17. Определите заряд комплексообразователя и его координационное число в комплексном ионе [Fe(C2O4)2(OH)2] 3- .
Изобразите графически его структурную формулу.
Классифицируйте этот ион по природе лигандов.
Напишите выражение константы нестойкости.
Пусть заряд иона-комплексообразователя Fe =(Х+). Заряды лигандов равны:(C2O4) 2- , (OH) — . Составим уравнение баланса зарядов:
Т.О. заряд комплексообразователя: Fe +3
Координационное число -число связей, образованных комплексообразователем, с лигандами. В данном ионе к.ч. железа равно 6, т.к. 4 связи железо образует с двумя двухвалентными группами C2O4 и две связи – с двумя одновалентными группами ОН)
1. Структурная формула комплексного иона:
2. Данный ион содержит различные по природе лиганды: оксалат – ион и нидроксид – ион. Т.о. комплексный ион является ацидокомплексом (за счет оксалатов – кислотных остатков щавелевой кислоты) и гидроксокомплексом ( за счет гидроксильных групп).
3. Выражение константы нестойкости:
18. Напишите формулу комплексного соединения, имеющего название: хлорид гексаамминхрома (III).
Изобразите графически структурную формулу внутренней сферы.
Классифицируйте соединение по заряду комплексной частицы, по электропроводности, по природе ионов внешней сферы и по природе лигандов.
Рассчитайте координационное число комплексообразователя.
Напишите выражение константы нестойкости.
1. Хлорид гексаамминхрома (III) имеет молекулярную формулу:
2. Cтруктурная формула внутренней сферы:
По заряду комплексной частицы хлорид гексаамминхрома является катионным комплексом; по электропроводности –сильным электролитом, по природе ионов внешней сферы-хлоридом, по природе лигандов –аммиакатом
Координационное число комплексообразователя равно 6
Выражение константы нестойкости:
[Cr(NH3)6] 3+ ↔ Cr 3+ +6 NH3
19. Рассчитайте DG процесса [Fe(CN)6] 4- ↔ Fe 2+ + 6CN — , если Кн в стандартных условиях равна 10 -35 .
Изобразите графически структурную формулу комплексной частицы.
Классифицируйте её по природе лигандов.
Напишите выражение константы нестойкости.
Изменение свободной энергии Гиббса ΔG и константа равновесия связаны соотношением:
Подставляя данные задачи и учитывая, что стандартные условия соответствуют Т=298 К,получаем:
ΔG=-8,31*298 *ln10 -35 =-2,3*8,31*298*lg10 -35 =-2,3*8,31*298*(-35)=199349 дж=199,349 кДж
Структурная формула комплексной частицы:
3.По природе лиганда данное соединение является ацидокомплексом, т.к. CN — — кислотный остаток синильной кислоты
4. Выражение константы нестойкости:
Физико-химия коллоидно-дисперсных систем и растворов ВМС
20. Напишите коллоидно-химические формулы мицелл золей полученных по реакциям:
А) AgNO3 + KI ®
В) FeCl3 + NaOH ®
Приведите строение мицелл.
Примечания:
В вариантах А – В необходимо написать формулы мицелл в избытке каждого из исходных веществ.
2.Коллоидно-химические формулы мицелл золей:
А) AgNO3 + KI ®AgI↓+К NO3
Состав мицеллы, полученной при избытке AgNO3, может быть представлен следующим образом:
Ядро — m AgI *nAg + ; адсорбционный слой противоионов -(n-x) NO3 — ; диффузный слой противоионов — х NO3 — .
Состав мицеллы, полученной при избытке KI, может быть представлен следующим образом:
[m AgI *nI — *(n-x) К + ] x — *х К +
Ядро — m AgI *nI — ; адсорбционный слой противоионов -(n-x) К + ; диффузный слой противоионов — х К + .
Состав мицеллы, полученной при избытке CaCl2, может быть представлен следующим образом:
[m Са C2O4 *nCa 2+ *2(n-x) Cl — ] 2 x + *2х Cl —
Ядро — m Са C2O4 *nCa 2+ ; адсорбционный слой противоионов 2(n-x) Cl — ; диффузный слой противоионов — 2х Cl —
Состав мицеллы, полученной при избытке H2C2O4, может быть представлен следующим образом:
[m Са C2O4 *nC2O4 2- *2(n-x) H + ] 2 x — *2х H +
Ядро — m Са C2O4 *nC2O4 2- ; адсорбционный слой противоионов 2(n-x) H + ; диффузный слой противоионов — 2х H +
В)FeCl3 + 3NaOH ®Fe(OH)3↓ +3NaCl
Состав мицеллы, полученной при избытке FeCl3, может быть представлен следующим образом:
[m Fe(OH)3*nFe 3+ *3(n-x) Cl — ] 3x+ *3х Cl —
Ядро — m Fe(OH)3*nFe 3+ ; адсорбционный слой противоионов 3(n-x) Cl — ; диффузный слой противоионов — 3х Cl —
Состав мицеллы, полученной при избытке NaOH, может быть представлен следующим образом:
[m Fe(OH)3*nОН — * (n-x) Na + ] x- *х Na +
Ядро — m Fe(OH)3*n ОН — ; адсорбционный слой противоионов (n-x) Na + ; диффузный слой противоионов — х Na +
Г) FeCl3 + 2H2O ® Fe(OH)2Cl+ 2HCl
Состав мицеллы, полученной при гидролизе хлорида железа, может быть представлен следующим образом:
Ядро — m Fe(OH)3* nFeO + ; адсорбционный слой противоионов (n-x) Cl — ; диффузный слой противоионов — х Cl —
21. Имеются 3 коллоидных раствора: гидроксида железа (III), полученного гидролизом FeCl3, иодида серебра, полученного в избытке КI, и иодида серебра, полученного в избытке AgNO3.
Предложите два варианта взаимной коагуляции.
Объясните, используя формулы мицелл.
А)гидроксида железа (III), полученного гидролизом FeCl3:
Положительно заряженный золь
Б)иодида серебра, полученного в избытке КI:
[m AgI *nI — *(n-x) К + ] x — *х К +
Отрицательно заряженный золь
в)иодида серебра, полученного в избытке AgNO3:
Положительно заряженный золь
2.Взаимная коагуляция наблюдается при сливании растворов противоположно заряженных золей., а именно:
· Отрицательно заряженного золя иодида серебра, полученного в избытке КI, и положительно заряженного золя иодида серебра, полученного в избытке AgNO3.;
· Отрицательно заряженного золя иодида серебра, полученного в избытке КI, и положительно заряженного золя гидроксида железа (III), полученного гидролизом FeCl3.
22. Пороговая концентрация коллоидного раствора гидроксида алюминия равняется 0,63 ммоль/л.
Рассчитайте объем 0,01М раствора дихромата калия, вызывающего коагуляцию золя объёмом 200 мл.
Определите заряд гранулы, учитывая, что коагулирующим действием обладает дихромат-анион.
Предложите соответствующий вариант формулы мицеллы золя Al(OH)3.
Рассчитаем объем раствора электролита-коагулятора дихромата калия (V) по формуле:
, где γ- пороговая концентрация коллоидного раствора гидроксида алюминия, равна 0,63 ммоль/л, V золя –объем золя, согласно условию равен 0,2 л, С- концентрация электролита-коагулятора дихромата калия, равна 10 ммоль/л. Подставляя значения в формулу, получаем:
V=0,63 ммоль/л *0,2л/10 ммоль/л=0,0126 л=12,6 мл
2.Поскольку коагулирующим действием обладает дихромат-анион, заряд гранулы (коллоидной частицы) противоположен, т.е. положителен.
3. Соответствующий вариант формулы мицеллы золя Al(OH)3, стабилизированного AlCl3:
[m Al(OH)3 *nAl 3+ *3(n-x)Cl — ] +x *3xCl —
3.Строение мицеллы:
Ядро — m Al (OH)3*n Al 3+ ; адсорбционный слой противоионов 3(n-x) Cl — ; диффузный слой противоионов — 3х Cl —
23. ИЭТ альбумина плазмы крови равна 4,64.
Определите знак заряда частиц альбумина в 0,001М растворе HCl.
Укажите направление перемещения частиц альбумина при электрофорезе в данных условиях.
Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
http://lektsia.com/4×5602.html
http://chemege.ru/kinetika/