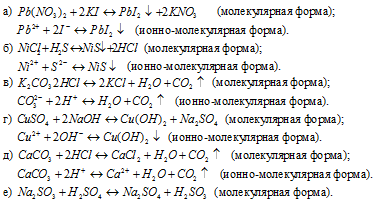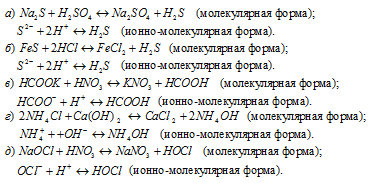Составьте молекулярные (а) и краткие ионные (б) уравнения реакций нейтрализации, в которых образуются: 1) сульфат свинца
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,211
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Реакция нейтрализации в химии: объяснение, примеры, уравнения и решение
Содержание:
Реакция нейтрализации – это реакция между кислотой и основанием с формированием растворимой соли и воды.
Кислота + основание = соль + вода
Как правило, эти взаимодействия сопровождаются выделением тепла. Количество выделенной энергии — это тепловой эффект взаимодействия между соединениями. Реакция нейтрализации — это один из типов реакции обмена.
Характеристика нейтрализации
H + +Cl — +K + +OH — =K + +Cl — +H2O
Реакцию нейтрализации можно записать сокращенным ионным уравнением:
Если поместить лакмусовую бумажку в пробирку с кислотой, то она становится красной. Если ее поместить в пробирку со щелочью, то она становится синей. При взаимодействии щелочи и кислоты лакмус приобретает фиолетовый оттенок, что указывает на нейтральную среду.
Если получившийся раствор нагреть, то вода испарится, а в колбе останутся кристаллы соли.
Примеры реакций нейтрализации
Реакции нейтрализации — это реакции ионного обмена. Необратимые реакции характерны для реакций сильной кислоты и сильного основания.
Полное ионное уравнение
H + +Br — +K + +OH — → K + + Br — + H2O
Сокращенное ионное уравнение
Обратимые реакции наблюдаются при взаимодействии сильного основания и слабой кислоты.
Полное ионное уравнение
2Н + +SO3 2- +2Li + +2OH — ↔2Li + +SO3 2- +2H 2 O
Сокращенное ионное уравнение
Также обратимые реакции характерны для взаимодействий слабого основания и сильной кислоты.
Полное ионное уравнение
Сокращенное ионное уравнение
Не характерно для данной реакции.
Задачи на реакции нейтрализации
Задача. Сколько мл гидроксида натрия NaOH необходимо для нейтрализации 0,1 моль серной кислоты H2SO4, при том что плотность гидроксида натрия NaOH равна 0,968 г/мл.
Дано:
Решение:
Ответ: V(NaOH)=8,264 мл
Найти: V(NaOH)-?
Применение реакций нейтрализации
Реакции нейтрализации активно используются в титровании. Их используют при определении уровня кислотности желудочного сока. Если в лаборатории проливается щелочь, то ее нейтрализуют и убирают. Таким образом, реакции нейтрализации активно используются человеком.
Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
http://bingoschool.ru/manual/reakcziya-nejtralizaczii-v-ximii-obyasnenie-primeryi-uravneniya-i-reshenie/
http://buzani.ru/zadachi/khimiya-glinka/1194-ionno-molekulyarnaya-forma-uravneniya-zadachi-580-582