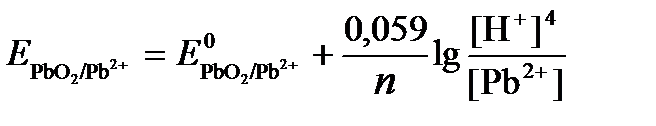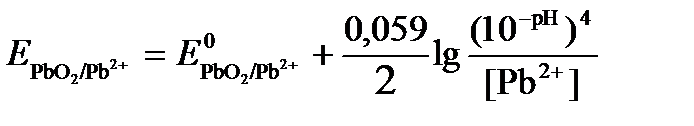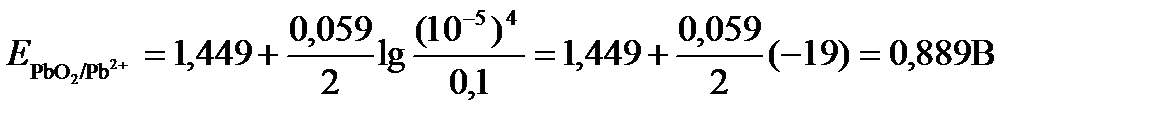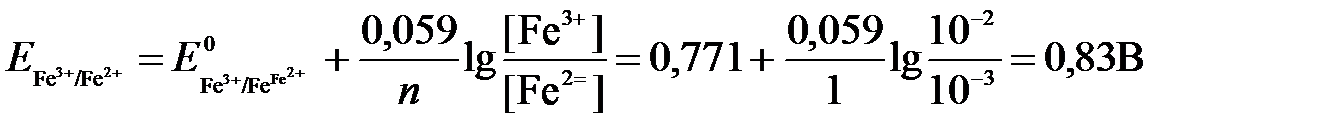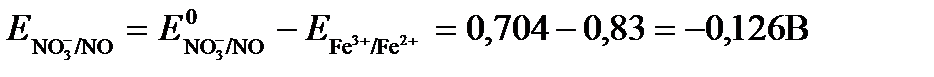ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ. 2KBr + PbO2 + 4HNO3 = Pb(NO3)2 + Br2 + 2KNO3 + 2H2O
ПРИМЕР 1 Для реакции
установить направление возможного протекания ее при стандартных условиях.
РЕШЕНИЕ . Запишем уравнение реакции в ионно-молекулярной форме:
Затем представим его в виде полуреакций, с указанием табличных значений ОВ-потенциалов:
PbO2 + 4H + + 2ē = Pb 2+ + 4H2O E 0 (Pb 2+ /PbO2)= 1,449 В
Потенциал окислителя Е 0 окбольше, чем потенциал восстановителя Е 0 восс, следовательно, приведенная реакция будет самопроизвольно протекать слева направо.
ПРИМЕР 2.Могут ли в стандартных условиях одновременно находиться в растворе хлориды двухвалентного олова и трехвалентного железа?
РЕШЕНИЕ. Представим данную систему в виде реакции
Определим по таблице значения стандартных электродных потенциалов полуреакций.
Sn 2+ — 2 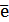
2 Fe 3+ + 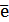
Sn 2+ +2Fe 3+ = Sn 4+ + 2Fe 2+
В данном примере Еок > Eвосс, т.е. реакция в стандартных условиях будет протекать самопроизвольно в прямом направлении и, следовательно, указанные хлориды будут реагировать между собой, поэтому одновременное нахождение их в растворе невозможно.
ПРИМЕР 3. Рассчитать константу равновесия окислительно-восстановительной системы при стандартных условиях:
10Br — + 2MnO4 — + 16H + = 5Br2 + 2Mn 2+ + 8H2O,
если E 0 (Br2/Br — ) = 1,065В; E 0 (MnO4 — /Mn 2+ ) = 1,507В.
РЕШЕНИЕ. Представим данную реакцию в виде полурекций окисления и восстановления:
Константа равновесия К окислительно-восстановительной реакции с окислительно-восстановительными потенциалами связана следующим соотношением:
lgК= 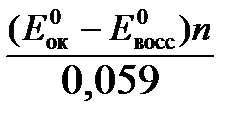
Окислителем в данной реакции является MnO4 — , а восстановителем – Br — . В окислительно-восстановительном процессе участвуют 10 электронов. Отсюда:
lgK = 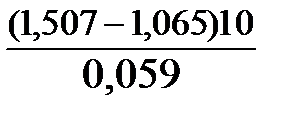
ПРИМЕР 4. Рассчитайте равновесный потенциал электрода, на котором протекает реакция PbO2+ 4 H + + 2ē ↔ Pb 2+ + 2H2О, если 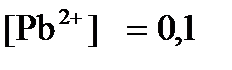
РЕШЕНИЕ. Потенциал окислительно-восстановительного электрода определяем по уравнению:
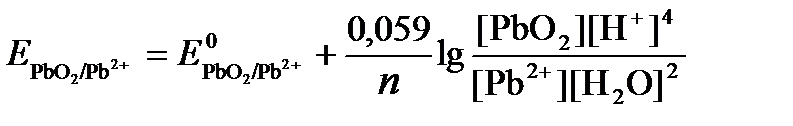
Концентрация 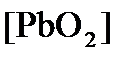
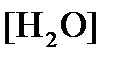
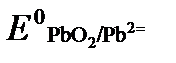
Исходя из того, что рН =-lg[H + ] или [H + ]= 10 -рН , данное уравнение принимает вид:
Подставляя значения Е 0 и концентраций ионов, получаем
ПРИМЕР 5. Рассчитайте ЭДС окислительно-восстановительной системы
3Fe 2+ + NO3 — + 4H + = NO + 3Fe 3+ + 2H2O,
если [Fe 2+ ]=10 -3 моль/л, [Fe 3+ ]=10 -2 моль/л, [NO3 — ]=10 -1 моль/л, а рН=3.
РЕШЕНИЕ. Выразим данную ОВ-систему в виде окислительно-восстановительных полурекций с указанием стандартных ОВ-потенциалов:
а) Fe 2+ — ē →Fe 3+ 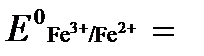
б) NO3 — + 4H + + 3ē → NO + 2H2O 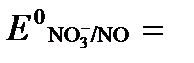
Для реакции (а) определим ОВ-потенциал по уравнению (3):
Для реакции (б) используем уравнение Нернста с учетом рН-среды:
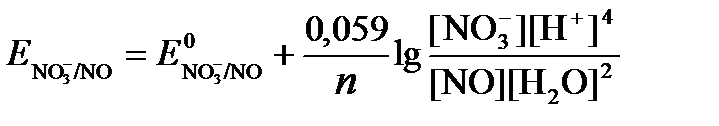
Имея ввиду, что активности [NO] и [H2O] являются постоянными и включены в значение Е 0 , а [H + ]=10 -рН ,рассчитаем ОВ-потенциал реакции (б) по уравнению:
Затем рассчитаем ЭДС приведенной окислительно-восстановительной системы:
ЭДС= ΔЕ =Еокс – Евосст=
ПРИМЕР 6.Могут ли в стандартных условиях KClO3 и КBr одновременно находиться в щелочном растворе? Если нет, то укажите возможные продукты окисления и восстановления.
РЕШЕНИЕ. В бромиде калия КBr бром имеет низшую степень окисления -1 (Br -1 ), следовательно, он может проявлять только восстановительные свойства. В щелочной среде возможны следующие реакции окисления Br -1 :
а) Br -1 + 6ОН — — 6ē = BrО3 -1 + 3Н2О Е 0 = +0,61В
б) Br -1 + 2ОН — — 2ē = BrО -1 + Н2О Е 0 = +0,76В.
В ионе ClO3 — хлор находится в промежуточной степени окисления +5. В случае совместного нахождения в растворе с восстановителем (КBr), KClO3 будет проявлять только окислительные свойства.
В щелочном растворе возможно восстановления ClO3 — по реакции:
ClO3 — + 3Н2О +6е = Cl — + 6ОН — Е 0 = +0,63В.
Сравнивая потенциалы окислителя и восстановителя, можно сделать вывод, что реакция окисления Br -1 по реакции (б) не может протекать, потому что Еок -1 в присутствии KClO3 по реакция (а) возможно:
Br -1 + 6ОН — — 6ē = BrО3 -1 + 3Н2О
Br -1 + 6ОН — + ClO3 — + 3Н2О = BrО3 -1 + 3Н2О + Cl — + 6ОН —
Таким образом, KClO3 и КBr одновременно находиться в щелочном растворе не могут, а вероятные продукты реакции — KCl и К BrО3.
ПРИМЕР 7. Может ли пероксид водорода H2O2 проявлять окислительные и восстановительные свойства? На основании стандартных электродных потенциалов привести примеры возможных реакций.
РЕШЕНИЕ. Пероксид водорода H2O2 имеет в своем составе кислород в промежуточной степени окисления (-1), поэтому он может проявлять как окислительные, так и восстановительные свойства.
Например, в кислой среде восстановление H2O2 протекает по реакции:
Окисление H2O2 протекает по реакции:
Чтобы в ОВ-реакции H2O2 проявлял окислительные свойства, надо по окислительно-восстановительным потенциалам выбрать восстановитель, у которого потенциал был меньше 1,776 В. Например, ион I — для которого:
2 I -1 — 2ē = I2 Е 0 = +0,536В.
Чтобы в ОВ-реакции H2O2 проявлял восстановительные свойства, надо по окислительно-восстановительным потенциалам выбрать окислитель, у которого потенциал был больше 0,682 В. Например, ион ClO3 — для которого:
Сократив в правой части ионы водорода (Н + ), получаем:
ПРИМЕР 8. Какой из металлов никель или кадмий легче взаимодействует с разбавленной HCl?
РЕШЕНИЕ. Запишим уравнения реакции взаимодействия этих металлов с HCl:
Ni – 2ē = Ni 2+ E 0 = -0,25 B
Cd – 2ē = Cd 2+ E 0 = -0,403 B
Рассчитаем для обеих реакций изменение свободной энергии Гиббса по формуле
Для реакции (а) ΔGх.р. = -2.96500.(0,0 + 0,25)= -48250 Дж.
Для реакции (б) ΔGх.р. = -2.96500.(0,0 + 0,403)= -77779 Дж.
Так как в реакции (б) убыль свободной энергии Гиббса больше, чем в реакции (а), следовательно, кадмий легче взаимодействует с HCl.
ПРИМЕР 9. На основании окислительно-восстановительных потенциалов реакций восстановления иона ClО3 — определите, в какой среде, нейтральной или кислой, ClО3 — проявляет более сильные окислительные свойства.
РЕШЕНИЕ. Представим возможные реакции восстановления иона ClО3 — в нейтральной и кислой средах:
C1О3 — + 3H2O + 6ē = Cl — + 6ОH — E 0 =0,63 B
Процесс протекает тем глубже, чем отрицательнее ΔGхр. Из соотношения ΔG 0 х.р = -nF(Е 0 ок – E 0 восс ) следует: чем выше потенциал окислителя, тем меньше ΔG 0 хр. В кислой среде ОВ-потенциал иона ClО3 — больше, значит, в кислой среде он проявляет более сильные окислительные свойства.
Дата добавления: 2015-07-24 ; просмотров: 2550 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
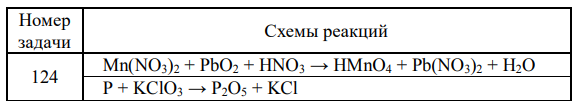
Окислительно-восстановительные реакции протекают по приведенным схемам. Mn(NO3)2 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + H2O
| 🎓 Заказ №: 22189 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Окислительно-восстановительные реакции протекают по приведенным схемам. Для каждой реакции укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций.
Решение: Mn NO PbO HNO HMnO Pb NO3 2 H2O В ходе данной окислительно-восстановительной реакции степень окисления марганца повышается от +2 до +7, степень окисления свинца понижается от +4 до +2 2Mn(NO3 ) 2 5PbO2 HNO3 2HMnO4 5Pb(NO3 ) 2 H2O В правой части 10 атомов азота, в левой части 5 атомов азота. Для уравнивания ставим перед формулой HNO3 коэффициент 6
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Гидролиз нитрата свинца (II)
Pb(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Полное ионное уравнение
Pb 2+ + 2NO3 — + HOH ⇄ PbOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Pb 2+ + HOH ⇄ PbOH + + H +
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
PbOH + + NO3 — + HOH ⇄ Pb(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
PbOH + + HOH ⇄ Pb(OH)2 + H +
Среда и pH раствора нитрата свинца (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
http://lfirmal.com/%D0%9E%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D0%BE-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5-%D1%80%D0%B5%D0%B0-18/
http://chemer.ru/services/hydrolysis/salts/Pb(NO3)2