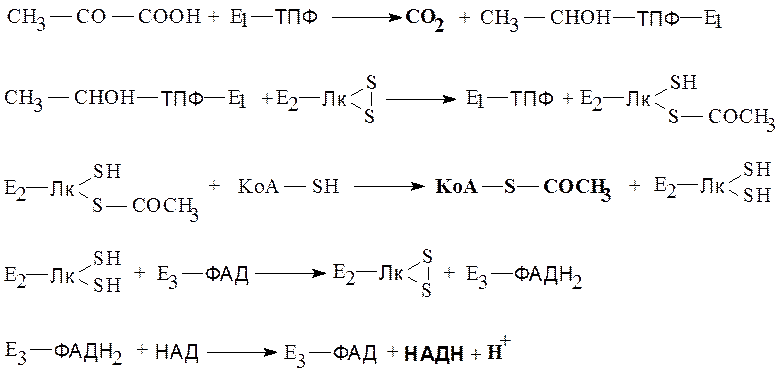Пируват окисляется до уксусной кислоты
Пировиноградная кислота (ПВК, пируват) является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях пируват симпортом с ионами Н + , движущимися по протонному градиенту, проникает в митохондрии. Здесь происходит его превращение до уксусной кислоты, переносчиком которой служит коэнзим А.
Пируватдегидрогеназный мульферментный комплекс
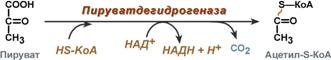
Суммарное уравнение отражает окислительное декарбоксилирование пирувата, восстановление НАД до НАДН и образование ацетил-SKoA.
Суммарное уравнение окисления пировиноградной кислоты
Превращение состоит из пяти последовательных реакций, осуществляется мультиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают 3 фермента и 5 коферментов:
- Пируватдегидрогеназа (Е1, ПВК-дегидрогеназа), ее коферментом является тиаминдифосфат (ТДФ), катализирует 1-ю реакцию.
- Дигидролипоат-ацетилтрансфераза (Е2), ее коферментом является липоевая кислота, катализирует 2-ю и 3-ю реакции.
- Дигидролипоат-дегидрогеназа (Е3), кофермент – ФАД, катализирует 4-ю и 5-ю реакции.
Помимо указанных коферментов, которые прочно связаны с соответствующими ферментами, в работе комплекса принимают участие коэнзим А и НАД.
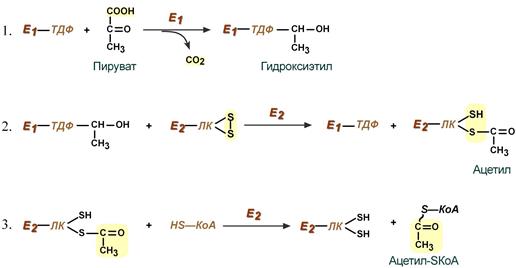
Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению полученного гидроксиэтила до ацетила и переносу ацетила на коэнзим А (катализируется дигидролипоат-ацетилтрансферазой, Е2).
Реакции синтеза ацетил-SКоА
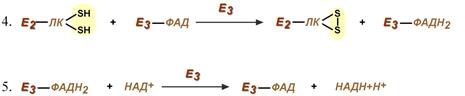
Оставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в окисленное состояние (катализируются дигидролипоат-дегидрогеназой, Е3). При этом образуется НАДН.
Реакции образования НАДН
Регуляция пируватдегидрогеназного комплекса
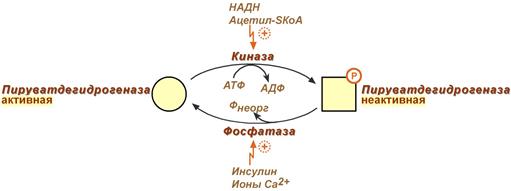
Регулируемым ферментом ПВК-дегидрогеназного комплекса является первый фермент – пируватдегидрогеназа (Е1). Два вспомогательных фермента – киназа и фосфатаза обеспечивают регуляцию активности пируватдегидрогеназы путем ее фосфорилирования и дефосфорилирования.
Вспомогательный фермент киназа активируется при избытке конечного продукта биологического окисления АТФ и продуктов ПВК-дегидрогеназного комплекса – НАДН и ацетил-S-КоА . Активная киназа фосфорилирует пируватдегидрогеназу, инактивируя ее, в результате первая реакция процесса останавливается.
Фермент фосфатаза, активируясь ионами кальция или инсулином , отщепляет фосфат и активирует пируватдегидрогеназу.
Регуляция активности пируватдегидрогеназы
Таким образом, работа пируватдегидрогеназы подавляется при избытке в митохондрии (в клетке) ацетил-SКоА и НАДН, что позволяет снизить окисление пирувата и, следовательно, глюкозы в случае когда энергии достаточно.
Если АТФ мало или имеется влияние инсулина, то образуется ацетил-SКоА. Последний в зависимости от условий будет направляться либо в цикл трикарбоновых кислот с образованием энергии АТФ, либо на синтез холестерина и жирных кислот.
Окислительное декарбоксилирование пирувата.
Раздел 2. Тема 7. Общий путь катаболизма.
Сущность общего пути катаболизма.
Начальные этапы катаболизма (специфические пути катаболизма) основных пищевых веществ (углеводы, белки, жиры) происходят при участии ферментов, специфичных для каждого класса веществ, и завершаются образованием 2 метаболитов — ПВК и уксусной кислоты в форме ацетил-КоА. После образования ПВК дальнейший путь распада веществ до конечных продуктов СО2 и Н2О происходит одинаково в общем пути катаболизма (ОПК, см. рисунок. ).
Ацетил-КоА образуется в специфических реакциях катаболизма жирных кислот и некоторых аминокислот. Но главным источником ацетил-КоА служит пировиноградная кислота, образующаяся в реакциях катаболизма глюкозы и некоторых аминокислот.
Катаболизм основных пищевых веществ. 1-3 — пищеварение; 4-8 — специфические пути катаболизма; 9-10 — общий путь катаболизма; 11 — ЦПЭ; 12 — окислительное фосфорилирование.
Таким образом, общий путь катаболизма включает: 1) окислительное декарбоксилирование пирувата до ацетил-КоА; 2) окисление ацетильной группы ацетил-КоА в цикле трикарбоновых кислот (ЦТК=Цикле Кребса=цикле лимонной кислоты).
Общий путь катаболизма протекает в матриксе митохондрий, реакции являются необратимыми, т.к. происходит уменьшение стандартной свободной энергии.
Строение пируватдегидрогеназного комплекса.
Пируватдегидрогеназный комплекс (ПДК) является классическим мультиферментным комплексом (молекулярная масса более 6×10 6 ), в котором промежуточные продукты остаются связанными на поверхности молекулы фермента до образования конечного продукта. Его концентрация повышена в сердечной мышце, почках.
В состав ПДК входит 3 фермента и 5 кофакторов.
I-й фермент – пируватдегидрогеназа содержит кофактор тиаминпирофосфат (производное витамина В1);
II-й фермент – дигидролипоилтрансацетилаза содержит кофакторы липоевую кислоту (липоамид, ЛК) и кофермент А (НS-КоА);
III-й фермент — дигидролипоилдегидрогеназа содержит кофакторы ФАД + и НАД + .
Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза.
| Фермент | Кофермент | Витамин | |
| 1. Пируватдекарбоксилаза (пируватдегидрогеназа) | Е1 | ТПФ (ТДФ) | Тиамин (B1) |
| 2. Дигидролипоилтрансацетилаза | Е2 | Липоамид | Липоевая кислота (ЛК) |
| KoA | Пантотеновая кислота (В5) | ||
| 3. Дигидролипоилдегидрогеназа | Е3 | FAD + NAD + | Рибофлавин (В2) Никотиновая кислота (РР) |
В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3). Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТПФ, а дигидролипоилдегидрогеназа — FAD. Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные «кронштейны», переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH+Н + ) образование высокоэнергетической тиоэфирной связи в ацетил-КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока — шаперонов, предотвращающих их преждевременный фолдинг (приобретение окончательной нативной конформации) до поступления в митохондриальный матрикс или внутреннюю мембрану митохондрий.
Окислительное декарбоксилирование пирувата.
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н + .
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD + + HS-KoA → CH3-CO ∼SKoA + (NADH + H + ) + CO2
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил-КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н + поступает в среду. Реакция необратима, поскольку ΔG 0′ = -33,5 кДж/моль.
Превращение пирувата в ацетил-КоА включает 5 стадий (см. рисунок ниже).
Стадия I.На этой стадии пируват соединяется с ТПФ в составе Е1 и подвергается декарбоксилированию. В результате двух реакций образуется производное ТДФ с гидроксиэтильной группой — гидроксиэтилтиаминпирофосфат.
Стадия П.Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты (ацитиллипоевая кислота).
Стадия III.На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток (дигидролипоевая кислота).
Стадия IV.На стадии IV дигидролипоилдегидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD — простетическую группу фермента Е3.
Стадия V. На стадии V восстановленный FADH2 передаёт водород на NAD + с образованием NADH+Н + .
Окислительное декарбоксилирование пирувата сопровождается образованием NADH+Н + , поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования.
или упрощенная схема (учим по той, которая больше нравится):
Окислительное декарбоксилирование пирувата
В аэробных условиях в клетках большинства организмов пировиноградная кислота преимущественно используется в процессе окислительного декарбоксилирования.
Окислительное декарбоксилирование представляет собой сложный метаболический процесс, протекающий в митохондриях. В нем принимают участие несколько ферментов, объединенных в единый структурный ансамбль – пируватдегидрогеназный комплекс.
Пируватдегидрогеназный комплекс встроен во внутреннюю митохондриальную мембрану. Он включает три фермента: пируватдегидрогеназу (Е 
Ниже представлена последовательность реакций, происходящих в процессе окислительного декарбоксилирования пирувата (жирным шрифтом выделены конечные продукты процесса):
На I стадии процесса пируват подвергается декарбоксилированию. При взаимодействии с коферментом пируватдегидрогеназы (Е1) он теряет свою карбоксильную группу. Продукт декарбоксилирования, в форме гидроксиэтильного производного, оказывается связанным с ТПФ.
На II стадии гидроксиэтильная группа с кофермента пируватдегидрогеназы переносится на кофермент дигидролипоил-ацетилтрансферазы (Е2) –амидлипоевой кислоты. При этом образуется ацетильный радикал, связанный с восстановленной формой амида липоевой кислоты и освобождается редуцированная пируватдегидрогеназа (Е1).
На III стадии процесса происходит перенос ацетильной группы на коэнзим А с образованием ацетил-КоА, представляющего собой один из конечных продуктов окислительного декарбоксилирования пировиноградной кислоты.
На IV стадии происходит окисление восстановленной формы амида липоевой кислоты за счет дегидролипоилдегидрогеназы (Е3). Атомы водорода переносятся с сульфгидрильных групп амида липоевой кислоты на флавиновую простетическую группу Е3.
На V стадии восстановленный ФАД используется для восстановления НАД. При этом образуется следующий продукт окислительного декарбоксилирования пирувата – восстановленный НАД.
Балансовое уравнение окислительного декарбоксилирования пирувата может быть представлено как:
Пируват + НАД + КоА-SH = Ацетил-КоА + НАДН+Н + + СО2
Процесс, катализируемый пируватдегидрогеназным комплексом, сопровождается значительным уменьшением свободной энергии. Поэтому он практически необратим.
Функционирование пируватдегидрогеназного комплекса подвержено тонкой регуляции. Входящий в его состав энзим пируватдегидрогеназа (Е1) является аллостерическим ферментом. Его ингибиторы – АТФ, восстановленный НАД, ацетил-КоА и высшие жирные кислоты.
Помимо аллостерической регуляции, активность пируватдегидрогеназы регулируется путем ее ковалентной модификации. В состав пируватдегидрогеназного комплекса, наряду с тремя ферментами, которые катализируют отдельные стадии процесса, входят два регуляторных фермента:
1 – киназа пируватдегидрогеназы, катализирующая фосфорилирование Е1 за счет АТФ; 2 – фосфатаза Е1, катализирующая дефосфорилирование того же энзима (рис. 89).
Рисунок 89 – Регуляция активности пируватдегидрогеназы (Е1) путем
ковалентной модификации (ПДГ- пируватдегидрогеназа)
Ковалентная модификация (фосфорилирование) пируватдегидрогеназы происходит при увеличении концентрации АТФ в клетке. Фосфорилированный фермент утрачивает каталитические свойства. Активность восстанавливается в том случае, если фермент дефосфорилируется под влиянием фосфатазы.
Основным путем обмена образовавшегося в результате окислительного декарбоксилирования пирувата ацетил-КоА является окисление в цикле трикарбоновых кислот до конечных продуктов обмена (двух молекул углекислого газа). Окисление одного ацетильного радикала сопровождается восстановлением трех молекул НАД и одной молекулы ФАД, а также образованием одной молекулы ГТФ.
Окисление каждой молекулы восстановленного НАД в дыхательной цепи может обеспечивать синтез трех молекул АТФ, а восстановленного ФАД – двух молекул АТФ. В этой связи энергетический эффект окисления одной молекулы ацетил-КоА в цикле Кребса соответствует 12 молекулам АТФ.
Таким образом, в аэробных условиях происходит окисление глюкозы до конечных продуктов обмена – углекислого газа и воды. Этот процесс складывается из трех основных стадий (рис. 90).
Рисунок 90 – Стадии процесса полного аэробного распада глюкозы
На первой стадии происходит окисление глюкозы до пирувата в гликолитических реакциях. На второй стадии продукт гликолиза – пировиноградная кислота подвергается процессу окислительного декарбоксилирования с образованием ацетил-КоА. На третьей стадии ацетил-КоА подвергается окислению в цикле Кребса.
Для расчета энергетического эффекта полного аэробного окисления глюкозы необходимо суммировать энергетические эффекты каждой стадии этого процесса:
1. В процессе гликолиза синтезируются две молекулы АТФ и две молекулы восстановленного НАД (образующегося в глицеральдегид-3-фосфат-дегидрогеназной реакции), из которого при окислении в дыхательной цепи может возникать
Итого, в процессе гликолиза при окислении молекулы глюкозы в аэробных условиях может образоваться
2. Из двух молекул пирувата, образующихся в процессе гликолиза, при окислительном декарбоксилировании синтезируется две молекулы восстановленного НАД. При их окислении в дыхательной цепи митохондрий может образовываться
3. При окислении в цикле Кребса двух молекул ацетил-КоА, образующихся из двух молекул пирувата, в процессе его окислительного декарбоксилирования, образуется (3 х 2) молекулы восстановленного НАД, (1 х 2) молекулы восстановленного ФАД и (1 х 2) молекулы ГТФ (АТФ). Всего при окислении в дыхательной цепи восстановленных коферментов может образоваться 2 х 3 х 3 = 18 АТФ и 2 х 1 х 2 = 4 АТФ.
Итого: 18 + 4 + 2 = 24 АТФ.
Суммируя количество молекул АТФ, образующихся в процессе полного аэробного окисления глюкозы, получаем 8 + 6 + 24 = 38 АТФ.
Итого, энергетический баланс полного аэробного окисления глюкозы составляет 38 АТФ в расчете на одну молекулу глюкозы.
Сравнивая энергетический эффект аэробного и анаэробного окисления глюкозы, можно придти к выводу о значительном преимуществе (2/38) аэробного окисления глюкозы. Вместе с тем при условиях, когда доступность кислорода ограничена, клетка использует анаэробный гликолиз, как основной источник энергетического обеспечения.
В аэробных условиях две молекулы НАД, восстановленного в глицеральдегиддегидрогеназной реакции гликолиза могут быть использованы для окисления в дыхательной цепи митохондрий, в результате чего образуется соответствующее количество АТФ (что было учтено при расчете энергетического баланса полного аэробного окисления глюкозы). Однако гликолитические реакции проходят в цитозоле клетки, а дыхательная цепь локализуется во внутренней митохондриальной мембране. При этом внутренняя митохондриальная мембрана непроницаема ни для окисленного, ни для восстановленного НАД. В этой связи возможность использования цитозольного восстановленного НАД для окисления в дыхательной цепи, может быть связана с существованием особых механизмов переноса восстановленного НАД внутрь митохондрий. Действительно, в процессе эволюции были сформированы особые системы переноса цитозольного восстановленного НАД в матрикс митохондрий, которые получили название “челночные системы”.
http://poisk-ru.ru/s1193t8.html
http://allrefrs.ru/1-46597.html