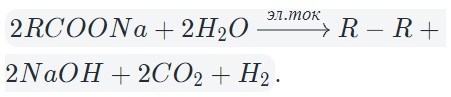Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6dfedad0b8af0b33 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Электролиз расплава бромида бария?
Химия | 5 — 9 классы
Электролиз расплава бромида бария.
К : Ba[ + 2] + 2e = Ba[0]|окислитель
A : 2Br[ — ] — 2e = Br2[0]|восстановитель
BaBr2 = Ba + Br2(электролиз расплава).
Напишите уравнение и схему электролиза : A) Расплава флорида бария Б) Раствора сульфида натрия?
Напишите уравнение и схему электролиза : A) Расплава флорида бария Б) Раствора сульфида натрия.
Составьте схемы электролиза расплава бромида калия и раствора хлорида натрия?
Составьте схемы электролиза расплава бромида калия и раствора хлорида натрия.
Напишите уравнения электролиза расплавов :А) хлорида калияБ) бромида натрияВ) хлорида магния?
Напишите уравнения электролиза расплавов :
А) хлорида калия
Б) бромида натрия
В) хлорида магния.
Напишите уравнения реакций, протекающих при электролизе водного раствора и расплава бромида калия?
Напишите уравнения реакций, протекающих при электролизе водного раствора и расплава бромида калия.
Какие вещества можно получить при этом?
Схема электролиза расплава бромида натрия?
Схема электролиза расплава бромида натрия.
Написать уравнение реакции электролиза расплава бромида кальция?
Написать уравнение реакции электролиза расплава бромида кальция.
1. составьте уравнения реакций электролиза расплава йодида калия?
1. составьте уравнения реакций электролиза расплава йодида калия?
Расплава бромида кальция (катод) (анод) 3.
Расплава хлорида меди(II) (катод) (анод).
Написать уравнение электролиза раствора и расплава Бромида Бария?
Написать уравнение электролиза раствора и расплава Бромида Бария.
Электролиз расплава cuso4?
Электролиз расплава cuso4.
Прошу помогите?
«»»»Составить схему электролиза растворов : карбоната калия, нитрата свинца, иода бария, ортофосфата натрия, бромида олова Расплава : гидроксида натрия,.
Вы зашли на страницу вопроса Электролиз расплава бромида бария?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 5 — 9 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
Cao кислотный оксид koh основание cuso4 соль so2 кислотный оксид h3po4 кислота.
M = 160 (г) M(Al(NO3)3) = 27 + 3 * 14 + 9 * 16 = 213 (г / моль) n = m / M = 160 / 213 = 0. 75 (моль) N = Na * n, гдеNa — число Авогадро = 6. 02 * 10 ^ 23 (молекул / моль) N = 6. 02 * 10 ^ 23 * 0. 75 = 4. 515 * 10 ^ 23 (молекул).
Ну если бы не зарубежные, то тогда о химии не узнали бы зарубежные люди, а наши ученые изобрели химию, если бы не они, ее бы и не было.
4)HCl + Fe(OH)2 = FeCl2 + H2O.
Метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан. Каждый раз на один углерод больше. Изомеры : сначала находите главную цепь (в той, которой больше углеродов), для удобства ее можно обвести, затем смотрите какие есть ответвле..
Вещества в природе огромное количество. В основном это руды металлов с неметаллами. Газы в воздухе. Физические явления явления меняющие агрегатные состояния, массы. Химические которые из одного вещества, получают существенно другое вещество.
А — 4 W(O2) = ((16×2) / 58) * 100% = 55. 2% Б — 3 W(O2) = ((16×7) / 183) * 100% = 61. 2%.
Электролиз расплавов и растворов
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:
Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
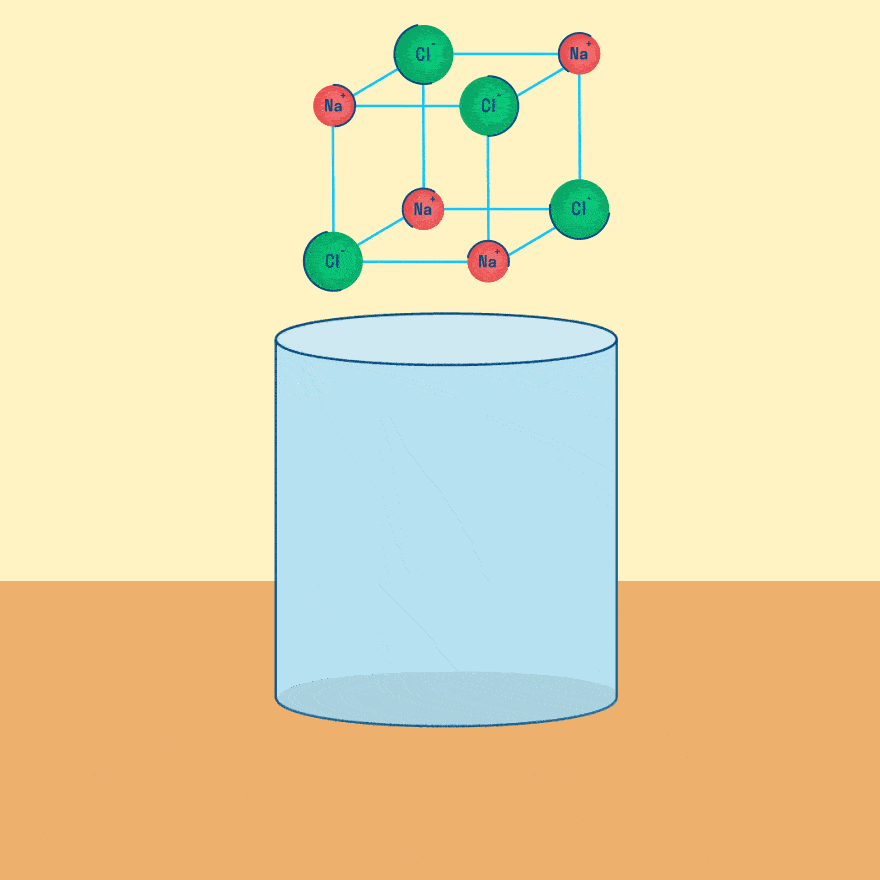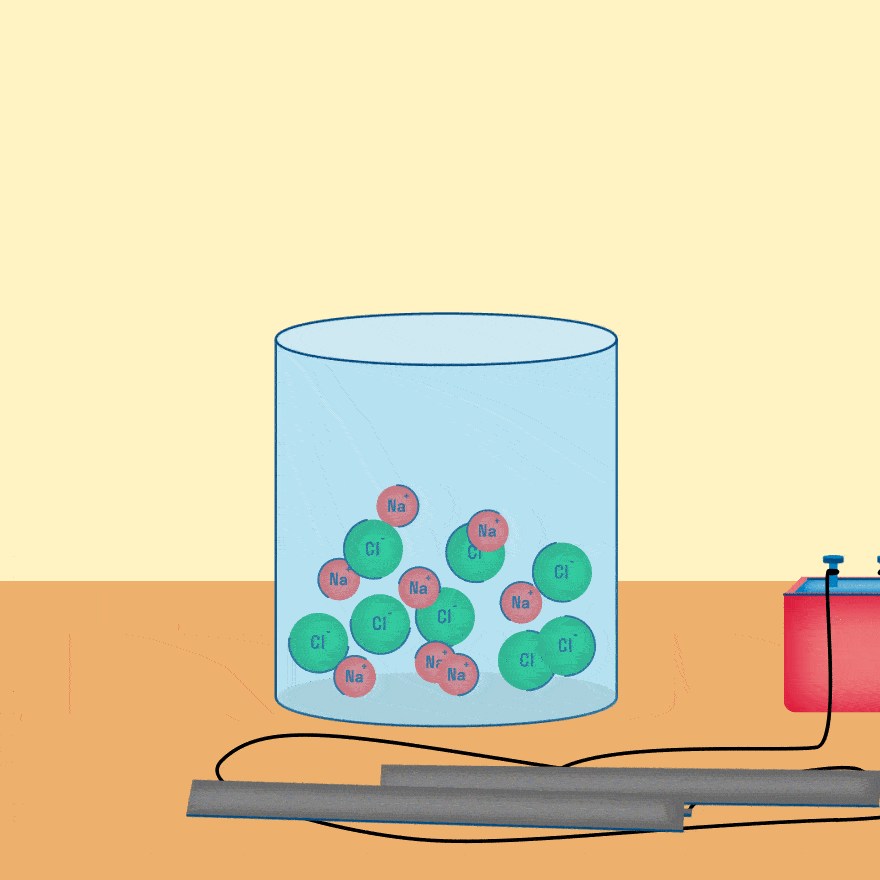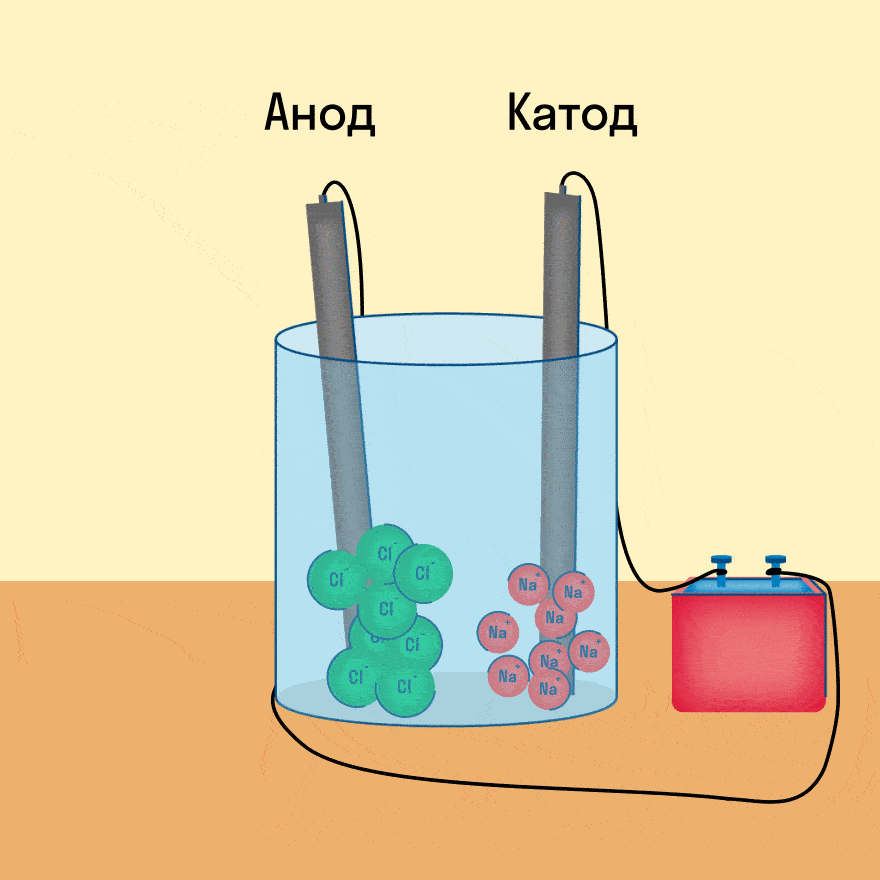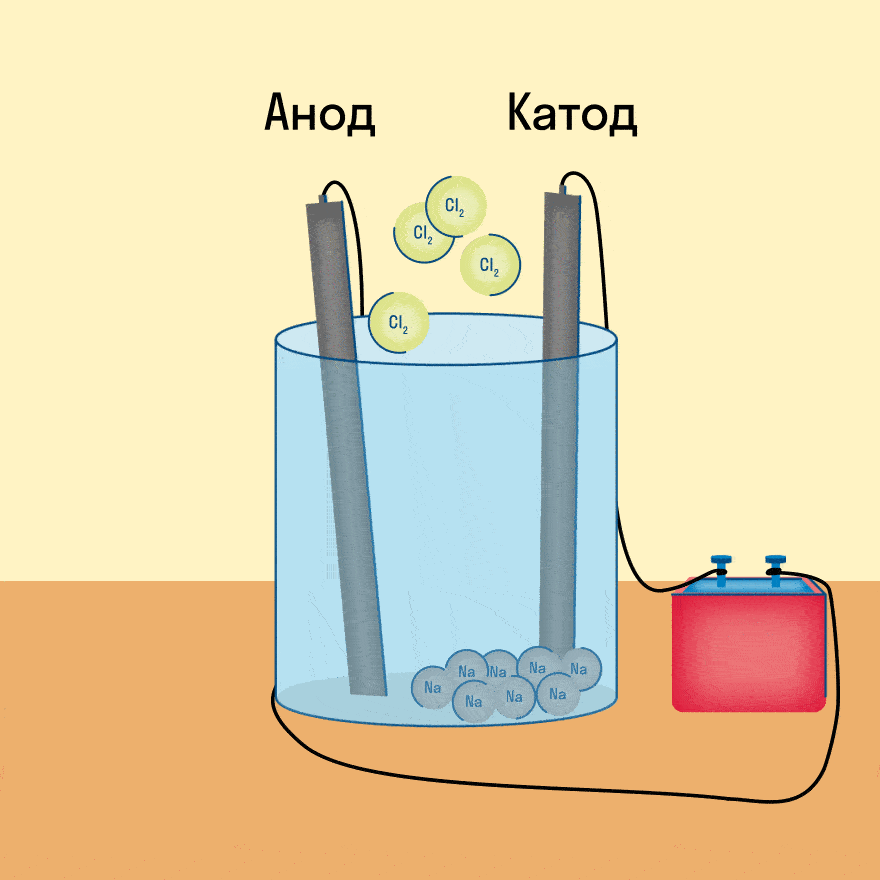
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
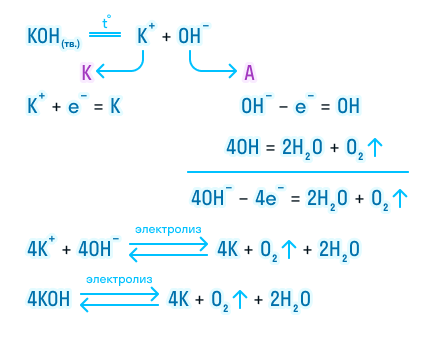
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH — как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Металл и водород.
При электролиза водного раствора фторида лития что на аноде выделится?
http://himia.my-dict.ru/q/5219349_elektroliz-rasplava-bromida-baria/
http://skysmart.ru/articles/chemistry/elektroliz-rasplavov-i-rastvorov