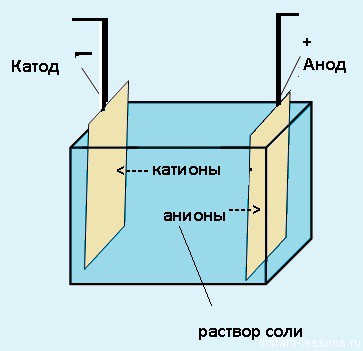
Схема электролиза водного раствора соли
Задача 590.
Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный.
Решение:
ZnCl2 ⇔ Zn 2+ + 2Cl —
Стандартный электродный потенциал системы Zn 2+ + 2 
2H2O + 2 
а ионы цинка Zn 2+ , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление цинка – материала анода, поскольку, отвечающий системе Zn 0 + 2 

Уравнения электродных процессов:
А(+): Zn 0 — 2e ⇔ Zn 2+
К(-): 2H2O + 2 
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + Zn 0 ⇔ H2↑ + 2OH- + Zn 2+
катод анод
Таким образом, при электролизе ZnCl2 с цинковым анодом на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид цинка, на аноде будет происходить растворение материала анода (цинк) и будут накапливаться ионы цинка и хлорид-ионы.
б) При электролизе ZnCl2 с угольным анодом будут происходить следующие процессы:
на катоде: 2H2O + 2 
на аноде: 2Cl — — 2 
хотя стандартные электродные потенциалы системы 2H2O — 4 

Таким образом, при электролизе раствора хлорида цинка с угольным электродом на катоде будет будет наблюдаться выделение газообразного водорода и в катодном пространстве будет выпадать осадок гидроксида цинка, а на аноде будет наблюдаться выделение газообразного хлора.
Задача 691.
Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный.
Решение:
CaSO4 ⇔ Ca 2+ + SO4 2-
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление меди – материала анода, поскольку, отвечающий системе Cu 2+ — 2 

Уравнения электродных процессов:
А(+): Cu 0 — 2e ⇔ Cu 2+
К(-): Cu 2+ + 2e ⇔ Cu 0
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu 0 + Cu 2+ = Cu 2+ + Cu 0
анод катод
Таким образом, при электролизе CuSO4 на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид меди, на аноде будет происходить растворение материала анода (медь) и будут накапливаться ионы меди и сульфат-ионы.
б) При электролизе CuSO4 с угольным анодом будут происходить следующие процессы ( стандартный электродный потенциал системы 2H2O — 4 

на катоде: 2|4|Cu 2+ + 2 
на аноде: 1|2|2H2O — 4 
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + 2Cu 2+ ⇔ О2 ↑ + 4Н + + 2Cu (ионно-молекулярная форма);
анод катод
2CuSO4 + 2H2O → 2H2SO4 + O2↑ + 2Cu ( молекулярная форма).
Таким образом, при электролизе раствора сульфата меди с угольным анодом на аноде будет наблюдаться выделение газообразного кислорода, и в анодном же пространстве будет накапливаться сульфат-ионы, которые с ионами водорода создают кислую среду, будет накапливаться серная кислота (2H + + SO4 2- = H2SO4); на катоде будет откладываться металлическая медь.
Электролиз водного раствора zncl2
Задача 590.
Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный.
Решение:
ZnCl2 ⇔ Zn 2+ + 2Cl –
Стандартный электродный потенциал системы Zn 2+ + 2 
2H2O + 2 
а ионы цинка Zn 2+ , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление цинка – материала анода, поскольку, отвечающий системе Zn 0 + 2 

Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + Zn ⇔ H2↑ + 2OH- + Zn 2+
катод анод
Таким образом, при электролизе ZnCl2 с никелевым анодом на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид цинка, на аноде будет происходить растворение материала анода (цинк) и будут накапливаться ионы цинка и хлорид-ионы.
б) При электролизе ZnCl2 с угольным анодом будут происходить следующие процессы:
на катоде: 2H2O + 2 
на аноде: 2Cl – – 2 
хотя стандартный электродный потенциал системы 2H2O – 4 

Таким образом, при электролизе раствора хлорида цинка с угольным электродом на катоде будет будет наблюдаться выделение газообразного водорода и в катодном пространстве будет выпадать осадок гидроксида цинка, а на аноде будет наблюдаться выделение газообразного хлора.
Задача 691.
Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный.
Решение:
CaSO4 ⇔ Ca 2+ + SO4 2-
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление меди – материала анода, поскольку, отвечающий системе Cu 2+ – 2 

Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu 0 + Cu 2+ = Cu 2+ + Cu 0
катод анод
Таким образом, при электролизе CuSO4 на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид меди, на аноде будет происходить растворение материала анода (медь) и будут накапливаться ионы меди и сульфат-ионы.
б) При электролизе CuSO4 с угольным анодом будут происходить следующие процессы:
так как стандартный электродный потенциал системы 2H2O – 4 

на катоде: Cu 2+ + 2 
на аноде: 2H2O – 4 
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + Cu ⇔ H2 ↑ + 2OH – + Cu
катод анод
Таким образом, при электролизе раствора сульфата меди с угольным анодом на катоде будет наблюдаться выделение газообразного водорода, и в катодном пространстве будет выпадать осадок гидроксида меди, а на аноде будет наблюдаться выделение газообразно-го кислорода и будет накапливаться серная кислота.
Тема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей.
Электролиз водных растворов солей
Для начала давайте представим себе систему, в которой происходит электролиз.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
- Анод — положительно заряженный электрод
- Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
- Неметаллы и их производны, анионы — к аноду
- Металлы и их производный, катионы — к катоду
Теперь рассмотрим электролиз водных растворов различных солей
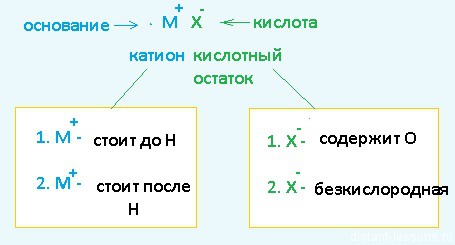
Разберем сначала катионы :
- Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2е = H2 + 2OH – Образовавшийся водород H2 идет к катоду - Если металл стоит после Н, то он сам восстанавливается:
Cu 2+ + 2е = Cu 0 Медь осаждается на катоде - Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды :
2Н2О + 2е = Н2+ 2ОН — Zn 2+ + 2e = Zn 0
Теперь анионы-кислотные остатки :
- Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H + Образовавшийся O2 выделяется на аноде - Бескислородные кислотные остатки — окисляются до простого вещества:
Cl − — 1e = Cl2 0 Хлор выделяется на аноде - Исключение: F − — вместо него будет выделяться кислород.
Примеры:
1 .1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
анод (+): Cl − — 1e = Cl 0 ; Cl 0 +Cl 0 =Cl2
2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
K(-): Cu 2+ + 2e = Cu 0
2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu 2+ + 2e = Cu 0
анод (+): 2Cl − — 2e = 2Cl 0
Электролиз водных растворов солей отличается от электролиза расплавов.
Отличие — в наличии растворителя. При электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
- ЕГЭ это вопрос Части B № 3
Элетролиз раствора Cu(NO3)2
А(+): 2 H2O – 4e —> 4 H+ + O 2 | 1 | – окисление
К(-): Сu2+ + 2e —> Cu 0 | 2 | – восстановление
2 Cu2+ + 2 H 2O –эл. ток–> 2 Cu + 4 H+ + O 2
2 Cu(NO3)2 + 2 H 2O –эл. ток–> 2 Cu + 4 HNO3 + O 2
электролиз водного раствора ZnCl2
ZnCl2 = Zn2+ + 2Cl-
H20 = H+ + OH-
К(-) Zn2+, H2O; Zn2+ +2e = Zn
А(+) Cl-, H20; 2Cl- 2e = Cl2;
ZnCl2 = Zn + Cl2
Электролиз водного раствора гидроксида калия:
К(-) 2H2O + 2e = H2 + 2OH –
А(+) 4OH- = O 2 + 2H 2 O + 4e
2H2O = O2 + 2H 2
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2ccbe7f94f1640 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://4apple.org/jelektroliz-vodnogo-rastvora-zncl2/
http://gomolog.ru/reshebniki/11-klass/gabrielyan-2019/15/6.html