Составление схем электродных процессов на электродах при электролизе солей
Электролиз водного раствора соли хлорида железа (ⅠⅠ)
Задача 152.
Составьте схему электролиза водного раствора FeCl2. Вычислите время, в течение которого должен быть пропущен ток силой I A через раствор, чтобы на катоде выделилось m (г) металла.(восстановление воды не учитывать)
Раствор FeCl2 , катод-угольный, анод-угольный. I = 4 А , m = 2.9 г
Решение:
Е(Fe 2+ /Fe) = 0,44 В;
M(FeCl2) = 126,751 г/моль
Э(FeCl2) = 63,3755 г/?моль.
В водном растворе соль FeCl2 диссоциирует по схеме: FeCl2 = Fe 2+ + 2Cl – . Стандартный электродный потенциал системы
Fe 2+ + 2электрона = Fe 0 (-0,44 В) незначительно положительнее потенциала водородного электрода в нейтральной среде (-0,41В). Поэтому на катоде будет происходить электрохимическое восстановление ионов Fe 2+ и Н2О:
Fe 2+ + 2ē = Fe 0
2Н2О + 2ē = Н2 + 2ОН –
На аноде будет происходить электролитическое окисление ионов хлора с образованием свободных атомов хлора, которые, соединяясь друг с другом, образуют молекулу хлора:
2Cl – — 2ē = 2Cl*
Cl* + Cl* = Cl2
Сложим уравнение катодного и анодного процессов, получим суммарное ионно-молекулярное уравнение:
Fe 2+ + 2Н2О + 2Cl – = 2Fe 0 + Н2↑ + 2ОН – + Cl2↑
На аноде ионы Fe 2+ соединяются с двумя ионами ОН – , образуя нерастворимый гидроксид железа (ⅠⅠ) Fe(OH)2:
Тогда молекулярная форма процесса будет иметь вид:
При гидролизе FeCl2 в водном растворе с инертными электродами образуются металлическое железо, и выделяются газообразный водород и хлор. На катоде будет выделяться металлическое железо и газообразный водород, а на аноде — хлор.
Рассчитаем время электролиза FeCl2, получим:
m = (Э . I . t)/F;
t = (m . F)/(Э . I) = (2,9 . 96500)/(63,3755 . 4) = 48250/324,96 = 1104 c.
Электролиз водного раствора нитрата кадмия
Задача 153.
Электролиз раствора нитрата кадмия с графитовыми электродами и кадмиевым анодом. Опишите электродные процессы на электродах.
Решение:
В водном растворе соль нитрата кадмия диссоциирует по схеме:
1. Электролиз раствор нитрата кадмия с графитовыми электродами
Стандартный электродный потенциал системы Cd 2+ + 2ē = Cd0 (-0,402 В) незначительно отличается от потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, поэтому на катоде протекают одновременно две реакции – образование водорода и выделение кадмия:
Уравнение электролиза будет иметь вид:
2Cd 2+ + 2Н2О = 2Cd 0 + H2↑ + O2↑ + 4Н +
Таким образом, в катодном пространстве будут разряжаться ионы кадмия и молекулы воды при этом на графитовом электроде откладываеся металлический кадмий и выделяется газообразный водород, а в анодном пространстве будет у графитового электрода будет выделяться газообразный водород и будут накапливаться ионы NO3 – и H + . Среда у анода в процессе электролиза Cd(NO3)2 становится кислой.
Суммарная реакция электролиза в молекулярной форме:
2. Электролиз раствора нитрата кадмия с кадмиевым анодом
Так как кадмиевый анод растворим в условиях электролиза соли Cd(NO3)2, то на аноде происходит окисление материала анода. Поэтому при электролизе Cd(NO3)2 с использованием кадмиевого анода на катоде будет выделяться чистый кадмий и водород, а на аноде ионы кадмия не будут разряжаться, и, следовательно, выделение кислорода не наблюдается. В данном случае происходит растворение самого кадмиевого анода, т.е. с анода кадмий в виде ионов Cd 2+ переходит в раствор.
Электродные процессы на электродах:
1|Катод(-): Cd 2+ + 2ē = Cd 0 ;
2H2O + 2ē = H2↑ + 2OH – ;
2|Анод(+): Сd 0 – 2ē = Cd 2+
Уравнение электролиза в ионно-молекулярном виде:
Сd 2+ + 2H2O + 2Cd 0 = Cd 0 + 2Cd 2+ + H2↑ + 2OH –
После приведения членов в обеих частях равенства получим:
Ионы кадмия Cd 2+ у анода будут соединяться с ионами ОН-, образуя малорастворимое основание Cd(OH)2:
Суммарная реакция электролиза в молекулярной форме:
Электролиз водного раствора соли хлорида меди (Ⅰ)
Задача 154.
Составить схему электролиза соли CuCl. Рассчитать массу меди, выделившейся при электролизе соли CuCl, если в течении 40 минут пропущен ток силой 3 А.
Решение:
Mэ(CuCl) = 98,999 г/моль;
I = 3 A;
t = 40 мин = 2400 с.
1. Электродные процессы
Медь находятся в ряду активности металлов «после водорода», значит на катоде будет протекать реакция восстановления только меди:
Стандартный электродный потенциал системы Cu + + 1ē = Cu 0 (+0,52 В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди:
Так как стандартный электродный потенциал системы 2H2O — 4ē = O2↑ + 4OH – и 2Cl – + 2ē = Cl2, соответственно, равны 1,23В и 1,36 B, то на
аноде будет: 2Cl – + 2ē = Cl2.
Схема электролиза соли CuCl с использованием графитовых электродов:
2|Катод: Cu + + 1ē = Cu 0
1|Анод: 2Cl – + 2ē = Cl2.
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu + + 2Cl – = 2Cu 0 + Cl2
катод анод
Таким образом, при электролизе водного раствора CuCl с использованием графитовых электродов на катоде выделяется металлическая медь, а на аноде — газзобразный хлор.
2. Вычисление количества полученной меди
Для вычисления массы меди используем выражение из первого закона электролиза Фарадея:
m(B) = [M(Э)•I•t]/F = M(Э)•q, где
m(B) — масса выделяемого веществав; M(Э) — электрохимический эквивалент (молярная масса эквивыалента вещества); I – сила тока; t – время; F — число Фарадея (96500 Кл/моль); q — количество электричества.
Тогда
m(CuCl) = [Mэ(CuCl)•I•t]/F = (98,999•3•2400)/96500 = 7,4 г.
Ответ: m(CuCl) = 7,4 г.
Решение химических задач
на закон Фарадея в курсе
средней школы
Среди великого множества разнообразных химических задач, как показывает практика преподавания в школе, наибольшие затруднения вызывают задачи, для решения которых помимо прочных химических знаний требуется неплохо владеть материалом курса физики. И хотя далеко не в каждой средней школе уделяется внимание решению хотя бы простейших задач с использованием знаний двух курсов – химии и физики, задачи такого типа иногда встречаются на вступительных экзаменах в вузах, где химия является профилирующей дисциплиной. А потому, не разобрав задачи такого типа на уроках, учитель может неумышленно лишить своего ученика шанса на поступление в вуз на химическую специальность.
Эта авторская разработка содержит свыше двадцати задач, так или иначе связанных с темой «Электролиз». Для решения задач данного типа необходимо не только хорошо знать тему «Электролиз» школьного курса химии, но и знать закон Фарадея, который изучается в школьном курсе физики.
Возможно, эта подборка задач не будет интересна абсолютно всем ученикам в классе или всем доступна. Тем не менее задачи данного типа рекомендуется разобрать с группой заинтересованных учащихся на кружковом или факультативном занятии. Можно с уверенностью отметить, что задачи такого типа усложненные и по крайней мере не являются типовыми для школьного курса химии (речь идет о средней общеобразовательной школе), а потому задачи данного типа можно смело включать в варианты школьной или районной химической олимпиады для 10-х или 11-х классов.
Наличие подробного решения для каждой задачи делает разработку ценным подспорьем, особенно для начинающих учителей. Разобрав несколько задач с учащимися на факультативном занятии или занятии кружка, творчески работающий учитель непременно задаст несколько однотипных задач на дом и воспользуется данной разработкой в процессе проверки домашних заданий, что позволит существенно сэкономить бесценное учительское время.
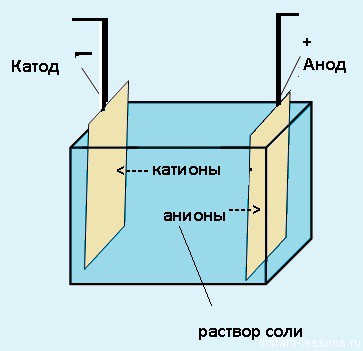
Химические реакции, протекающие под действием электрического тока на электродах, помещенных в раствор или расплав электролита, называют электролизом. Рассмотрим пример.
В стаканчике при температуре около 700 °С находится расплав хлорида натрия NaCl, в него погружены электроды. До пропускания через расплав электрического тока ионы Na + и Cl – движутся хаотически, однако при наложении электрического тока движение этих частиц становится упорядоченным: ионы Na + устремляются к отрицательно заряженному электроду, а ионы Cl – – к положительно заряженному электроду.
Ион – заряженный атом или группа атомов, обладающая зарядом.
Катион – положительно заряженный ион.
Анион – отрицательно заряженный ион.
Катод – отрицательно заряженный электрод (к нему движутся положительно заряженные ионы – катионы).
Анод – положительно заряженный электрод (к нему движутся отрицательно заряженные ионы – анионы).


или в молекулярной форме:

В электрохимическом ряду активности металлов медь расположена правее водорода, поэтому медь и будет восстанавливаться на катоде, а на аноде будет окисляться хлор.

Аналогично происходит электролиз водного раствора нитрата калия (платиновые электроды).





Концентрация CuSO4 в растворе остается постоянной, процесс сводится к переносу материала анода на катод. В этом и заключается сущность процесса электрохимического рафинирования (получение чистого металла).
При составлении схем электролиза той или иной соли нужно помнить, что:
– катионы металлов, имеющие больший стандартный электродный потенциал (СЭП), чем у водорода (от меди до золота включительно), при электролизе практически полностью восстанавливаются на катоде;
– катионы металлов с небольшими значениями СЭП (от лития до алюминия включительно) не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды до водорода;
– катионы металлов, у которых значения СЭП меньше, чем у водорода, но больше, чем у алюминия (от алюминия до водорода), при электролизе на катоде восстанавливаются одновременно с водой;
– если водный раствор содержит смесь катионов различных металлов, например Ag + , Cu 2+ , Fe 2+ , то в этой смеси первым восстановится серебро, затем медь и последним – железо;
– на нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды, причем анионы S 2– , I – , Br – , Cl – окисляются легко;
– если в растворе находятся анионы кислородсодержащих кислот 



– если анод растворим, то при электролизе он сам подвергается окислению, т. е. посылает электроны во внешнюю цепь: при отдаче электронов смещается равновесие между электродом и раствором и анод растворяется.
Если из всего ряда электродных процессов выделить только те, которые отвечают общему уравнению
то получим ряд напряжений металлов. В этот ряд всегда помещают также водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот, а какие нет (табл.).
Ряд напряжений металлов
| Уравнение электродного процесса | Стандартный электродный потенциал при 25 °С, В | Уравнение электродного процесса | Стандартный электродный потенциал при 25 °С, В |
|---|---|---|---|
| Li + + 1e = Li 0 | –3,045 | Co 2+ + 2e = Co 0 | –0,277 |
| Rb + + 1e = Rb 0 | –2,925 | Ni 2+ + 2e = Ni 0 | –0,250 |
| K + + 1e = K 0 | –2,925 | Sn 2+ + 2e = Sn 0 | –0,136 |
| Cs + + 1e = Cs 0 | –2,923 | Pb 2+ + 2e = Pb 0 | –0,126 |
| Ca 2+ + 2e = Ca 0 | –2,866 | Fe 3+ + 3e = Fe 0 | –0,036 |
| Na + + 1e = Na 0 | –2,714 | 2H + + 2e = H2 | 0 |
| Mg 2+ + 2e = Mg 0 | –2,363 | Bi 3+ + 3e = Bi 0 | 0,215 |
| Al 3+ + 3e = Al 0 | –1,662 | Cu 2+ + 2e = Cu 0 | 0,337 |
| Ti 2+ + 2e = Ti 0 | –1,628 | Cu + +1e = Cu 0 | 0,521 |
| Mn 2+ + 2e = Mn 0 | –1,180 | Hg2 2+ + 2e = 2Hg 0 | 0,788 |
| Cr 2+ + 2e = Cr 0 | –0,913 | Ag + + 1e = Ag 0 | 0,799 |
| Zn 2+ + 2e = Zn 0 | –0,763 | Hg 2+ + 2e = Hg 0 | 0,854 |
| Cr 3+ + 3e = Cr 0 | –0,744 | Pt 2+ + 2e = Pt 0 | 1,2 |
| Fe 2+ + 2e = Fe 0 | –0,440 | Au 3+ + 3e = Au 0 | 1,498 |
| Cd 2+ + 2e = Cd 0 | –0,403 | Au + + 1e = Au 0 | 1,691 |
В более простом виде ряд напряжений металлов можно представить так:
Для решения большинства задач на электролиз требуется знание закона Фарадея, формульное выражение которого приведено ниже:
где m – масса выделившегося на электроде вещества, F – число Фарадея, равное 96 485 А•с/моль, или 26,8 А•ч/моль , М – молярная масса элемента, восстанавливающегося в процессе электролиза, t – время проведения процесса электролиза (в секундах), I – сила тока (в амперах), z – число электронов, участвующих в процессе.
1. Какая масса никеля выделится в процессе электролиза раствора нитрата никеля в течение 1 ч при силе тока 20 А?
2. При какой силе тока необходимо проводить процесс электролиза раствора нитрата серебра, чтобы в течение 10 ч получить 0,005 кг чистого металла?
3. Какая масса меди выделится при электролизе расплава хлорида меди(II) в течение 2 ч при силе тока 50 А?
4. В течение какого времени нужно проводить процесс электролиза водного раствора сульфата цинка при силе тока 120 А, чтобы при этом получить 3,5 г цинка?
5. Какая масса железа выделится в процессе электролиза раствора сульфата железа(III) при силе тока 200 А в течение 2 ч?
6. При какой силе тока необходимо проводить процесс электролиза раствора нитрата меди(II), чтобы в течение 15 ч получить 200 г чистого металла?
7. В течение какого времени необходимо проводить процесс электролиза расплава хлорида железа(II) при силе тока 30 А, чтобы при этом получить 20 г чистого железа?
8. При какой силе тока необходимо проводить процесс электролиза раствора нитрата ртути(II), чтобы в течение 1,5 ч получить 0,5 кг чистого металла?
9. При какой силе тока необходимо проводить процесс электролиза расплава хлорида натрия, чтобы в течение 1,5 ч получить 100 г чистого металла?
10. Расплав хлорида калия подвергли электролизу в течение 2 ч при силе тока 5 А. Полученный металл прореагировал с водой массой 2 кг. Какой концентрации раствор щелочи получился при этом?
11. Сколько граммов 30%-го раствора соляной кислоты потребуется для полного взаимодействия с железом, полученным при электролизе раствора сульфата железа(III) в течение 0,5 ч при силе тока
10 А?
12. В процессе электролиза расплава хлорида алюминия, проводимого в течение 245 мин при силе тока 15 А, получили чистый алюминий. Сколько граммов железа можно получить алюминотермическим методом при взаимодействии данной массы алюминия с оксидом железа(III)?
13. Сколько миллилитров 12%-го раствора КОН плотностью 1,111 г/мл потребуется для взаимодействия с алюминием (с образованием тетрагидроксиалюмината калия), полученным электролизом раствора сульфата алюминия в течение 300 мин при силе тока 25 А?
14. Сколько миллилитров 20%-го раствора серной кислоты плотностью 1,139 г/мл потребуется для взаимодействия с цинком, полученным электролизом раствора сульфата цинка в течение 100 мин при силе тока 55 А?
15. Какой объем оксида азота(IV) (н.у.) получится при взаимодействии избытка горячей концентрированной азотной кислоты с хромом, полученным электролизом раствора сульфата хрома(III) в течение 100 мин при силе тока 75 А?
16. Какой объем оксида азота(II) (н.у.) получится при взаимодействии избытка раствора азотной кислоты с медью, полученной электролизом расплава хлорида меди(II) в течение 50 мин при силе тока 10,5 А?
17. В течение какого времени необходимо проводить электролиз расплава хлорида железа(II) при силе тока 30 А, чтобы получить железо, необходимое для полного взаимодействия со 100 г 30%-го раствора соляной кислоты?
18. В течение какого времени необходимо проводить электролиз раствора нитрата никеля при силе тока 15 А, чтобы получить никель, необходимый для полного взаимодействия с 200 г 35%-го раствора серной кислоты при нагревании?
19. Расплав хлорида натрия подвергли электролизу при силе тока 20 А в течение 30 мин, а расплав хлорида калия подвергли электролизу в течение 80 мин при силе тока 18 А. Оба металла растворили в 1 кг воды. Найдите концентрацию щелочей в полученном растворе.
20. Магний, полученный электролизом расплава хлорида магния в течение 200 мин при силе тока
10 А, растворили в 1,5 л 25%-го раствора серной кислоты плотностью 1,178 г/мл. Найдите концентрацию сульфата магния в полученном растворе.
21. Цинк, полученный электролизом раствора сульфата цинка в течение 100 мин при силе тока
17 А, растворили в 1 л 10%-го раствора серной кислоты плотностью 1,066 г/мл. Найдите концентрацию сульфата цинка в полученном растворе.
22. Железо, полученное электролизом расплава хлорида железа(III) в течение 70 мин при силе тока 11 А, превратили в порошок и погрузили в 300 г 18%-го раствора сульфата меди(II). Найдите массу меди, выпавшей в осадок.
23. Магний, полученный электролизом расплава хлорида магния в течение 90 мин при силе тока
17 А, погрузили в раствор соляной кислоты, взятый в избытке. Найдите объем и количество выделившегося водорода (н.у.).
24. Раствор сульфата алюминия подвергли электролизу в течение 1 ч при силе тока 20 А. Сколько граммов 15%-го раствора соляной кислоты потребуется для полного взаимодействия с полученным алюминием?
25. Сколько литров кислорода и воздуха (н.у.) потребуется для полного сжигания магния, полученного электролизом расплава хлорида магния в течение 35 мин при силе тока 22 А?
Ответы и решения см. в следующих номерах
Химия, Биология, подготовка к ГИА и ЕГЭ
Электролиз водных растворов солей
Тема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей.
Электролиз водных растворов солей
Для начала давайте представим себе систему, в которой происходит электролиз.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
- Анод — положительно заряженный электрод
- Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
- Неметаллы и их производны, анионы — к аноду
- Металлы и их производный, катионы — к катоду
Теперь рассмотрим электролиз водных растворов различных солей
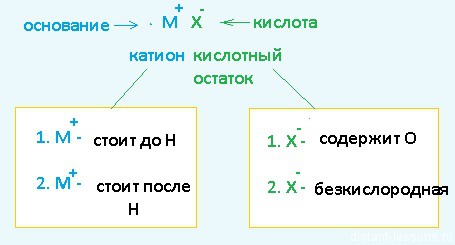
Разберем сначала катионы :
- Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2е = H2 + 2OH – Образовавшийся водород H2 идет к катоду - Если металл стоит после Н, то он сам восстанавливается:
Cu 2+ + 2е = Cu 0 Медь осаждается на катоде - Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды :
2Н2О + 2е = Н2+ 2ОН — Zn 2+ + 2e = Zn 0
Теперь анионы-кислотные остатки :
- Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H + Образовавшийся O2 выделяется на аноде - Бескислородные кислотные остатки — окисляются до простого вещества:
Cl − — 1e = Cl2 0 Хлор выделяется на аноде - Исключение: F − — вместо него будет выделяться кислород.
Примеры:
1 .1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
анод (+): Cl − — 1e = Cl 0 ; Cl 0 +Cl 0 =Cl2
2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
K(-): Cu 2+ + 2e = Cu 0
2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu 2+ + 2e = Cu 0
анод (+): 2Cl − — 2e = 2Cl 0
Электролиз водных растворов солей отличается от электролиза расплавов.
Отличие — в наличии растворителя. При электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
- ЕГЭ это вопрос Части B № 3
Обсуждение: «Электролиз водных растворов солей»
Здравствуйте. Очень благодарна вам за такое понятное объяснение темы.
У меня к Вам вопрос. В одном из заданий В3, где нужно было определить продукт на катоде, я столкнулась с такой проблемой. В одной из формул веществ был написан AlCl3. Продуктом на катоде я написала водород. Но в ответ к заданию был алюминий. Скажите в чём моя ошибка или это ошибка в тесте?
Водород — правильный ответ. В ответах к тренировочным тестам ЕГЭ очень часто бывают ошибки. Да и не только в ответах. В этом году, например, в заданиях пробных ЕГЭ быди ошибки!
1. Запишите все возможные процессы на аноде, установите потенциалы процессов.
2. Сравните потенциалы анодных процессов и определите, какой из них протекает в первую очередь?
3. Выясните, меняется ли среда около анода, если да, то как и почему?
4. Запишите все возможные процессы на катоде, установите потенциалы процессов.
5. Сравните потенциалы катодных процессов и определите, какой из них протекает в первую очередь.
6. Установите, меняется ли среда около катода, если да, то как и почему?
7. Запишите итоговую схему процесса электролиза.
0,1 M раствор CuSO4
pH = 5, катод – Al, анод – Сu
здесь решают задачи школьного уровня. Не сможем вам помочь
http://him.1sept.ru/article.php?ID=200500513
http://distant-lessons.ru/ximiya/elektroliz