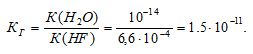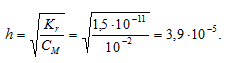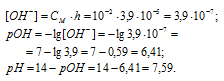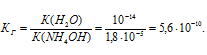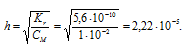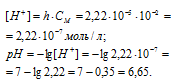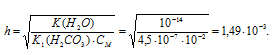Вычисление константы гидролиза, определение степени гидролиза соли
Задача 588.
Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(HF) = 6,6 . 10 -4 .
KF — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Константа гидролиза соли определяется константой диссоциации образовавшейся кислоты HF и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Ответ: КГ = 1,5 . 10 -11 ; h = 3,9 . 10 -5 ; pH = 7,59.
Задача 589.
Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и рН раствора.
Решение:
K(NH4OH) = 1,8 . 10-5.
NH4Cl — соль слабого основания и сильной кислоты гидролизуется по катиону:
Константа гидролиза соли определяется константой диссоциации образовавшегося основания NH4OH и определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов H + :
Ответ: КГ = 5,6 . 10 -10 ; h = 2,4 . 10 -4 ; pH = 6,65.
Задача 590.
Определить рН 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
Решение:
K1(H2CO3) = 4,5 . 10 -7 .
Na2CO3 — соль сильного основания и слабой кислоты, поэтому гидролиз соли проходит по аниону:
Здесь h — степень гидролиза соли, показывает долю гидролизованных ионов.
Теперь рассчитаем концентрацию образовавшихся ионов OH — :
Общая химия
Гидролиз солей
В общем случае гидролиз – это реакция обменного разложения вещества водой. Гидролизу подвержены соединения различных классов.
Гидролиз солей – процесс взаимодействия ионов, образовавшихся при диссоциации соли, с молекулами воды, сопровождающийся образованием слабых электролитов и изменением рН среды.
В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются
Растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию. Например при растворении в воде цианида калия он полностью диссоциирует (все соли сильные электролиты):
Образующиеся в результате диссоциации ионы калия соответствуют сильному электролиту КОН, а цианид-ионы — слабой циановодородной кислоте HCN. Ионы водорода, образовавшиеся в результате диссоциации молекул воды, связываются цианид-ионами в молекулы HCN, в результате в растворе накапливаются ионы гидроксила:
Обычно эти два процесса при записи объединяют, получая сокращенное ионное уравнение гидролиза:
рН этого раствора больше 7. Такой гидролиз называется гидролизом по аниону. Для него можно записать полное ионное:
K + + CN — + H2O =K + + HCN + OH —
и молекулярное уравнение:
Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию. Аналогично предыдущему примеру гидролиз хлорида аммония NH4Cl:
Диссоциация при растворении соли:
Слабому основанию — аммиаку — соответствует ион аммония NH4 + , он и будет взаимодействовать с молекулами воды образуя слабый электролит:
В растворе накапливаются ионы водорода, среда кислая, рН раствора меньше 7. Такой гидролиз называется гидролизом по катиону. Полное ионное уравнение:
Особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. В этом случае происходит гидролиз по катиону и аниону. Пример — гидролиз сульфида аммония. Соль при растворении в воде диссоциирует:
Оба иона, образовавшиеся при диссоциации, соответствуют слабым элетролитам, поэтому протекает гидролиз по катиону:
Ионы водорода и гидроксила дают молекулы воды — среда не может быть одновременно кислотй и щелочной:
однако среда не будет нейтральной. Реакция среды будет определяться соотношением констант диссоциации кислоты и основания. Если больше константа диссоциации основания (основание сильнее кислоты), среда будет щелочной, если больше константа диссоциации кислоты (кислота сильнее основаниия) — кислой. В приведенном примере аммиак — более сильный электролит по сравнению с сероводородной кислотой, поэтому среда будет слабощелочной, рН > 7.
В редких случаях, когда константы диссоциации кислоты и основания практически одинаковы, например, при гидролизе ацетата аммония CH3COONH4, среда будет почти нейтральная.
Если соль образована многокислотным основанием или многоосновной кислотой, гидролиз протекает ступенчато. Пример — гидролиз хлорида железа(III). Диссоциация соли при растворении:
Ион Fe 3+ соответствует слабому трехкислотному основанию Fe(OH)3, он и подвергается ступенчатому гидролизу. I-я ступень:
Гидролиз по первой ступени всегда протекает в значительно большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в рассмотренном примере — ионы H + ), способствуют смещению равновесия второйступени влево, т. е. также подавляют гидролиз по второй ступени. Поэтому в обычных условиях (комнатная температура, атмосферное давление) гидролизом по второй и последующим ступеням можно пренебречь.
Следующий пример — гидролиз карбоната натрия Na3CO3. Диссоциация:
Ион соответствует слабой двухосновной угольной кислоте, именно он и подвергается гидролизу. I-я ступень:
И опять в обычных условиях существенна только первая ступень гидролиза.
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22,23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5/2004
§ 7.3. Соли. Гидролиз
Взаимодействие ионов солей с водой – явление, широко распространенное в природе и играющее огромную роль как в технологии, так и в быту. От чего зависит рН океанских и речных вод, крови человека, газированной воды? Почему пекарные добавки поднимают тесто? Много других ответов поможет вам найти чтение этого раздела.
Водные растворы солей в зависимости от природы образующих их кислот и оснований могут быть кислотными, щелочными и нейтральными. Так, растворы хлорида аммония, хлорида железа или сульфата алюминия имеют кислотную среду. Растворы ацетата натрия, карбоната натрия (сода), ацетата кальция имеют основную (щелочную) реакцию. А растворы ацетата аммония, хлорида натрия (поваренная соль), сульфата натрия почти нейтральные. Почему? Кислотность раствора хлорида железа настолько велика, что в этом растворе цинк «растворяется» с выделением водорода, как в растворе соляной кислоты.
Кислотность или основность водных растворов солей объясняется протеканием в них реакций гидролиза. В широком понимании гидролиз – это любое взаимодействие вещества с водой. Сейчас мы будем изучать гидролиз как реакцию иона соли с водой.
Гидролиз – процесс, обратный нейтрализации (реакция между кислотой и основанием с выделением воды), а константа гидролиза записывается выражением, обратным выражению константы равновесия нейтрализации.
Большинство солей – сильные электролиты и находятся в водном растворе в виде ионов, поэтому уравнения реакции гидролиза следует записывать сокращенным молекульно-ионным способом, как реакцию между ионом и молекулами воды.
Характер протекания гидролиза, т. е. природа образующихся продуктов реакции, и среда получающегося раствора зависят от сочетания силы кислоты и силы основания, образующих соль. Возможны четыре варианта взаимодействия ионов соли в зависимости от ее природы.
1. Соль образована сильной кислотой и слабым основанием, например хлорид железа FeCl3, хлорид аммония NH4Cl, хлорид цинка ZnCl2, сульфат меди CuSO4.
Когда вас попросят написать уравнение реакции гидролиза соли (правильнее – гидролиз иона), обязательно напишите уравнение диссоциации соли на ионы. Например, обсудим гидролиз хлорида железа FeCl3. Уравнение диссоциации:
Далее следует (в уме) посмотреть, какой из ионов может реагировать с молекулой воды, помня, что молекула воды состоит из иона водорода Н + и гидроксид-иона ОН – . Возможна ли реакция иона железа с ионом водорода и хлорид-иона с гидроксид-ионом? Конечно, нет – ведь эти пары ионов имеют одинаковые заряды!
Возможна ли реакция между хлорид-ионом и молекулой воды (ее ионом водорода)? Реакция невозможна, т. к. образовалась бы молекула хлороводорода, которая в водном растворе является сильным электролитом и находится в состоянии исходных ионов.
Остается единственная возможность – реакция между ионом железа Fe 3+ и молекулой воды (ее гидроксид-ионом) с образованием слабого электролита – гидроксо-иона железа FeОН 2+ :
Fe 3+ + Н2О = FeОН 2+ + Н + .
Образующиеся ионы водорода обусловливают кислотную среду раствора (рН 2+ реагирует по второй ступени с еще одной молекулой воды:
Наконец, реакция проходит и по третьей ступени:
В водном растворе гидролиз по третьей ступени не проходит – из раствора хлорида железа не выпадает осадок гидроксида железа(III) Fe(ОН)3 из-за накопления ионов водорода Н + по первым двум ступеням, что смещает равновесие третьей ступени реакции гидролиза влево.
Чтобы реакция гидролиза прошла по третьей ступени, следует равновесие третьей ступени сместить вправо. Это можно сделать удалением ионов водорода Н + из сферы реакции, для чего достаточно ввести гидроксид-ионы приливанием раствора гидроксида натрия, что приводит к образованию слабого электролита – воды Н2О:
Таким образом, известная вам реакция образования осадка гидроксида железа(III) по реакции между хлоридом железа и гидроксидом натрия в водном растворе, обычно записываемая в других школьных учебниках уравнением
есть реакция гидролиза, смещенная вправо гидроксид-ионами. В тех же учебниках эта реакция называется реакцией обмена, что правильно только в том случае, если она проходит в кристаллическом состоянии (или в особых условиях в газовой фазе). В водном растворе нет хлорида железа, гидроксида натрия и хлорида натрия, а есть только составляющие их ионы.
Следовательно, реакцию гидролиза иона железа можно представить тремя уравнениями:
Fe 3+ + Н2О = FeОН 2+ + Н + ,
Реакцию гидролиза хлорида аммония NH4Cl, точнее иона аммония, записывают одним уравнением:

Образующийся ион водорода обусловливает кислотную среду раствора, т. е. рН + ]. Концентрацию иона аммония можно считать равной концентрации его соли, т. е. [
Тогда Кгидр = 

Второе преобразование. Умножим числитель и знаменатель на концентрацию того из ионов [Н + ] или [ОН — ], который с имеющейся в числителе концентрацией другого иона дает ионное произведение воды Кв. В данном случае умножим числитель и знаменатель на концентрацию гидроксид-ионов и получим новое выражение константы гидролиза:
Кгидр = 

Выражение 
NH4ОН = 
Косн =
Учитывая это, получаем новое выражение константы гидролиза:
Кгидр =
Это выражение показывает, что чем меньше константа диссоциации основания (или кислоты), тем больше константа гидролиза, тем сильнее смещено равновесие реакции гидролиза вправо и тем выше кислотность (основность) раствора, т. е. меньше (больше) значение рН.
Объединяем результаты двух преобразований выражения константы гидролиза:

Откуда [Н + ] = 
Пример. Рассчитать рН 0,01М раствора хлорида аммония. Константа диссоциации гидроксида аммония равна Косн = 1,79•10 -5 .
Воспользуемся приведенной выше формулой:
[Н + ] = 

pН = 5,6 (среда раствора кислотная).
Какой должна быть концентрация соляной кислоты, чтобы ее раствор имел такое же значение рН? Можно дать приближенный ответ.
http://www.chem03.ru/index.php/data/index.php?id=33
http://him.1sept.ru/article.php?ID=200400702