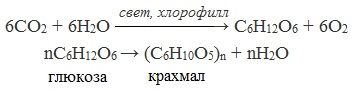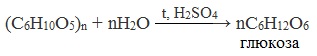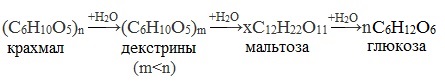Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e22b42e7bdf0bc1 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Напишите уравнение гидролиза крахмала?
Химия | 10 — 11 классы
Напишите уравнение гидролиза крахмала.
Укажите условия протекания реакции и дайте названия продуктам.
Допишите краткие ионные уравнения реакций гидролиза солей :
Составьте молекулярные уравнения, укажите среду раствора.
(C6H10O5)n + nH2O — > ; nC6H12O6 — глюкоза * * *
Если более узко рассматривать продукты гидролиза крахмала, то вот они :
(C6H10O5)n — > ; (вода, кислоты) — > ; растворимый крахмал — > ; (C6H10O5)x — декстрины — > ; n / 2C12H22O12 — мальтоза — > ; nC6H12O6 — глюкоза * * *
Гидролиз по катиону Железа 3 + , — слабое основание, сильная кислота, к примеру хлороводород.
Fe3 + + H( + )OH( — ) — > ; Fe(OH)2( + ) + H + < ; — — — — катион водорода, среда кислая FeCl3 + 2HOH — > ; Fe(OH)2Cl + 2HCl
Fe(OH)2(2 + ) + H( + )OH( — ) = Fe(OH)3 + H( + ) < ; — — — — катион водорода, среда кислая Fe(OH)2Cl + HOH = Fe(OH)3 + HCl
Гидролиз по силикат — аниону SiO3(2 — ) — слабая кислота, сильное основание, возьмем например силикат натрия Na2SiO3
SiO3(2 — ) + H( + )OH( — ) = HSiO3( — ) + OH( — ) < ; — — — — гидроксид — ионы, щелочная Na2SiO3 + HOH = NaHSiO3 + NaOH
HSiO3( — ) + H2O = H2SiO3(осад.
) + OH( — ) < ; — — — гидроксид — ионы, среда щелочная NaHSiO3 + H2O = H2SiO3 + NaOH.
Напишите уравнение гидролиза соли хлорида хрома в молекулярной, ионной и сокращенной форме?
Напишите уравнение гидролиза соли хлорида хрома в молекулярной, ионной и сокращенной форме.
Укажите реакцию среды в растворе соли.
Какие из следующих солей подвергаются гидролизу?
Какие из следующих солей подвергаются гидролизу.
Записать молекулярное, ионное и сокращённое ионное уравнение реакции гидролиза.
Указать реакцию среды растворов соли.
Назвать все продукты реакции.
Ужасно срочно?
Составить уравнения гидролиза солей в молекулярном и ионном виде.
Назовите продукты гидролиза.
Укажите реакцию среды в растворе рассматриваемой соли : хлорид магния.
Срочно с подробным объяснением.
Составьте уравнение гидролиза солей в молекулярном и ионном виде?
Составьте уравнение гидролиза солей в молекулярном и ионном виде.
Назовите продукты гидролиза.
Укажите реакцию среды в растворе дигидрофосфата калия.
Укажите, какие из перечисленных солей подвергаются гидролизу : NaCl KNO3 CuCl2?
Укажите, какие из перечисленных солей подвергаются гидролизу : NaCl KNO3 CuCl2.
Для каждой из гидролизующихся солей напишите в молекулярной и ионной форме уравнения гидролиза по каждой ступени, укажите реакцию водного раствора соли.
Составьте ионное уравнение гидролиза соли Составьте ионное уравнение гидролиза соли K2CrO4?
Составьте ионное уравнение гидролиза соли Составьте ионное уравнение гидролиза соли K2CrO4.
Укажите реакцию среды?
Укажите реакцию среды растворов Na3PO4 и ZnSO4?
Укажите реакцию среды растворов Na3PO4 и ZnSO4.
Ответ подтвердите молекулярными и ионно — молекулярными уравнениями реакций.
Назовите продукты гидролиза данных солей по 1 — ой ступени.
Составьте молекулярное полное и сокращенное ионное уравнение реакции гидролиза?
Составьте молекулярное полное и сокращенное ионное уравнение реакции гидролиза.
Укажите среду каждого раствора и тип гидролиза.
Для K2SO3 NH4CL BaCL2.
Запишите в молекулярном и ионном виде уравнения реакций гидролиза солей AlCl3 и KCN?
Запишите в молекулярном и ионном виде уравнения реакций гидролиза солей AlCl3 и KCN.
Укажите среду в растворах этих солей.
Напишите молекулярное и ионное уравнение гидролиза, укажите среду водного раствора соли CuSO4 : CuSO4 + H2O =?
Напишите молекулярное и ионное уравнение гидролиза, укажите среду водного раствора соли CuSO4 : CuSO4 + H2O =.
На этой странице сайта размещен вопрос Напишите уравнение гидролиза крахмала? из категории Химия с правильным ответом на него. Уровень сложности вопроса соответствует знаниям учеников 10 — 11 классов. Здесь же находятся ответы по заданному поиску, которые вы найдете с помощью автоматической системы. Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по заданной теме. На этой странице можно обсудить все варианты ответов с другими пользователями сайта и получить от них наиболее полную подсказку.
Напишите уравнение гидролиза крахмала укажите условия
Крахмал – ценный питательный продукт. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Химическая формула крахмала (С6(Н2О)5) n .
Строение крахмала
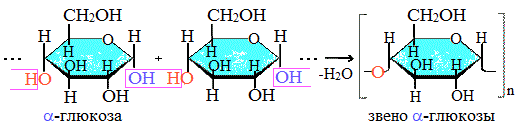
Крахмал состоит из 2 полисахаридов, построенных из остатков циклической a-глюкозы.
Как видно, соединение молекул глюкозы происходит с участием наиболее реакционноспособных гидроксильных групп, а исчезновение последних исключает возможность образования альдегидных групп, и они в молекуле крахмала отсутствуют. Поэтому крахмал не дает реакцию «серебряного зеркала».
Крахмал состоит не только из линейных молекул, но и из молекул разветвленной структуры. Этим объясняется зернистое строение крахмала.
В состав крахмала входят:
- амилоза (внутренняя часть крахмального зерна) — 10-20%;
- амилопектин (оболочка крахмального зерна) — 80-90%.
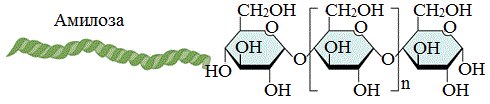
Амилоза
Амилоза растворима в воде и представляет собой линейный полимер, в котором остатки α–глюкозы связаны друг с другом через первый и четвертый атомы углерода (α-1,4-гликозидными связями).
Цепь амилозы включает 200 — 1000 остатков a-глюкозы (средняя мол. масса 160 000) .
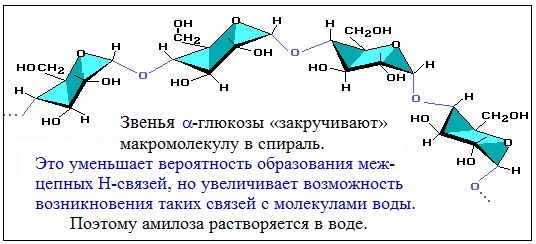
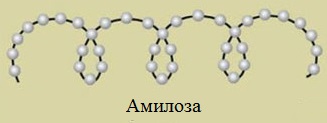
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев a-глюкозы.
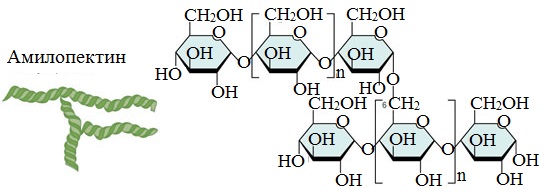
Амилопектин
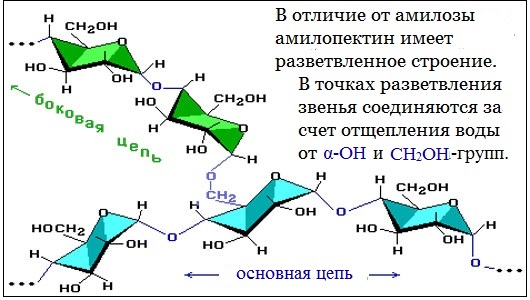
В отличие от амилозы, амилопектин не растворим в воде, и имеет разветвленное строение.
Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе α-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются α-1,6-гликозидные связи.
Молекулярная масса амилопектина достигает 1-6 млн.
Молекулы амилопектина также довольно компактны, так как имеют сферическую форму.
Биологическая роль крахмала. Гликоген
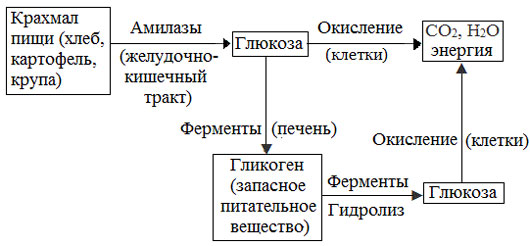
Крахмал – главное запасное питательное вещество растений, основной источник резервной энергии в растительных клетках.
Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии.
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах.
Гликоген (животный крахмал) – полисахарид, молекулы которого построены из большого числа остатков α–глюкозы. Он имеет сходное строение с амилопектином, но отличается от него большей разветвленностью цепей, а также большей молекулярной массой.
Содержится гликоген главным образом в печени и в мышцах.
Гликоген – белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе – глюкозу.
Превращение крахмала в организме человека и животных
Нахождение в природе
Крахмал широко распространен в природе. Он образуется в растениях в процессе фотосинтезе и накапливается в клубнях, корнях, семенах, а также в листьях и стеблях.
Крахмал содержится в растениях в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 80%), пшеницы (до 70%), кукурузы (до 72%), а также клубни картофеля (до 25%). В клубнях картофеля крахмальные зерна плавают в клеточном соке, в злаках они плотно склеены белковым веществом клейковиной.
Физические свойства
Крахмал – белое аморфное вещество, без вкуса и запаха, нерастворимое в холодной воде, в горячей воде набухает и частично растворяется, образуя вязкий коллоидный раствор (крахмальный клейстер).
Крахмал существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
Химические свойства крахмала
Химические свойства крахмала объясняются его строением.
Крахмал не дает реакцию «серебряного зеркала», однако ее дают продукты его гидролиза.
1. Гидролиз крахмала
При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками α-глюкозы. При этом образуется ряд промежуточных продуктов, в частности мальтоза. Конечным продуктом гидролиза является глюкоза:
Процесс гидролиза протекает ступенчато, схематически его можно изобразить так:
Видеоопыт «Кислотный гидролиз крахмала»
Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К.Кирхгоф (реакция Кирхгофа).
2. Качественная реакция на крахмал
Так как молекула амилозы представляет собой спираль, то при взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения.
Раствор иода окрашивает крахмал в синий цвет. При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь.
Крахмал + J2 – синее окрашивание
Видеоопыт «Реакция крахмала с йодом»
Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба)
3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2,3,6-го атомов углерода), в точках разветвления – у 2-го и 3-го атомов углерода.
Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют.
Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде.
Получение крахмала
Из растений извлекают крахмал, разрушая клетки и отмывая его водой. В промышленном масштабе его получают главным образом из клубней картофеля (в виде картофельной муки), а также кукурузы, в меньшей степени – из риса, пшеницы и других растений.
Получение крахмала из картофеля
Картофель моют, измельчают и промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Вода извлекает из измельченного сырья крахмальные зерна, образуя так называемое «крахмальное молоко».
Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Получение крахмала из кукурузы
Зерна кукурузы замачивают в теплой воде разбавленной сернистой кислоты с целью размягчения зерна и удаления из него основной части растворимых веществ.
Набухшее зерно дробят для удаления ростков.
Ростки, после всплывания на поверхность воды, отделяют и используют в дальнейшем для получения кукурузного масла.
Кукурузную массу повторно измельчают, обрабатывают водой для вымывания крахмала, затем отделяют отстаиванием или с помощью центрифуги.
Применение крахмала
Крахмал широко применяется в различных отраслях промышленности (пищевой, фармацевтической, текстильной, бумажной и т.п.).
Он является основным углеводом пищи человека – хлеба, круп, картофеля.
В значительных количествах перерабатывается на декстрины, патоку и глюкозу, используемые в кондитерском производстве.
Из крахмала, содержащегося в картофеле и зерне злаков, получают этиловый, н-бутиловый спирты, ацетон, лимонную кислоту, глицерин.
Крахмал используется как клеящее средство, применяется для отделки тканей, крахмаления белья.
В медицине на основе крахмала готовятся мази, присыпки и т.д.
http://himia.my-dict.ru/q/73591_napisite-uravnenie-gidroliza-krahmala/
http://himija-online.ru/organicheskaya-ximiya/uglevody/kraxmal.html