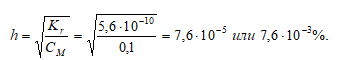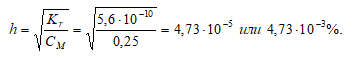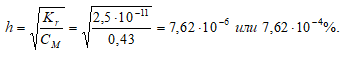Напишите уравнение гидролиза натрия ацетата укажите рн

Уксусная кислота – слабый электролит. Ацетат натрия – соль образованная сильным основанием и слабой кислотой. При растворении этой соли в воде создается щелочная среда. Особенностью кристаллогидрата ацетата натрия является то, что он при нагревании легко плавится и ацетат натрия растворяется в своей кристаллизационной воде. Смешает ацетат натрия с сухим индикатором фенолфталеином. Полученную смесь нагреем. Появляется малиновая окраска. Соль частично расплавилась, в расплаве появились гидроксид- ионы.
При охлаждении соль кристаллизуется, равновесие смещается в сторону образования ацетата натрия, гидроксид-илны исчезают, и окраска пропадает. Опыт доказывает, что уксусная кислота является слабой кислотой.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Вычисление константы гидролиза, степени гидролиза и рН раствора соли, образованной
Гидролиз соли ацетата натрия
Задача 87.
В растворе объёмом 0,5 дм 3 содержится СН3СООNа массой 4,10 г. Вычислите рН и степень гидролиза (h) соли.
Решение:
V(p-pa) = 0,5 дм 3 = 500 см 3 ;
KD(CH3COOH) = 1,78 · 10 –5 ;
m(СН3СООNа) = 4,10 г;
М(СН3СООNa) = 82,00 г/моль;
pH = ?
h = ?
1. Рассчитаем молярность раствора соли СН3СООNа
СМ(СН3СООNa) = [m(СН3СООNa) · 1000/500]/М(СН3СООNa) = [4,10 · 1000/500]/82,00 = 8,2/82,00 = 0,1 M.
2. Расчет константы гидролиза соли
СН3СООNа — соль сильного основания и слабой кислоты, поэтому гидролиз проходит по аниону:
СН3СОО– + H2O = СН3СООH + OH–
Константа гидролиза определяется константой диссоциации образовавшейся кислоты СН3СООH и определяется по формуле:
Kr = KD(H2O)/KD(СН3СООH) = (1 · 10 -14 )/(1,78 · 10 –5 ) = 5,6 · 10 -10 .
3. Определение степени гидролиза соли
Степень гидролиза определяется по формуле:
4. Расчет рН раствора соли образованной сильным основанием и слабой кислотой
Так как гидролиз соли СН3СООNа протекает с выделением ОН – — ионов, то рассчитаем [OH – ]:
[OH – ] = h · CM = (7,6 · 10 –5 )·(0,1) = 7,6 · 10 –6 моль/дм 3 ;
рОН = -lg[OH – ] = -lg7,6 · 10 –6 = 6 — 0,88 = 5,12;
pH = 14 — pOH = 14 — 5,12 = 8,88.
Ответ: рН = 8,88; h = 7,6 · 10 –3 %.
Задача 88.
В 200 см 3 раствора содержится СН3СООNа массой 4,10 г. Вычислите рН и степень гидролиза соли.
Решение:
V(p-pa) = 200 см 3 ;
KD(CH 3 COOH) = 1,78 · 10 –5 ;
m(СН3СООNа) = 4,10 г;
М(СН3СООNa) = 82,00 г/моль;
pH = ?
h = ?
1. Рассчитаем молярность раствор соли
СМ(СН3СООNa) = [m(СН3СООNa) · 1000/500]/М(СН3СООNa) = [4,10 · 1000/200]/82,00 = 20,5/82,00 = 0,25 M.
2. Расчет константы гидролиза соли
СН3СООNа — соль сильного основания и слабой кислоты, поэтому гидролиз проходит по аниону:
Константа гидролиза определяется константой диссоциации образовавшейся кислоты СН3СООH и определяется по формуле:
3. Определение степени гидролиза соли
Степень гидролиза определяется по формуле:
4. Расчет рН раствора соли образованной сильным основанием и слабой кислотой
Так как гидролиз соли СН3СООNа протекает с выделением ОН – — ионов, то рассчитаем [OH – ]:
[OH – ] = h · CM = (4,73 · 10 –5 )·(0,25) = 1,18 · 10 –5 моль/дм 3 ;
рОН = -lg[OH – ] = -lg1,18 · 10 –5 = 5 — 0,07 = 4,93;
pH = 14 — pOH = 14 — 4,93 = 9,07.
Ответ: рН = 9,07; h = 4,73 · 10 –3 %.
Гидролиз нитрита калия
Задача 89.
К 30 см 3 воды прибавили 5 см 3 3 М раствора КNO2. Вычислите рН и степень гидролиза соли.
Решение:
V(Н2О) = 30 см 3 ;
V(КNO2) = 5 см 3 ;
KD(КNO2) = 4,00 · 10 –4 ;
М(КNO2) = 85,1 г/моль;
СМ(КNO2) = 3 М;
pH = ?
h = ?
Объем раствора после смешения составляет 35 см 3 (V(р-ра) = 30 + 5 = 35 см 3 ).
1. Определение массы соли КNO2
2. Определение молярности раствора после смешения
3. Расчет константы гидролиза соли
КNO2 — соль сильного основания и слабой кислоты, поэтому гидролиз проходит по аниону:
Константа гидролиза определяется константой диссоциации образовавшейся кислоты СН3СООH и определяется по формуле:
4. Определение степени гидролиза соли
4. Расчет рН раствора соли образованной сильным основанием и слабой кислотой
Так как гидролиз соли КNO2 протекает с выделением ОН – — ионов, то рассчитаем [OH – ]:
[OH¯] = h · CM = (7,62 · 10 –6 )·(0,43) = 3,28 · 10 –6 моль/дм 3 ;
рОН = -lg[OH¯] = -lg3,28 · 10 –6 = 6 — 0,52 = 5,48;
pH = 14 — pOH = 14 — 5,48 = 8,52.
Ответ: рН = 8,52; h = 7,62 · 10 –4 %.
Гидролиз ацетата натрия
CH3COONa — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Молекулярное уравнение
CH3COONa + HOH ⇄ CH3COOH + NaOH
Полное ионное уравнение
CH3COO — + Na + + HOH ⇄ CH3COOH + Na + + OH —
Сокращенное (краткое) ионное уравнение
CH3COO — + HOH ⇄ CH3COOH + OH —
Среда и pH раствора ацетата натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
http://buzani.ru/zadachi/obshchaya-khimiya/1650-konstanta-gidroliza-atsetata-natriya-zadachi-87-89
http://chemer.ru/services/hydrolysis/salts/CH3COONa