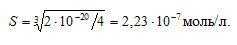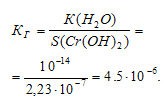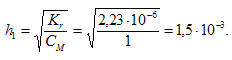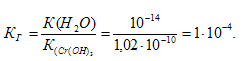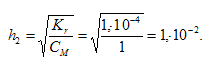Гидролиз хлорида олова (II)
SnCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Первая стадия (ступень) гидролиза
Молекулярное уравнение
SnCl2 + HOH ⇄ SnOHCl + HCl
Полное ионное уравнение
Sn 2+ + 2Cl — + HOH ⇄ SnOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Sn 2+ + HOH ⇄ SnOH + + H +
Вторая стадия (ступень) гидролиза
Молекулярное уравнение
SnOHCl + HOH ⇄ Sn(OH)2 + HCl
Полное ионное уравнение
SnOH + + Cl — + HOH ⇄ Sn(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
SnOH + + HOH ⇄ Sn(OH)2 + H +
Среда и pH раствора хлорида олова (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Напишите молекулярные и ионные уравнения реакций гидролиза, протекающего в растворе соли SnCl2?
Химия | 10 — 11 классы
Напишите молекулярные и ионные уравнения реакций гидролиза, протекающего в растворе соли SnCl2.
При возможности нескольких ступеней гидролиза, ограничьтесь первой стадией процесса.
SnCl2 (гидролиз по катиону) SnCl2 = Sn( + 2) + 2Cl( — )2Cl( — ) + Sn( + 2) + HOH = 2Cl( — ) + SnOH( — ) + H( + ) среда кислаяSnCl2 + H2O = SnOHCl + HCl.
Напишите уравнение гидролиза соли нитрита калия в молекулярной, ионной и сокращенной ионной форме?
Напишите уравнение гидролиза соли нитрита калия в молекулярной, ионной и сокращенной ионной форме.
Укажите, реакцию среды в растворе соли.
Даны соли : карбонат натрия , нитрат меди (II), сульфат калия?
Даны соли : карбонат натрия , нитрат меди (II), сульфат калия.
При гидролизе одной из них среда раствора становится кислой.
Напишите молекулярное и краткое ионное первой стадии гидролиза этой соли.
Какая из солей также подвергается гидролизу ?
Напишите молекулярное и краткое ионное уравнение первой стадии её гидролиза .
Напишите уравнение первой стадии гидролиза хлорида алюминия в молекулярном и ионно — молекулярном виде?
Напишите уравнение первой стадии гидролиза хлорида алюминия в молекулярном и ионно — молекулярном виде.
А). Напишите уравнение в молекулярной, полной и сокращённой ионной формах : NiCl2 + KOH → б)?
А). Напишите уравнение в молекулярной, полной и сокращённой ионной формах : NiCl2 + KOH → б).
Напишите молекулярные и ионные уравнения реакций гидролиза, протекающего в растворе соли Li(HCOO).
Составьте ионное и молекулярное уравнения гидролиза соли AlI3 по 1 ступени?
Составьте ионное и молекулярное уравнения гидролиза соли AlI3 по 1 ступени.
Укажите реакцию среды.
Напишите молекулярные и ионные уравнения реакций гидролиза соли K2SO3?
Напишите молекулярные и ионные уравнения реакций гидролиза соли K2SO3.
Напишите молекулярное и ионно — молекулярное уравнения реакции гидролиза и выражение для константы гидролиза по 1 ступени?
Напишите молекулярное и ионно — молекулярное уравнения реакции гидролиза и выражение для константы гидролиза по 1 ступени.
Составьте моекклярное и ионно — молекулярные (полное и сокрашенное ) уравнения реакции реакции гидролиза CuCl2?
Составьте моекклярное и ионно — молекулярные (полное и сокрашенное ) уравнения реакции реакции гидролиза CuCl2?
По первой ступени.
Mg(NO3)2 и Na2CO3 Ионные и молекулярные уравнения для гидролиза солей, реакция среды в растворе соли, выражение для константы гидролиза, куда сместиться равновесие гидролиза при подкислении раствора с?
Mg(NO3)2 и Na2CO3 Ионные и молекулярные уравнения для гидролиза солей, реакция среды в растворе соли, выражение для константы гидролиза, куда сместиться равновесие гидролиза при подкислении раствора соли.
Напишите уравнение реакции гидролиза соли k2s в молекулярной и ионной формах?
Напишите уравнение реакции гидролиза соли k2s в молекулярной и ионной формах.
На этой странице сайта вы найдете ответы на вопрос Напишите молекулярные и ионные уравнения реакций гидролиза, протекающего в растворе соли SnCl2?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 10 — 11 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
Всьо очень просто 112 делиш на 22, 4 = 5 моль Ответ 5 моль) Надеюсь что помог).
K2O CaO Li2O MgO Ag2O MnO2 MnO Mn2O7.
Пасан ну ты в каком классе.
2al + 6hcl = 2alcl3 + 3h2 13 коеффициентов.
Бредовый рассказ Кот Васька и старик часто рыбачили. Старик удил рыбу, а Васька сидел рядом. Однажды поймал старик рыбу. Не простую, а золотую. Васька хотел съесть ее, но вдруг она заговорила. Попросила она отпустить ее и тогда исполнит любое же..
22 * 2 = 44 44 — 32 = 12 значит, это СО2, или, проще сказать, углерод.
Потому что элементы соединяясь друг с другом образуют соединения.
P2O5 + 6NaOH→2Na3PO4 + 3H2O H2SO4 + 2NaOH→2H2O + Na2SO4 H2SO4 + Zn→ZnSO4 + H2 H2SO4 + MgCO3→MgSO4 + CO2 + H2O H2SO4 + 2AgNO3→2HNO3 + Ag2SO4 2NaOH + Zn0→Na2ZnO2 + H2 2NaOH + MgCO3→Mg(OH)2 + Na2CO3 2NaOH + 2AgNO3→Ag2O + 2NaNO3 + H2O Zn + 2AgNO3→2Ag + Z..
СвойстваЭтилен(другое название —этен) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частичнорастворим в воде(25, 6 мл в 100 мл воды при 0°C), этаноле ..
Жозеф Луи Пруст открыл закон постоянства веществ.
Как определяется степень гидролиза изомолярного раствора соли
Задача 1105.
Каково соотношение степеней гидролиза для изомолярных растворов СrCl2 (h1) и СгСI3 (h2): а) h1 > h2; 6) h1 = h2; в) h1 . 10 -20 ;
КД[Сr(ОН)3] = 1,02 . 10 -10 .
а) Рассчитаем растворимость Сr(ОН)2:
ПР[Сr(ОН)2] = [Cr 2+ ] . [OH – ] = S . (2S) 2 = 4S 3 ;
Константа гидролиза будет определяться растворимостью образовавшегося Сr(ОН)2 и определяется по формуле:
Степень гидролиза определяется по формуле:
б) Константа гидролиза определяется константой диссоциации образовавшегося основания Сr(ОН)3 и определяется по формуле:
Степень гидролиза определяется по формуле:
Как можно уменьшить степень гидролиза соли
Задача 1106.
Как уменьшить степень гидролиза SnCl2: а) нагреть раствор; б) добавить кислоту; в) уменьшить рН раствора?
Решение:
SnCl2 – соль слабого основания [(Sn(OH)2] и сильной кислоты (HCl), поэтому гидролизуется по катиону. С учетом того, что гидролиз в основном протекает по первой ступени, уравнение гидролиза можно представить уравнением:
Sn 2+ + H2O — Sn(OH) + + H +
Следовательно, раствор соли SnCl2 имеет кислую реакцию среды (рН
а) Диссоциация воды есть процесс эндотермический, то есть сопровождается поглощением тепла: Н2О = Н + + ОН – – 55,835 кДж/моль. Следовательно по принципу Ле-Шателье, повышение температуры благоприятствует процессу диссоциации воды, то есть с повышением температуры концентрация ионов Н+ и ОН– возрастает, а следовательно, возрастает величина ионного произведения воды. Если нагреть раствор SnCl2, то равновесие сместится вправо, т.е. усилится гидролиз.
б) При добавлении кислоты в растворе SnCl2 увеличится содержание ионов Н + , что будет подавлять гидролиз, смещая равновесие гидролиза влево.
в) По принципу Ле-Шателье уменьшение концентрации ионов водорода при уменьшении его рН сместит равновесие влево, т.е. уменьшит гидролиз. Чтобы усилить гидролиз, нужно увеличить рН раствора, т.е. нужно добавить сильную щелочь, связывающую ионы водорода.
http://himia.my-dict.ru/q/2102743_napisite-molekularnye-i-ionnye-uravnenia-reakcij/
http://buzani.ru/zadachi/khimiya-glinka/1378-stepen-gidroliza-zadachi-1105-1106