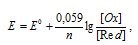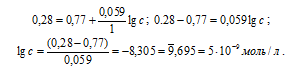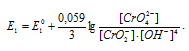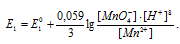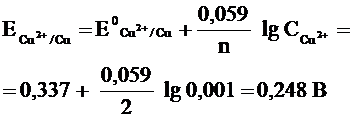Окисление-восстановление водорода на электродах гальванического элемента
Задача 662.
Гальванический элемент состоит из стандартного водородного электрода и водородного электрода, погруженного в раствор с рН = 12. На каком электроде водород будет окисляться при работе элемента, а на каком — восстанавливаться? Рассчитать э. д. с. элемента.
Решение:
Стандартный электродный потенциал водорода равен нулю. Электродный потенциал водородного электрода, погруженного в раствор с рН =12, вычислим из уравнения:
E = -0,059pH = -0,059 . 12 = -0,71B.
ЭДС = E(катод) — Е(анод) = Е0(2Н + /H2) — E[(2Н + /H2) . (pH12)]
Здесь Е 0 (2Н + /H2) и E[(2Н + /H2) . (pH12)] — потенциалы водородных электродов, отвечающих соответственно стандартному водородному электроду и водородному электроду, погружённому в раствор с рН = 12. Так как значение электродного потенциала водородного электрода, погружённого в раствор с рН = 12 (-0,71 В) более отрицательнее, чем значение потенциала стандартного водородного электрода (0,00В), то он будет являться анодом, а стандартный потенциал – катодом.
Электродные процессы на электродах
анод: H2О — 2 
катод: 2H + + 2 
ЭДС = -o,71 — (0,00) = -0,71B.
Ответ: -0,71В.
Задача 663.
Э. д. с. гальванического элемента, составленного из двух водородных электродов, равна 272мВ. Чему равен рН раствора, в который погружен анод, если катод погружен в раствор с рН = 3?
Решение:
Так как катод погружён в раствор с рН = 3, то его электродный потенциал можно рассчитать по уравнению:
E = -o,059pH = -o,059 . 3 = 0,177B.
Зная ЭДС гальванического элемента и электродный потенциал катода можно рассчитать электродный потенциал анода, получим:
ЭДС = E(катод) — Е(анод); Е(анод) — ЭДС = 0,177 — 272 = -0,095B.
Теперь рассчитаем рН раствора, в который погружён анод:
E = -0,059pH = pH = E/(-0,059) = 0,095/0,059 = 1,6.
Ответ: 1,6.
Задача 664.
Имеется окислителъно-восстановительная система [Fe(CN)6] 2- + 1 
Решение:
E(Fe 2+ /Fe) = o,77.
Электродный потенциал (Е) зависит от концентрации ионов электрода в растворе. Эта зависимость наблюдается и для электрохимических систем и выражается уравнением Нернста:
где Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; [Ox] и [Red] — произведения концентраций (активностей) веществ, принимающих участие в соответствующей полуреакции в окисленной ([Ox]) и восстановленной ([Red]) формах. Используя уравнение Нернста, рассчитаем отношение концентраций окисленной и восстановленной форм:
Ответ: 5 . 10 -9 моль/л.
Задача 665.
В каких случаях электродный потенциал зависит от рН раствора? Как изменятся при возрастании рН электродные потенциалы следующих электрохимических систем:
а) crO4 2- + 2H2O + 3 
б) MnO4 — + 8H + + 5 
в) Sn 4+ + 2 
Ответ обосновать.
Решение:
В тех случаях, когда в электродном процессе участвует вода, электродный потенциал зависит от концентрации ионов Н + (или ОН — , т.е. от рН раствора.
а) При возрастании рН раствора электродный потенциал электрохимической системы:
СrO4 2- + 2H2O + 3 
При увеличении рН раствора концентрация ионов становится меньше и тогда численное значение члена 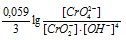
б) При возрастании рН раствора электродный потенциал электрохимической системы
MnO4 — + 8H + + 5 
При увеличении рН раствора концентрация ионов [H + ] становится меньше и тогда численное значение члена 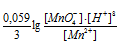
в) При увеличении рН раствора электродный потенциал электрохимической системы Sn 4+ + 2 
Ответ: а) увеличивается; б) уменьшается; в) не изменяется.
Применение уравнения Нернста в решении задач.
При рассмотрении вопроса об окислительно-восстановительных реакциях часто возникает необходимость расчета электродвижущей силы (ЭДС) и потенциалов отдельных полуреакций. В справочниках обычно приведены таблицы т.н. стандартных потенциалов тех или иных процессов, рассчитанных при р=1 атм, Т=298К и активностях участников равных 1. Однако в реальных задачах условия могут значительно отличаться от указанных выше. Как быть в таком случае? Ответ дает уравнение Нернста. В оригинальном виде оно выглядит так:
Как можно заметить, в уравнении фигурируют несколько постоянных величин. Также температура в подавляющем большинстве случаев равна 298К. Кроме того, можно заменить натуральный логарифм на десятичный. Это можно сделать путем умножения на коэффициент перевода. Если собрать все постоянные в единый множитель, то приходим к несколько иному, но более знакомому по учебным пособиям виду уравнения Нернста:
Такой вариант уравнения сильно облегчает жизнь в ряде случаев, например рассмотрении рН-зависимых процессов. Используя данное уравнение можно провести вычисления в любых условиях, приведенных в задаче. Рассмотрим характерные примеры задания по данной теме.
Пример 1:
Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0.01М ZnSO4 соответственно. Коэффициенты активности ионов Cu 2+ и Zn 2+ принять равными единице.
Решение:
Для начала запишем уравнения протекающих процессов:
Далее находим по таблице стандартные потенциалы процессов:
Если в условиях задачи ничего не сказано про коэффициенты активности ионов, то можно считать их равными единице, как и в нашем случае. Тогда активности участников процессов можно принять равными их аналитическим концентрациям.
Найдем реальные потенциалы с учетом нестандартных активностей ионов:
Далее необходимо сравнить полученные величины между собой, чтобы определить, кто из участников процесса – окислитель. Потенциал меди больше, чем у цинка, поэтому она будет окислителем. Тогда найдем ЭДС системы:
Ответ: 1.13 В
Пример 2:
Одним из лабораторных способов получения хлора является действие KMnO4 на концентрированную соляную кислоту. Можно ли провести процесс при рН=4?
Решение:
Для начала запишем уравнения протекающих процессов.
Далее находим по таблице стандартные потенциалы процессов:
Несложно заметить, что от рН в данном случае зависит только потенциал перманганата. Тогда воспользуемся уравнением Нернста и рассчитаем его реальный потенциал в условиях задачи:
Получается, что потенциал KMnO4 стал меньше, чем у хлора, а значит, реакция не пойдет.
Водородный электрод
Водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (для увеличения активной поверхности электрода) и погруженный в раствор, содержащей катионы водорода, обычно раствор HCl или H2SO4, На пластинку подается ток водорода, который поглощается платиной (учебник Ершова, с. 472).

Водород, растворенный в платине, частично, под действием силовых полей атомов платины, диссоциирует на протоны и электроны:


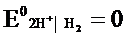
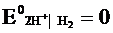
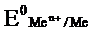
Стандартный электродный потенциал численно равен электродвижущей силе со знаком «+» или «-» гальваническою элемента, составленного из стандартного водородного и стандартного данного электродов.
Стандартные электродные потенциалы распространенных металлов в водных растворах при 25 °С представлены в соответствующих таблицах.
Последовательность металлов по возрастанию стандартного потенциала Е 0 (от больших отрицательных к большим положительным значениям) называется рядомстандартныхэлектродныхпотенциалов или электрохимическим рядом напряжений. У металлов, стоящих до водорода, стандартные электродные потенциалы отрицательные. После водорода — положительные.
Таким образом, при стандартных условиях электродные потенциалы имеют определенные стандартные значения. Величиныстандартныхэлектродныхпотенциаловколичественнохарактеризуютвосстановительнуюспособностьметалловиокислительнуюспособностьихионов. Так, Li — самый сильный восстановитель, а Аu — самый слабый, и наоборот, ион Аu 3+ — самый сильный окислитель, а ион Li + — самый слабый.
Для условий отличных от стандартных (иная концентрация электролита и иная температура) электродные потенциалы будут иметь другие значения. Их можно рассчитать по уравнению Нернста (немецкий физик, 1888г):
где 
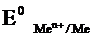
R — универсальная газовая постоянная, равная 8,31 Дж/моль*К,
Т — абсолютная температура, К.
n — заряд ионов металлов.
F — число Фарадея, равное 96500 Кл/моль,
ln — натуральный логарифм,
а — активность ионов металла в растворе, моль/л.
Таким образом, величина электродного потенциала зависит от природы металла (E 0 ), активности ионов металла в растворе и температуры.
В разбавленных растворах активность примерно равна молярной концентрации а ≈ с.
Для расчетов при температуре 298 К (25 °С), подставив константы R, F и умножив значение ln на 2,3 (коэффициент перехода от натуральных логарифмов к десятичным), получают уравнение Нернста в следующей форме:
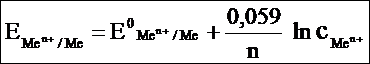 |
Пример. Потенциал медного электрода (n = 2) в растворе CuCl2 с концентрацией ионов меди С = 0,001 моль/л равен:
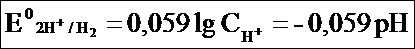
По этой формуле, зная величину электродного потенциала водородного электрода, находящегося в исследуемом растворе, можно рассчитать рН этого раствора. Однако для серийных измерений водородный электрод не применяется в силу громоздкой конструкции и чувствительности к посторонним веществам и каталитическим ядам.
http://scienceforyou.ru/jelektrohimija/uravnenie-nernsta
http://mydocx.ru/2-126621.html