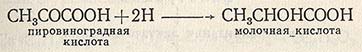Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Карбоновые кислоты и их производные. Гидроксикислоты. Оксокислоты (стр. 4 )
Поскольку гидроксиальдегиды образуются при окислении гликолей, последние также можно использовать для получения гидроксикислот. 3. Физические и химические свойстваГидроксикислоты – жидкости или большей частью кристаллические вещества. В воде они растворимы лучше, чем соответствующие карбоновые кислоты, не содержащие гидроксила. Низшие гидроксикислоты смешиваются с водой в любых соотношениях. Гидроксикислоты проявляют свойства кислот и спиртов. Как кислоты они дают соли, сложные эфиры, амиды и т. д.: По сравнению с карбоновыми кислотами с тем же числом углеродных атомов гидроксикислоты (в особенности α-гидроксикислоты) обнаруживают более сильно выраженные кислотные свойства. Так, константа диссоциации гликолевой кислоты в 8,5 раз больше, чем уксусной. Как спирты гидроксикислоты образуют алкоголяты, простые эфиры, замещают гидроксил галогеном: Вступление в реакцию спиртового или кислотного гидроксила определяется выбором реагента и условиями реакции. Так, при действии галогеноводородов замещается галогеном только спиртовой гидроксил, а при действии пентахлорид фосфора – и кислотный, и спиртовой. При действии щелочных металлов (натрий) сначала получаются соли кислот, а затем алкоголяты. При всех превращениях гидроксикислот приходится считаться с взаимным влиянием гидроксильной и карбоксильной групп. Особенно это влияние велико, если эти группы находятся в α-положении. α-Гидроксикислоты обнаруживают ряд специфических реакций, обусловленных взаимным влиянием гидроксильной и карбоксильной групп. 3.1. Восстановление α-гидроксикислот.α—гидроксикислоты легко восстанавливаются в карбоновые кислоты, например при действии иодистого водорода: СН3―СНOH―COOH + 2HI → CH3―CH2―COOH + I2 + H2O 3.2. Нагревание α-гидроксикислот.При кипячении с разбавленными кислотами α-гидроксикислоты расщепляются с выделением муравьиной кислоты: СН3―СН(OH)―COOH → CH3―COН + HCOOH 3.3. Реакция дегидротации α-, β— и γ-гидроксикислот.Реакция отщепления воды позволяет различить α-, β— и γ-гидроксикислоты. 3.3.1. Образование лактидов.α-Гидроксикислоты при нагревании отщепляют воду с образованием лактидов. Лактидами называются циклические эфиры, построенные из двух и более остатков гидроксикислот (необязательно α-гидроксикислот). При нагревании этих кислот в результате межмолекулярной этерификации образуется димерный продукт, легко превращающийся в более устойчивый шестичленный циклический диэфир – лактид: Название лактидов включает корень тривиального латинского названия гидроксикислоты, суффикс –ид и умножающий префикс ди—, три- и т. д., указывающий число молекул, образующих лактид. Например, дигликолид – от гликолевой кислоты, дилактид – от молочной кислоты. По химическим свойствам лактиды подобны сложным эфирам. 3.3.2. Образование непредельных кислот.β—гидроксикислоты теряют воду и дают непредельные кислоты. Такое направление дегидратации связано с повышенной подвижностью водородных атомов в соседстве с карбоксильной группой, обусловленной устойчивостью (благодаря сопряжению) соответствующего аниона: 3.3.3. Образование лактонов.При нагревании в кислой среде, а иногда просто при стоянии в растворе, γ- и δ-гидроксикислоты подвергаются внутримолекулярной этерификации с образованием пяти- и шестичленных лактонов, например: Лактонами называются внутренние сложные эфиры гидрксикислот, т. е. соединения, в которых сложноэфирная группировка ―С(О)О― включена в циклическую структуру. Легкость лактонизации γ- и δ-гидроксикислот объясняется повышенной термодинамической устойчивостью пяти — и шестичленных циклических соединений. Циклы меньшего или большего размера в этих условиях не образуются. По номенклатуре ИЮПАК лактоны, образованные из алифатических кислот, называют, добавляя суффикс –олид к названию углеводорода с тем же числом атомов углерода. Цифрой указывают место замыкания цикла, начиная нумерацию от карбонильного атома углерода. Так, приведенный выше, γ-бутиролактон имеет систематическое название 4-бутанолид. 4. Отдельные представители.Молочная кислота CH3CH(OH)COOH была впервые обнаружена (1780) в прокисшем молоке, отсюда и получила название. Благодаря наличию в молекуле асимметрического атома углерода молочная кислота может существовать в виде двух оптически активных энантиомеров – D — и L-форм – и оптически неактивной рацемической формы. Последняя представляет собой молочную кислоту брожения. L(+)–Молочная кислота, образуется в мышечной ткани как продукт расщепления и дальнейшего превращения полисахарида гликогена. D(-)–Молочная кислота может быть получена под действием микроорганизмов. Соли и сложные эфиры молочной кислоты называются лактатами. Важно отметить, что соли и эфиры L(+)-молочной кислоты являются левовращающими, а соли и эфиры D(-)–молочной кислоты – правовращающими. Яблочная кислота HOOCCH2CH(OH)COOH – представитель гидроксидикарбоновых кислот. Яблочная кислота, как и молочная, существует в виде двух энантиомеров. L(-)–яблочная кислота, содержится в незрелых яблоках, плодах рябины и барбариса. Лимонная кислота HOOCCH2C(OH)(COOH)CH2COOH, т. пл. 1530С – наиболее распространенная гидрокситрикарбоновая кислота. Она содержится в плодах цитрусовых (в лимонах её 6-8% от сухой массы), некоторых ягодах и фруктах. Лимонная кислота и её соли (цитраты) широко используются в пищевой промышленности и фармации. Салициловая кислота о-HOC6H4COOH представляет собой кристаллическое вещество, плохо растворимое в воде. По кислотности (рКа2,98) она превосходит почти все монозамещённые бензойные кислоты, в том числе и с электроноакцепторными заместителями. Салициловая кислота встречается в растительном мире как в свободном состоянии, так и в связанном виде во многих эфирных маслах. Салициловая кислота обладает антисептическими свойствами и находит применение как в медицине, так и как консервант некоторых пищевых продуктов. Но ещё более широко используются в медицинской практике производные салициловой кислоты по обеим функциональным группам. Главным образом, это сложные эфиры по карбоксильной группе – метилсалицат и фенилсалицат, имеющий торговое название салол, и по фенольному гидроксилу – ацетилсалициловая кислота, для которой одно из многочисленных торговых названий — аспирин. Названные производные получают известными способами синтеза сложных эфиров. Так, метилсалицат образуется при этерификации салициловой кислоты метанолом: салициловая кислота метилсалицилат Низкая нуклеофильность фенолов не позволяет таким же способом получить фенилсалицилат. Поэтому салициловую кислоту превращают предварительно в более активный ацилирующий агент – хлорангидрид, которым затем ацилируют фенол: Гидроксильная группа фенола ацилируется под действием уксусного ангидрида с количественным выходом: Салициловая кислота и её производные со свободной гидроксильной группой дают с раствором хлорида железа (III) фиолетовое окрашивание, характерное для фенолов, что используется в качественном анализе. III. Оксокислоты.1. Общая характеристика.Оксокарбоновыми кислотами (оксокислотами) называются соединения, молекулы которых содержат наряду с карбоксильной группой оксогруппу, т. е. это альдегидо — или кетонокислоты. Оксокислоты могут содержать одну, две или более карбоксильных групп. По взаимному расположению функциональных групп различают α-, β-, γ-оксокарбоновые кислоты; существуют также оксокислоты и с иным расположением функциональных групп. Многие оксокислоты являются важными метаболитами, участвующими в обмене веществ. Биологическая роль α-оксокислот заключается в том, что они являются интермедиатами в биосинтезе α-аминокислот в живых организмах. Названия оксокислот часто связано со способами получения веществ из природных источников. Например, пировиноградная кислота СН3СОСООН называется так по способу ее получения пиролизом виноградной кислоты. Альдегидо — кетокислоты также рассматривают как производные соответствующей жирной кислоты, полученной замещением водорода на ацильный остаток. 1.1. Некоторые биогенные оксокарбоновые кислотыи их биологическая рольЭто единственная α-альдегидокисло-та. Встречается в недозрелых фрук-тах Важнейший проме-жуточный метабо-лит в живых систе-мах Образуется в орга-низме при β-окис-лении жирных кис-лот; накапливается при сахарном диа-бете
Метаболит, участ-вующий в цикле Кребса
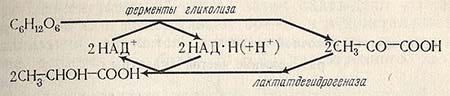
Метаболит, участ-вующий в цикле Кребса и в синтезе глутаминовой и γ-аминомасляной кислот В названиях альдегидо — и кетонокислот наличие карбонильной группы обозначают префиксом оксо-. Для некоторых оксокислот укоренились тривиальные названия (пировиноградная, левулиновая); для оксокислот, участвующих в биохимических циклах в живых организмах, используются традиционно сложившиеся в биохимической литературе названия – ацетоуксусная, щавелевоуксусная, кетоглутаровая и др.: 2. Способы получения2.1. Гидролиз дигалогенозамещённых кислот.Оксокислоты разных типов могут быть получены гидролизом дигалогенозамещенных кислот. 2.2. Гидролиз α-оксонитрилов.α-Оксокислоты также получают гидролизом α-оксонитрилов, которые, в свою очередь, синтезируют из ацилгалогенидов и солей циановодородной кислоты: 2.3. Сложноэфирная конденсация.В качестве основного способа синтеза β-оксокислот используется реакция сложноэфирной конденсации, приводящая к получению эфиров β-оксокислот, гидролизуемых далее в свободные β-оксокислоты: 2.4 Дегидратация и декарбонилирование лимонной кислотыЧастный случай получения β-оксокарбоновых кислот состоит в дегидратации и декарбонилировании лимонной кислоты олеумом на холоду: 2.5 Синтез γ-оксокислот из янтарного ангидрида.Получение γ-оксокислот. Эти кислоты синтезируют из янтарного ангидрида и магнийорганических соединений, например: 3. Химические свойстваОксокарбоновые кислоты сильнее, чем соответствующие гироксикарбоновые кислоты. Поэтому в биосредах организма (рН≈7) они обычно находятся в виде анионов. Оксокислоты проявляют многие свойства, характерные как для карбоновых кислот, так и для альдегидов и кетонов. Оксокислоты образуют производные по карбоксильной группе – соли, сложные эфиры амиды и т. д., по оксогруппе – оксимы, гидразоны, гидроксинитрилы и т. д. Химические свойства оксокислот существенно зависят от взаимного расположения функциональных групп. Обе группы оказывают друг на друга определенное влияние. В частности, при близком их расположении наблюдается взаимное усиление электрофильных свойств атомов углерода карбонильной и карбоксильной групп и, как следствие, усиление их реакционной способности при взаимодействии с нуклеофилами. Кислотные свойства оксокарбоновых кислот снижаются по мере удаления оксогруппы от карбоксильной группы. 3.1. Образование гидратных форм.α-Оксокислоты, у которых карбонильная группа находится в непосредственном соседстве с электроноакцепторной группой, легко вступают в реакции нуклеофильного присоединения. Например, некоторые α-оксокислоты легко присоединяют воду и образуют устойчивые гидратные формы: 3.2. Декарбоксилирование и декарбонилирование α-оксо-кислот.Под действием разбавленных минеральных кислот α-оксокислоты подвергаются декарбоксилированию; нагревание с концентрированной серной кислотой приводит к декарбонилированию, т. е. отщеплению оксида углерода (II): 3.3.Кето-енольная таутомерия, β-оксокислот и их сложных эфиров..β-оксокислоты среди оксокислот имеют наибольшее практическое значение. Специфика их химических свойств обусловлена наличием сильного СН-кислотного центра, возникновение которого связано с β-расположением функциональных групп. Именно в ряду β-оксокислот наиболее ярко проявляется один из видов динамической изомерии – кето-енольная таутомерия. Таутомерия – способность химических соединений существовать в виде двух или нескольких, находящихся в равновесии, структурных изомеров. В большинстве случаев таутомерные превращения сопровождаются переносом протона от одного атома к другому, поэтому такие виды таутомерии объединяются общим понятием прототропной таутомерии. Одной из разновидностей прототропной таутомерии является кето-енольная таутомерия, сущность которой состоит в переносе протона от α-СН-кислотного центра карбонильного соединения к атому кислорода карбонильной группы как основному центру: Кето-енольная таутомерия свойственна β-оксокислотам и их сложным эфирам, а также 1,3-дикетонам и соединениям других классов, содержащим карбонильную группу. Енольная форма термодинамически менее выгодна, чем кетонная. Показано, что енолизация является эндотермическим процессом. Однако в 1,3-дикарбонильных соединениях енольная форма стабилизирована за счет образования внутримолекулярных водородных связей, а также за счет сопряжения. Таутомерные формы ацетоуксусного эфира: Положение равновесия таутомеров зависит от строения карбонильного соединения. Заметные количества енольной формы в равновесной смеси появляются тогда, когда СН-кислотность карбонильного соединения усиливается за счет дополнительной электроноакцепторной группы, например, у ацетона содержание енольной формы низкое, а у ацетилацетона она преобладает в равновесной смеси. При наличии в β-положении объемных заместителей устойчивость енольной формы понижается, так как объемные группы препятствуют образованию внутримолекулярной водородной связи. Так, содержание енольной формы снижается в ряду: ацетоуксусный эфир – метилацетоуксусный эфир – этилацетоуксусный эфир. Наличие у соединения таутометрии значительно расширяет и повышает его реакционную способность. Такое соединение способно не только вступать в реакции, характерные для каждого таутомера, но и проявлять еще двойственную реакционную способность, характерную для их общего амбидентного аниона. При этом таутомерная система прежде всего вступает в те реакции, которые протекают быстрее (кинетический фактор) и приводят к более устойчивым продуктам (термодинамический фактор). Поскольку все компоненты таутомерной системы находятся в равновесии, то убыль реагирующего компонента сразу восполняется за счет других компонентов. Поэтому таутомерная система реагирует как одно целое. В организме время установления равновесия в таутомерной системе уменьшается с помощью ферментов-таутомераз, что обеспечивает необходимую скорость жизненно важных биохимических реакций. 3.3.1. Химические свойства таутомерных форм.Существование двух таутомерных форм проявляется в химических свойствах β-оксоэфиров. Ацетоуксусный эфир может вступать в реакции как в кетонной, так и в енольной форме. Как кетон он способен присоединять циановодородную кислоту и гидросульфит натрия, а в реакции с этиленгликолем – образовывать циклический ацеталь: В реакциях с такими нуклеофилами, как гидразин и его производные или гидроксиламин, ацетоуксусный эфир образует пятичленные гетероциклические соединения. В енольной форме ацетоуксусный эфир при взаимодействии с хлоридом фосфора (V) превращается в эфир галогенозамещенной α,β-ненасыщенной кислоты: Качественной пробой для обнаружения енольной формы ацетоуксусного эфира служит реакция с хлоридом железа (III), приводящая к появлению вишневого окрашивания реакционной смеси. Для количественного определения содержания енольной формы в равновесной смеси применяют титрование бромом. Бромирование двойной связи протекает значительно быстрее, чем енолизация карбонильного соединения, поэтому при быстром проведении титрования удается довольно точно установить содержание енольной формы: 3.3.2. Кетонное и кислотное расщепление.Ацетоуксусный эфир, как эфир β-кетокислоты, расщепляется щелочами по связи С―С: Разбавленные щелочи вызывают кетонное расщепление эфира (а), концентрированные – кислотное (b). Различия в направлении расщепления ацетоуксусного эфира и его гомологов определяется особенностями действия разбавленных и концентрированных щелочей. Разбавленные щелочи омыляют эфир до кислоты. Последняя при нагревании декарбоксилируется. Ацетоуксусный эфир и его алкильные производные при действии концентрированных спиртовых растворов щелочи подвергаются так называемому кислотному расщеплению, приводящему к образованию сложных эфиров замещенных уксусных кислот. Гидролиз образующегося сложного эфира обычно осуществляют в кислой среде: 3.3.3. Декарбоксилирование.β-Оксокислоты легко подвергаются декарбоксилированию, что обусловлено образованием шестизвенного переходного состояния с низкой энергией. Ацетоуксусная кислота при нагревании выше 1000С декарбоксилируется с образованием ацетона: Декарбоксилирование является этапом так называемого кетонного расщепления замещенных ацетоуксусных эфиров с целью получения метилкетонов. 3.4. γ— и δ-ОксокислотыСпецифическим свойством γ— и δ-оксикислот является их способность к другому виду таутомерии – кольчато-цепной (цикло-оксо) таутомерии. Возникновение этого вида таутомерии обусловлено тем, что гидроксильная группа как нуклеофил обратимо присоединяется к кетонной группе: Открытая (ациклическая) форма γ— и δ-оксикислот находится в равновесии с соответствующими гидроксилактонами – соединениями, которые, с одной стороны, можно рассматривать как циклический полуацеталь, а с другой – как сложный эфир. Кольчато-цепная таутомерия более известна для моносахаридов. 4.Биологическое окисление гидрокси — и оксокарбоновых кислот.Реакции цикла Кребса.Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбоновых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива» углеводов, жирных кислот и аминокислот. Цикл Кребса также называют циклом лимонной кислоты или циклом ди — и трикарбоновых кислот. Участвующие в цикле ди — и трикарбоновые кислоты находятся в виде анионов, поэтому все реакции цикла Кребса даны для анионных форм. Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл состоит из восьми последовательных стадий. I стадия является реакцией нуклеофильного присоединения (АN) ацетилкофермента А по двойной связи карбонильной группы оксалоацетата. Образующийся цитрилкофермент А легко гидролизуется до цитрата (аниона лимонной кислоты) и кофермента А: II стадия заключается в изомеризации цитрата в изоцитрат, которая осуществляется за счет двух последовательных реакций: дегидратации исходного цитрата и гидратации образующегося промежуточного продукта: IIIа стадия – дегидрирование (окисление) изоцитрата дегидрогеназой с окисленной формой кофермента НАД+ с образованием оксалосукцината: IIIб стадия – декарбоксилирование оксалоацетата в 2 оксоглутарат в результате внутримолекулярной дисмутации: IV стадия является реакцией окислителного декарбоксилирования, происходящей под действием двух коферментов: НАД+ (окислитель) и HSКоА – и сопровождаемой межмолекулярной дисмутацией. На этом заканчивается этап окисления ацетильного остатка ацетилкофермета до СО2 и Н2О: V стадия заключается в гидролизе сукцинилкофермента А. Это – экзэргоническая реакция, с которой сопряжен синтез одной молекулы АТФ: VI стадия является реакцией дегидрирования сукцината в фумарат дегидрогеназой с окисленной формой кофермента ФАД, сопровождаемой межмолекулярной дисмутацией: VII стадия заключается в стереоспецифическом присоединении молекулы воды по кратной межуглеродной связи с образованием исключительно L-малата (аниона L-оксоянтарной кислоты). Эта реакция сопровождается внутримолекулярной дисмутацией: VIII стадия, сопровождаемая межмолекулярной дисмутацией, приводит к регенерации оксалоацетата за счет дегидрирования L-малата дегидрогеназой и окисленной формой кофермента НАД: Образовавшийся оксалоацетат опять вступает в реакцию (I стадия) с новой молекулой ацетилкофермента А. Таким образом, из 11 реакций цикла Кребса девять сопровождаются окислительно-восстановительной дисмутаций за счет углеродных атомов, причем пять имеет межмолекулярный, а четыре – внутримолекулярный характер. Как видно, за один оборот цикла, состоящего из восьми стадий, происходит полное окисление одной молекулы ацетил-КоА. В результате реакций одного цикла Кребса образуется 12 молекул АТФ, из них одна молекула синтезируется в результате экзэргонической реакции стадии V, а остальные – за счет окисления образующихся трех молекул НАД(Н) и одной молекулы ФАД(2Н), которое протекает в электронотранспортной цепи. Всего за счет полного окисления одной молекулы стеариновой кислоты С17Н35СООН, включая реакции её β-окисления и цикла Кребса, в митохондрии синтезируется 146 молекул АТФ, а пальмитиновой кислоты С15Н31СООН – 129 молекул АТФ. Кратко схема превращения ацетил-КоА и оксалоацетата в цикле Кребса представлена на рисунке.
Работа ферментов цикла Кребса очень надежна, так как не известны патологические состояния, связанные с недостатком активности какого-либо из этих ферментов. Это указывает на важность реакций цикла Кребса для организма и хорошую их защищенность от внешних воздействий. 5.Эталонное решение задач.1. Предложите схему синтеза молочной кислоты из 2-хлорпропановой кислоты. Обладает ли полученная кислота оптической активностью? Какой продукт образуется при нагревании молочной кислоты? Напишите схему реакции. Гидроксикислоты получают из галогенкарбоновых кислот в результате обработки их щелочью с последующим взаимодействием образующейся соли гидроксикислоты с кислотой: Благодаря наличию в молекуле асимметрического атома углерода она может существовать в виде двух оптически активных энантиомеров: Так как молочная кислота относится к α-гидроксикислотам, то она при нагревании образует устойчивый шестичленный циклический диэфир-лактид: 2. Какое соединение образуется при нагревании 3-гидроксибутановой кислоты? Объясните, почему при нагревании этой кислоты невозможна внутри — и межмолекулярная этерификация? 3-гидроксибутановая кислота относится к β-гидроксикислотам, а этим кислотам при нагревании или под действием минеральных кислот характерны реакции дегидратации с образованием α,β-ненасыщенных кислот: Внутри — или межмолекулярная этерификация в этом случае невозможна, так как она привела бы к образованию неустойчивого четырех — или восьмичленного цикла (лактона и лактида соответственно). Направленность реакции определяется большей подвижностью атома водорода в α-положении по сравнению с γ-положением. 3. Напишите схему реакций взаимодействия β-гидроксикислоты с гидроксидом натрия, этанолом и аммиаком. Назовите продукты реакции. Наличие в молекуле гидроксикислот карбоксильной и гидроксильной групп приводит к тому, что эти соединения вступают в реакции, свойственные как спиртам, так и кислотам. С гидроксидом натрия, этанолом и аммиаком реакции идут по карбоксильной группе: 4. Приведите схемы реакций взаимодействия молочной (2-гидроксипропановой) кислоты с галогеноводородом и уксусным ангидридом. Вступление в реакцию спиртового и кислотного гидроксила определяется выбором реагента и условиями реакции. С галогенводородом и уксусным ангидридом в реакции участвует спиртовой гидроксил: 5. Напишите схему реакций взаимодействия α-гидрокислоты с натрием и пентахлоридом фосфора. При взаимодействии щелочных металлов с гидроксикислотами сначала получаются соли, а затем алкоголяты: При действии пентахлорида фосфора замещается галогеном спиртовой и кислотный гидроксил: 6. Напишите схему расщепления лимонной кислоты под действием концентрированной серной кислоты. Какое карбонильное соединение получается в результате? Напишите схему соответствующей реакции. Нагревание с серной кислотой приводит к расщеплению лимонной кислоты на ацетондикарбоновую и муравьиную кислоты, которые распадаются далее с выделением соответственно диоксида и монооксида углерода: Процесс распада ацетондикарбоновой кислоты приводит к образованию ацетона 7. Напишите схемы реакций взаимодействия пировиноградной (2-оксопропановой) кислоты с гидроксидом натрия, этанолом и аммиаком. Наличие в молекуле пировиноградной кислоты карбонильной и карбоксильной групп приводит к тому, что в зависимости от реагента и условий реакции, процесс может протекать как по оксо-, так и по карбоксильной группе. С гидроксидом натрия и этанолом реакция протекает по карбоксильной группе: С аммиаком реакция протекает одновременно по карбонильной и карбоксильной группам: 8. Приведите схемы реакций взаимодействия ацетоуксусной (3-оксобутановой) кислоты с гидроксиламином и циановодородной кислотой. Оксокислоты с гидроксиламином и циановодородной кислотой образуют производные по карбонильной группе. Оксогруппе характерны реакции присоединения: 9. Пировиноградная (2-оксопропановая) кислота при добавлении кислот вступает в реакцию альдольной конденсации, а образующийся альдоль легко превращается в лактон. Напишите схемы реакций. Некоторые α-оксокислоты из-за наличия в молекуле СН-кислотного центра вступают в реакции альдольной конденсации. Пировиноградная кислота при длительном стоянии, а ещё быстрее при добавлении кислот, превращается в соответствующий альдоль, который затем отщепляет воду, образуя лактон: 10. Напишите схемы реакций ацетоуксусного эфира с металлическим натрием, бромом, синильной кислотой, фенилгидразином. Ацетоуксусный эфир – пример соединения, способного к кето-енольной таутомерии. Обе формы эфира могут быть получены в свободном состоянии: кетонная – вымораживанием, енольная – перегонкой в кварцевой посуде. В химических превращениях ацетоуксусный эфир в зависимости от реагента ведет себя как кетон или как енол. Реакции отвечающие кетонной форме: 1) присоединение синильной кислоты: 2) действие фенилгидразина: продукт реакции теряет молекулу спирта и образует метилпиразолон: Реакции, отвечающие енольной форме: 1) образование натрийацетоуксусного эфира: 2) присоединение брома: Эту реакцию используют для количественного определения содержания енольной формы в равновесной смеси. 3) действие пентахлорида фосфора: 6. Задачи для самостоятельного решения.1. Напишите схемы реакций образования гидротартрата и тартрата калия. Какой структурный фрагмент можно обнаружить с помощью этих реакций? 2. Какой структурный фрагмент в молекуле винной кислоты может образовывать комплексную соль меди (II)? 3. Какой химический процесс происходит при нагревании молочной кислоты с концентрированной серной кислотой? Напишите схему реакции. 4. Напишите схемы реакций, происходящих при взаимодействии 2-этилацетоуксусного эфира с разбавленным раствором гидроксида калия и 2,2-диметилацетоуксусного эфира с концентрированным раствором гидроксида калия. 5. Напишите схему таутомерных превращений ацетоуксусного эфира, происходящих при комнатной температуре. 6. Какой структурный фрагмент молекулы ацетоуксусного эфира обуславливает появление вишневого окрашивания с хлоридом железа(III)? 7. Какие факторы способствуют стабилизации енольной формы ацетоуксусного эфира? 8. Какая реакция служит для количественного определения содержания енольной формы в растворах β-оксокислот? 9. Напишите схему гидролиза ацетилсалициловой кислоты при нагревании её водного раствора. Какой структурный фрагмент в молекуле кислоты даёт фиолетовое окрашивание с хлоридом железа(III)? 10. В состав кетоновых тел входит β-гидроксимаслянная кислота. Напишите схему реакции, происходящей при нагревании этого соединения. 11. Напишите схему реакции декарбоксилирования ацетоуксусной (3-оксобутановой) кислоты. Назовите продукт реакции. 12. На одной из стадий цикла Кребса происходит взаимное превращение лимонной, изолимонной и цис-аконитовой кислот. Какая и них может существовать в виде энантиомеров? Напишите проекционные формулы этих энантиомеров. 13. Приведите проекционные формулы Фишера винной (2,3-дигидроксибутановой) кислоты. 14. Напишите реакции, протекающие при нагревании пировиноградной кислоты с разбавленной и концентрированной серной кислотой. Назовите продукты реакции. 15. Глиоксалевая (2-оксопропановая) кислота в отличии от алифатических альдегидов образует устойчивую гидратную форму. Приведите строение этой гидратной формы и объясните причину её устойчивости. Литература1. , Бауков химия. М.; Медицина, 1991. 2. «Руководство к лабораторным занятиям по органической химии» под редакцией Тюкавкиной . М. 2003. 3. «Органическая химия» под редакцией Тюкавкиной . М. 2003. 4. Слесарев химии живого. ХИМИЗДАТ. Санкт-Петербург. 2000. 5. Грандберг химия. Академкнига. М. 2008. 6. Травень химия. Академкнига. М. 2008. 7. Биохимия человека. Мир-. М. 1993. СодержаниеI. Карбоновые кислоты и их производные. 3 1. Изомерия и номенклатура. 3 2. Физические свойства. 4 3. Способы получения. 5 3.1. Окисление первичных спиртов. 5 3.2. Окисление альдегидов. 5 3.4. Окисление алкилбензолов. 6 3.5. Галоформная реакция метилкетонов. 6 3.6. Гидролиз нитрилов. 6 3.7. Гидролиз функциональных производных карбоновых кислот (ацилгалогенидов, ангидридов, сложных эфиров, амидов и т. д.). 6 3.8. Гидролиз тригалогенопроизводных. 7 4. Химические свойства. 7 4.1. Кислотные свойства. 8 4.2. Реакции карбоновых кислот. 12 4.2.1. Восстановление карбоновых кислот. 12 4.2.2. Реакции декарбоксилирования. 12 4.2.3. Галагенирование алифатических карбоновых кислот. 14 4.2.4. Реакции нуклеофильного замещения. 14 4.2.5. Образование сложных эфиров. 15 4.2.6. Образование галогенангидридов. 17 4.2.7. Образование ангидридов. 17 4.2.8. Образование амидов. 19 5. Отдельные представители карбоновых кислот. 19 6. Функциональные производные карбоновых кислот. 22 6.1. Номенклатура. 22 6.2. Химические свойства производных карбоновых кислот. 25 6.3. Галогенангидриды. 27 6.3.1. Реакции ацилирования. 27 6.3.2. Восстановление. 28 6.4.1.Реакции ацилирования. 29 6.5. Сложные эфиры. 30 6.5.2. Сложноэфирная конденсация. 32 6.5.3. Восстановление. 33 6.6.1. Кислотно-основные свойства. 34 6.6.2. Реакции ацилирования. 34 6.6.3. Расщепление азотистой кислотой. 35 6.6.4. Дегидратация. 36 6.6.5. Восстановление. 36 6.6.6. Ацилирование амидов. 37 6.6.7. Алкилирование. 38 6.6.8. Галогенирование. 38 6.7.2. Восстановление. 40 6.8. Взаимные превращения производных карбоновых кислот. 40 7. Медико-биологическое значение карбоновых кислот и их производных. 41 8. Эталонное решение тестовых задач. 44 9. Задачи для самостоятельного решения. 50 II. Гидроксикислоты. 52 1. Общая характеристика. 52 1.1. Некоторые биогенные гидроксикарбоновые кислоты.. 53 2. Способы получения. 58 2.1. Гидролиз галогенозамещённых карбоновых кислот. 58 2.2. Омыление гидроксинитрилов. 58 2.3. Реакция Реформаторского. 59 2.4. Гидратация непредельных карбоновых кислот. 59 2.5. Окисление гидроксиальдегидов и гликалей. 60 3. Физические и химические свойства. 61 3.1. Восстановление α-гидроксикислот. 62 3.2. Нагревание α-гидроксикислот. 62 3.3. Реакция дегидротации α-, β- и γ-гидроксикислот. 62 3.3.1. Образование лактидов. 62 3.3.2. Образование непредельных кислот. 63 3.3.3. Образование лактонов. 63 4. Отдельные представители. 64 III. Оксокислоты. 67 1. Общая характеристика. 67 1.1. Некоторые биогенные оксокарбоновые кислоты.. 67 и их биологическая роль. 67 2. Способы получения. 69 2.1. Гидролиз дигалогенозамещённых кислот. 69 2.2. Гидролиз α-оксонитрилов. 69 2.3. Сложноэфирная конденсация. 69 2.4 Дегидратация и декарбонилирование лимонной кислоты.. 70 2.5 Синтез γ-оксокислот из янтарного ангидрида. 70 3. Химические свойства. 71 3.1. Образование гидратных форм. 72 3.2. Декарбоксилирование и декарбонилирование α-оксо-кислот. 72 3.3.Кето-енольная таутомерия, β-оксокислот и их сложных эфиров.. 72 3.3.1. Химические свойства таутомерных форм. 75 3.3.2. Кетонное и кислотное расщепление. 76 3.3.3. Декарбоксилирование. 77 3.4. γ- и δ-Оксокислоты.. 78 4.Биологическое окисление гидрокси — и оксокарбоновых кислот. 78 Молочная кислотаМолочная кислота СН3СНОНСООН образуется в результате анаэробного превращения углеводов молочнокислыми бактериями. Молочная кислота представляет собой органическую одноосновную оксикислоту. Гидроксильная группа этой кислоты может находиться в двух (а и B) положениях углеродной цепи. Поэтому различают два вида молочной кислоты: а-оксипропионовая СН3СНОНСООН и B-оксипропионовая СН2ОНСН2СООН. Промышленное значение имеет а-оксипропионовая кислота, продуцируемая в процессе молочнокислого брожения. Молочная кислота находит широкое применение в химической, пищевой, фармацевтической промышленности. В СССР в промышленных условиях пищевую молочную кислоту получают методом глубинного культивирования с помощью бактерий Bacterium delbruckii (синоним Lactobacillus delbruckii), которые относятся к гомоферментативным термофильным бактериям с оптимумом развития 48-50 °С. Производственная ценность этих микроорганизмов заключается еще в том, что температурный максимум для их развития находится в интервале 54-56°С, а интенсивное кислотообразование обеспечивается при относительно высокой температуре — 50 °С. Такая температура создает элективные условия. Большинство микроорганизмов при этом не развиваются, так как указанные температуры находятся далеко за пределами оптимума и максимума для их развития. Производство молочной кислоты включает следующие основные технологические стадии: молочнокислое брожение, обработка сброженного раствора и фильтрование, расщепление лактата кальция, упаривание молочной кислоты. Образование молочной кислоты из глюкозы при сбраживании гомоферментативными молочнокислыми бактериями происходит согласно уравнению Суммарное уравнение превращения глюкозы в молочную кислоту с помощью ферментной системы молочнокислых бактерий можно представить в таком виде: Расщепление глюкозы происходит по ФДФ-пути, бактерии имеет для этого все необходимые ферменты, включая альдолазу. Водород, отщепляющийся при дегидрировании триозофосфата, передается к пирувату. Схема биосинтеза молочной кислоты представлена ниже. Другой вариант схемы молочнокислого брожения включает распад глюкозы до пировиноградной кислоты и восстановление пировиноградной кислоты до молочной Молочная кислота — нестойкое химическое соединение, и в зависимости от условий производства и хранения она легко образует продукты дегидратации, называемые ангидридами молочной кислоты. Кристаллы молочной кислоты при атмосферном давлении быстро плавятся с образованием бесцветной сиропообразной жидкости удельного веса 1,21 без запаха с резко кислым вкусом. Молочнокислое брожениеДля производства молочной кислоты используют самые различные углеводы. В промышленности кислоту обычно получают из таких видов сырья, в которых содержатся глюкоза, сахароза и мальтоза. Таким сырьем может служить рафинадная патока, меласса, крахмал (кукурузный, картофельный), предварительно осахаренный солодом. Концентрация сахара в сбраживаемой среде в зависимости от вида сырья и условий брожения может колебаться от 5 до 18%. Для сбраживания сульфитных щелоков можно использовать молочнокислые бактерии вида L. plantarum. Они сбраживают гидролизаты, содержащие пентозы (ксилозу, арабинозу) с примерно одинаковым выходом уксусной и молочной кислот. Разделение этих образовавшихся кислот осуществляют способом отгонки из сброженных растворов. В промышленных условиях молочную кислоту получают глубинным способом с помощью культуры L. delbruckii. В качестве основного сырья используют мелассу, сахарозу, гидролизаты крахмала. Концентрация сахара в среде составляет 5-20%, pH 6,3-6,5. Во время ферментации pH среды поддерживают при помощи мела, который добавляют 3-4 раза в сутки. Молочнокислое брожение проводят при строго постоянной температуре 50 °С. Снижение температуры до 46-48 °С вызывает резкое ослабление биохимической активности культуры и способствует развитию посторонней микрофлоры. Повышение температуры, например до 53-55 °С, также вызывает инактивацию культуры и замедление брожения. Положительное влияние на молочнокислое брожение оказывают биологически активные вещества. С этой целью к питательной среде добавляют вытяжку из солодовых ростков. При нормальном брожении за сутки бактериями сбраживается 1-1,5% сахара, и весь цикл брожения заканчивается за 7-11 сут. При этом количество несброженного сахара составляет 0,5-0,7%, а концентрация лактата кальция — 10-15%. Обработка сброженного раствора и фильтрованиеДля отделения мела и коллоидов сброженный раствор нагревают до 80-90 °С, а затем обрабатывают гашеной известью до слабощелочной реакции и отстаивают в течение 3-5 ч. Для удаления грубой взвеси и твердых частиц декантируют отстоявшийся слой раствора лактата кальция. Раствор насосом перекачивают на фильтр-пресс. Фильтрацию проводят при температуре раствора лактата кальция 70-80°С через предварительно прогретый фильтр-пресс. Полученный фильтрат упаривают до концентрации 27-30 %, затем охлаждают до температуры 25-30 °С и выдерживают 36-48 ч в кристаллизаторе. Кристаллизация считается законченной, если в маточном: растворе остается не более 5-6% растворенного лактата кальция. Расщепление лактата кальцияПромытый холодной водой лактат кальция отделяют на центрифуге и расплавляют. С целью предохранения лактата от обугливания расщепление лактата кальция серной кислотой с выделением свободной молочной кислоты проводят при 60-70 °С. Эта реакция проходит в соответствии с уравнением Для отделения ионов железа полученную сырую молочную кислоту при температуре 65 °С обрабатывают желтой кровяной солью. В осадок выпадает берлинская лазурь. Тяжелые металлы и мышьяк осаждают сульфатом натрия и сернистым барием. С целью освобождения молочной кислоты от красящих веществ используют активный уголь. После обработки полученную смесь фильтруют, а осадок гипса промывают для извлечения оставшейся молочной кислоты. Упаривание молочной кислотыПосле расщепления кристаллического лактата кальция и последующей обработки получают сырую молочную кислоту 18-20%-ной концентрации, которую для достижения 40%-ной концентрации упаривают. Упаривание кислоты производят в вакуум-аппаратах при остаточном давлении 10-15 кПа и давлении пара 0,2 МПа. Упаренную до 40% молочную кислоту осветляют активным углем и обрабатывают желтой кровяной солью. После осветления молочной кислоты активный уголь отделяют на фильтр-прессе. Отфильтрованную 40%-ную молочную кислоту сливают в сборник готовой продукции, а из него подают на фасовку. Для получения 70%-ной кислоты 40%-ную молочную кислоту вторично упаривают при большом разрежении в вакуум-аппаратах. 70%-ную молочную кислоту сливают в емкость, а затем подают на фильтр-пресс для окончательного фильтрования. Отфильтрованную кислоту сливают в сборник, откуда подают на розлив или на приготовление 70%-ной пастообразной кислоты, которую получают внесением в нее небольших количеств мела (4% к массе кислоты). При этом происходит частичное замещение ионов Н+ молочной кислоты ионом Са2+ и около 10% кислоты превращается в кристаллический лактат, который связывает молочную кислоту. источники: http://pandia.ru/text/78/277/100066-4.php http://www.spec-kniga.ru/tehnohimicheski-kontrol/obshchaya-tekhnologiya-mikrobiologicheskih-proizvodstv/organicheskie-kisloty-molochnaya-kislota.html |















 оксобутандиовая
оксобутандиовая 2-оксопентандиовая
2-оксопентандиовая


























 Схема превращений в цикле Кребса.
Схема превращений в цикле Кребса.