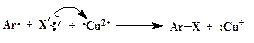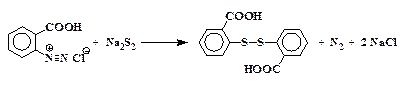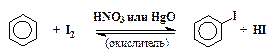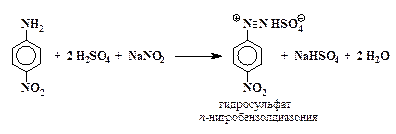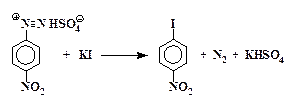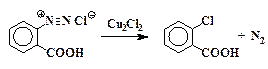Диазо- и азосоединения. Упражнения
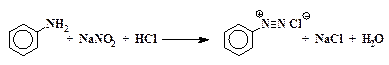
1.Какую реакцию называют диазотированием? Напишите уравнение реакции диазотирования п-толуидина нитритом натрия в разбавленной соляной кислоте на холоде. Приведите механизм этой реакции и ответьте на следующие вопросы: а) почему п-толуидин диазотируется быстрее, чем анилин; б) почему реакция ведется при 0–5 0 С; в) почему на 1 моль амина берется
2,5 моль HCl; г) какое соединение образуется, если диазотирование вести при недостатке кислоты; д) почему в 0,5 М HCl скорость диазотирования больше, чем в 0,05 М; е) как по иодкрахмальной бумаге определяют окончание диазотирования (приведите уравнение реакции, протекающей при таком определении)?
2.Какие указанные ниже условия наиболее приемлемы для диазотирования 2,4-диметиланилина и 2,4-динитроанилина: а) NaNO2, HCl (разб.), 0 0 С; б) NaNO2, H2SO4 (конц.), 20 0 С? Почему сульфаниловую кислоту для диазотирования вначале растворяют в растворе соды (или щелочи), затем смешивают с раствором нитрита натрия и полученный раствор приливают к холодной разбавленной соляной кислоте? Почему в этом случае необходим такой порядок смешения реактантов (как он называется)? Приведите схемы реакций.
3.Укажите, какие из приведенных аминов могут дать соли диазония, достаточно устойчивые в холодном водном растворе: п-анизидин, N-этиланилин, бензиламин, N,N-диметиланилин, м-нитроанилин. В каких случаях и почему получение солей диазония невозможно? Приведите схемы протекающих реакций.
4.Сопоставьте строение бензолдиазоний хлорида со строением циклогександиазоний хлорида и объясните причину относительной устойчивости первой соли в водных растворах на холоде и быстрое разложение с выделением азота второй в этих же условиях. Опишите строение бензолдиазоний-катиона методом резонанса.
5.Объясните результаты следующих превращений:
6.Рассмотрите влияние рН раствора на строение диазосоединений. На примере бензолдиазонийхлорида покажите, какие превращения имеют место при постепенном переходе от кислой среды к щелочной. Назовите все формы дизосоединений.
7.Напишите схему реакции, которая протекает при нагревании кислого водного раствора гидросульфата бензолдиазония. Рассмотрите механизм этой реакции. Какие экспериментальные данные послужили основой для постулирования данного механизма? Какое еще соединение образуется, если эту реакцию проводить в присутствии бромида калия? Зависит ли его выход от концентрации KBr? Будет ли изменяться скорость разложения соли бензолдиазония (определяется по скорости образования N2) с увеличением концентрации KBr? * Изменится ли ситуация, если вместо соли бензолдиазония использовать соль п-нитробензолдиазония?
8.Назовите соединения, образующиеся при нагревании водного раствора о-метилбензолдиазоний хлорида в присутствии следующих соединений: а) СН3ОН (Н + ); б)* KI; в)* СuCl (HCl); г) CuCN; д)* C2H5OH (CH3COONa). Для реакций, отмеченных звездочкой, приведите механизм.
9.На примере п-бромбензолдиазоний хлорида покажите, как можно осуществить замену диазониевой группы на следующие атомы или группы: а) Br; б) F; в) NO2. Приведите схемы реакций, укажите условия их проведения, назовите образующиеся соединения.
10.Дополните схемы превращений:
11.Используя реакцию диазотирования, составьте схемы синтеза из бензола или толуола следующих соединений: а) п-фторанилина, б) о-дибромбензола, в) о-динитробензола, г) м-хлоранилина, д) п-бромбензойной кислоты, е) м-фторфенола, ж) 3,5-дибромнитробензола, з) 4,4’-дигидроксибифенила, и) м-нитротолуола, к) м-бромтолуола, л) 3,5-дибромтолуола, м) 1,3,5-трибромбензола, н) 1,2,3-трибромбензола, о) трех изомеров метилфенола (крезолов), п) трех изомеров толуиловой кислоты СН3С6Н4СООН.
12.Предложите метод получения 4-метоксибифенила с помощью реакции Гомберга-Бахмана.
13.Как, используя реакцию Меервейна, осуществить следующие превращения: а) бутадиен-1,3 ® 1‑п‑нитрофенилбутадиен-1,3; б) акриловая кислота ® транс-п-хлоркоричная кислота; в) п-бензохинон ® 2‑фенил-1,4-бензохинон.
14.Из каких азо- и диазосоставляющих можно синтезировать указанные азокрасители? Как называется эта реакция? Рассмотрите ее механизм и укажите интервал значений pH, в котором следует осуществлять предложенные Вами процессы.
15.Вещество С12H9BrN2O ярко-желтого цвета растворяется в щелочах, а при восстановлении SnCl2 / HCl (H2O) превращается в п-броманилин и п-аминофенол. Каково его строение? Предложите метод синтеза из бензола.
16.Предложите метод получения диазометана, исходя из: а) мочевины; б) п-толуолсульфохлорида; в) этил N-метилуретана; г) диметилтерефталата; д) гидразина. Каково строение диазометана? Как он реагирует со следующими веществами: е) фенол, BF3 . Et2O; ж) циклогексанон, AlBr3 / Et2O; з) бензил; и) фенилуксусная кислота; к) хлорангидрид фенилуксусной кислоты (0,5 моль), затем кипячение в бензиловом спирте; л) толан.
Реакции солей диазония с выделением азота
Соли диазония неустойчивы и способны распадаться гетеролитически в растворителях с высокой диэлектрической проницаемостью:
Ar — N + ºN X — 
или гомолитически (как правило, под действием катализаторов):
Ar — N + ºN X — 
Направление распада зависит от аниона соли диазония и растворителя. Гомолизу способствуют в основном анионы слабых кислот, но в неводных растворах таким образом распадаются даже хлориды. Растворители с высокой диэлектрической проницаемостью способствуют гетеролитическому распаду (общая закономерность).
Диазосоединения широко используются для замены диазогруппы в аренах на различные функциональные группы. Иногда это единственный метод получения нужного продукта.
Ниже приведены наиболее часто применяемые в лаборатории синтезы с применением диазосоединений. Около каждой реакции указывается, если это достоверно известно, по какому механизму она протекает: ГТЛ (гетеролитически) или ГМЛ (гомолитически).
Замещение диазониевой группы гидроксилом:
Ar-N + ºN + H2O 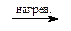 Ar-OH + N2 + H + Ar-OH + N2 + H + | (ГТЛ) |
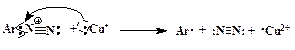
2. Замещение диазогруппы на Cl, Br, CN и CNS (реакция Зандмейера). Осуществляется путем разложения соли диазония в присутствии соответствующих координационных соединений меди(I) ([CuCl4] 3 — , [CuBr4] 3 — , [Cu(CN)4] — , [Cu(CNS)4] 3 — ):
Ar-N + ºN + X — 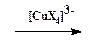 Ar-X + N2 Ar-X + N2 | (ГМЛ) |
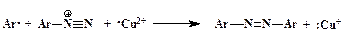
Доказано, что этот процесс идет через промежуточное образование арильного радикала. Поставщиком электрона, необходимого для гомолитического разрыва связи С-N, является ион меди в степени окисления +1 (схематично):
Далее ион Cu 2+ вновь превращается в Сu + , забирая электрон у галогена, и радикал Х· образует ковалентную химическую связь с Ar·:
Таким образом, медь в реакции Зандмейера служит переносчиком электрона.
Образованием в промежуточной стадии арильных радикалов объясняется прохождение ряда побочных процессов при реакциях Зандмейера:
а) Образование диарилов:
Ar. + Ar. 
б) Образование производных азобензола:
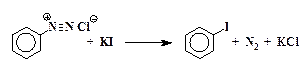
3. Замещение диазогруппы на иод непосредственно действием йодистого калия на водный раствор соли диазония без катализатора:
Ar-N + ºN + I — 
В случае реакции с йодид-анионом катализатор не нужен, т.к. роль переносчика электрона способен выполнить сам иодид-ион.
4. Разложение сухого тетрафторбората диазония с образованием фторзамещенных:
[Ar-N + ºN] [BF4] —  Ar-F + BF3 + N2 Ar-F + BF3 + N2 | (ГТЛ) |
5. В ряде случаев диазогруппа может быть замещена на сульфохлоридную группу и нитрогруппу:
Ar-N + ºN Cl — + SO2 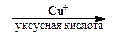
Ar-N + ºN SO4H — + NaNO2 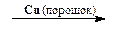
6. Взаимодействие диазониев с полисульфидами щелочных металлов:
Запрещается применять эту реакцию к диазониям, не содержащим групп, сообщающих растворимость в щелочной среде (-ОН, -СООН, -SО3Н), так как в этом случае наблюдаются сильные взрывы.
Если при диазотировании ароматических аминов образуется нерастворимая в воде соль диазония (например, при диазотировании сульфаниловой кислоты), ее необходимо перерабатывать только во влажном виде из-за чрезвычайной взрывчатости высушенных диазосоединений. Воронку и фильтр, на которых производилось отсасывание диазония, следует немедленно обмыть водой.
Йодбензол
Диазотирование анилина. В стакане емкостью 100 мл смешивают 8,3 мл 38,3 % соляной кислоты с 10 мл воды и к раствору прибавляют 3,1 г свежеперегнанного анилина. Раствор охлаждают в бане со льдом до 1 – 2 °С и из капельной воронки при непрерывном перемешивании постепенно прибавляют раствор 2,3 г нитрита натрия в 6,5 мл воды. Температура реакционной смеси не должна превышать 5 °С. Для этого в реакционную смесь бросают кусочки льда. Окончание реакции диазотирования контролируют по йодкрахмальной бумажке. Избыток азотистой кислоты разрушают добавлением нескольких крупинок карбамида (мочевины) до прекращения выделения пузырьков газа.
Замещение диазогруппы на йод.Полученный раствор соли диазония медленно при перемешивании приливают к предварительно охлажденному в ледяной воде раствору 6,7 г иодида калия в 10 мл воды, находящемуся в колбе емкостью 500 мл. Смесь оставляют на 2 часа при комнатной температуре. Затем к колбе присоединяют воздушный холодильник и нагревают на кипящей водяной бане до прекращения выделения азота. Раствор охлаждают и приливают к нему концентрированный (30 %) раствор NаОН до сильнощелочной реакции. Отгоняют йодбензол с водяным паром. Перегонку ведут до прекращения выделения маслянистых капель йодбензола.
Йодбензол отделяют от воды с помощью делительной воронки и обезвоживают прокаленным хлористым кальцием. Перегоняют из маленькой колбы, собирая фракцию, кипящую при 185 – 189 °С. Выход 90 %. Ткип 188 °С, показатель преломления йодбензола nD 20 = 1,6213.
Таким же способом можно получить из орто-толуидина орто-йодтолуол (Ткип 204 °С, nD 20 = 1,609).
Пояснения к синтезу
Из-за низкой активности йода и обратимости процесса прямое йодирование бензола проходит медленно и дает низкий выход иодбензола:
Окислитель выводит йодистый водород из сферы реакции и тем самым сдвигает равновесие вправо. Способ синтеза йодбензола с использованием соли диазония намного более удобен.
Необходимое для работы количество анилина следует перегнать непосредственно перед диазотированием на установке для микроперегонки (рис. 21, стр. 102). Для этого нужно взять 4 мл неочищенного анилина, а в перегонную колбочку вместе с анилином поместить небольшое количество цинковой пыли.
Разложение соли фенилдиазония в водном растворе йодистого калия проводят при очень медленном повышении температуры для того, чтобы замедлить побочную реакцию соли диазония с водой. Образующийся в качестве побочного продукта фенол связывают в неперегоняющийся фенолят натрия путем добавления в реакционную смесь щелочи:
Йодбензол и о-йодтолуол представляют собой очень тяжелые по сравнению с водой (плотность йодбензола 1,835) бесцветные жидкости с высокими показателями преломления. Это – характерные свойства галоген- и особенно йодпроизводных.
Контрольные вопросы по работе см. на стр. 147.
2.4.3. п-Йоднитробензол
Диазотирование п-нитроанилина. В конической колбе при нагревании растворяют 2,5 г п-нитроанилина в смеси 3 мл концентрированной серной кислоты с 30 мл воды. Смесь быстро охлаждают до
5 – 10° С и к ней постепенно при постоянном перемешивании в течение 30 мин прибавляют раствор 1,5 г нитрита натрия в 7,5 мл воды. Температура реакционной массы при этом не должна превышать 10 °С. Конец реакции диазотирования определяют пробой с иодокрахмальной бумажкой.
Холодную реакционную смесь фильтруют через складчатый фильтр. К фильтрату прибавляют небольшое количество карбамида (мочевины) до прекращения выделения пузырьков газа. Добавка карбамида требуется для разложения некоторого избытка азотистой кислоты. Фильтрату не дают при этом нагреваться выше 10 °С.
Разложение соли диазония. Холодный фильтрат, представляющий собой раствор гидросульфата п-нитробензолдиазония, постепенно при размешивании прибавляют к охлажденному раствору 5 г йодистого калия в 30 мл воды, находящемуся в стакане или конической колбе емкостью не менее 500 мл. Происходит бурное выделение азота, смесь при этом сильно пенится. Выпавший осадок отфильтровывают на воронке Бюхнера, промывают водой и высушивают. Выход 90 %.
Берут 1/5 часть сухого осадка (по весу) и перекристаллизовывают ено из спирта. Определяют температуру плавления перекристаллизованного продукта. Тпл 174° С. Рассчитывают выход неочищенного продукта и долю потерь при его перекристаллизации (в %).
Пояснения к синтезу
При низкой температуре растворимость и скорость растворения п-нитроанилина в 15 % серной кислоте мала, поэтому растворение проводят при нагревании. Затем раствор резко охлаждают, и в осадок выпадает мелкокристаллическая соль амина. В растворе при этом находится равновесная смесь свободного амина и его соли. Диазотированию подвергается только свободный амин, реагирующий относительно быстро. По мере расходования амина его содержание пополняется за счет разложения растворенной соли. Таким образом, скорость суммарного процесса диазотирования определяется скоростью растворения гидросульфата п-нитроанилиния. А она тем выше, чем меньше размеры кристаллов. Тем не менее, раствор нитрита к реакционной смеси следует добавлять медленно (7,5 мл за 30 мин).
Гидросульфат п-нитробензолдиазония, как и большинство других солей диазония, хорошо растворим в воде и разбавленных растворах кислот. Поэтому при правильном проведении процесса реакционная смесь к окончанию диазотирования будет однородным раствором желтоватого цвета. Если смесь в конце реакции представляет собой не раствор, а суспензию, это означает, что нитрит добавляли слишком быстро. Часть п-нитроанилина, не успев продиазотироваться, выпала в осадок из-за разбавления кислоты водой, добавленной вместе с нитритом. (С уменьшением концентрации кислоты растворимость амина падает). В этом случае раствор соли диазония нужно быстро отфильтровать, а лишь затем разлагать в присутствии иодистого калия. Избыток азотистой кислоты в растворе следует убрать, добавив к нему небольшое количество мочевины до прекращения выделения пузырьков газа. Иначе азотистая кислота окислит йодистый калий с выделением свободного йода, что приведет к загрязнению продукта.
Следует соблюдать осторожность при разложении соли n-нитрофенилдиазония в присутствии йодистого калия. Раствор КI перед прибавлением к нему соли диазония обязательно должен быть охлажден в ледяной воде.
Контрольные вопросы по работе см. на стр. 147.
О-Хлорбензойная кислота
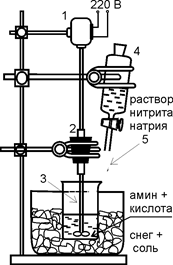 Рис. 24. Схема установки для проведения реакции диазотирования: 1 – электродвигатель, 2 – резиновая пробка с направляющей стеклянной трубкой, 3 – мешалка, 4 – капельная воронка, 5 – резиновая трубка Рис. 24. Схема установки для проведения реакции диазотирования: 1 – электродвигатель, 2 – резиновая пробка с направляющей стеклянной трубкой, 3 – мешалка, 4 – капельная воронка, 5 – резиновая трубка | Приготовление однохлористой меди. В колбе емкостью 250 мл растворяют при нагревании 4,5 г хлорида натрия и 12,5 г пятиводного сульфата меди (CuSO4·5H2O) в 40 мл воды. К смеси медленно при перемешивании добавляют 3,15 г безводного сульфита натрия (или 6,3 г семиводного сульфита натрия Na2SO3·7H2O) в 10 мл воды. Реакционную смесь охлаждают до комнатной температуры. Выпавший осадок белого цвета промывают методом декантации, т.е. сливанием прозрачной жидкости через край. Однохлористая медь чувствительна к действию кислорода воздуха, поэтому ее хранят под слоем воды в закрытой колбе. Диазотирование антраниловой кислоты. В стакане (рис. 24) емкостью 250 – 300 мл, снабженном мешалкой и капельной воронкой, конец трубки которой помещен ниже уровня жидкости, готовят смесь 6,9 г антраниловой кислоты, 20 мл воды, 14 мл концентрированной соляной кислоты |
и 10 г льда. В баню помещают охлажденную смесь размельченного льда или снега с поваренной солью, взятых в приблизительном весовом соотношении 10:1.
При интенсивном перемешивании в стакан постепенно прибавляют из капельной воронки охлажденный в ледяной воде раствор
4 г нитрита натрия в 20 мл воды. В реакционный сосуд желательно поместить 10 г измельченного льда непосредственно перед прибавлением нитрита, которое должно занимать не менее 15 минут. При соблюдении этих условий температура реакционной смеси не превышает 5 °С. По прошествии не менее 5 мин после окончания прибавления нитрита, следует сделать пробу на присутствие в реакционной массе азотистой кислоты, т.е. на конец диазотирования по йодкрахмальной бумажке
Замещение диазогруппы на хлор. Приготовленную ранее однохлористую медь растворяют в 20 мл концентрированной соляной кислоты. Получается около 25 мл раствора, который используют как катализатор разложения соли диазония. Раствор катализатора переносят в стакан емкостью 300 мл и охлаждают в бане с ледяной водой.
Холодный раствор соли диазония очень медленно при размешивании приливают к охлажденному раствору хлорида меди(I). При этом происходит бурное выделение азота. Выпавший осадок о-хлорбензойной кислоты отфильтровывают на воронке Бюхнера и промывают холодной водой. Для очистки продукт растворяют в разбавленном растворе соды (14 г Na2CO3·10H2O в 100 мл Н2О). При необходимости полученный раствор натриевой соли обесцвечивают с помощью активированного угля и фильтруют. Добавляют 10 % раствор соляной кислоты до кислой реакции по индикаторной бумажке (рН
Лабораторная работа № 6. Синтезы с использованием реакций диазотирования и азосочетания
Лабораторная работа № 6.
СИНТЕЗЫ С ИСПОЛЬЗОВАНИЕМ РЕАКЦИЙ
ДИАЗОТИРОВАНИЯ И АЗОСОЧЕТАНИЯ
1. Общая характеристика реакций диазотирования
Диазотированием называют реакции взаимодействия первичных ароматических аминов с азотистой кислотой, в результате которых образуются соли диазония.
Уравнение реакции диазотирования в общем виде может быть записано следующим образом:
При взаимодействии первичных алифатических аминов с азотистой кислотой образующаяся соль диазония неустойчива и тут же разлагается с выделением азота и образованием спирта:
Несмотря на то, что стабильность ароматического диазокатиона выше, чем алифатического (см. объяснение в [1, с.345-346]), тем не менее, при температуре выше 5оС он медленно разлагается водой:
Поэтому в синтезах с использованием солей диазония всегда применяют их свежеприготовленные растворы.
Механизм реакции диазотирования подробно рассмотрен в [1. с. 342–344].
При диазотировании возможен ряд побочных реакций. Соль диазония образуется только при избытке минеральной кислоты (рН 1–2), т. к. при недостатке ее (рН 5–7) образовавшаяся соль диазония взаимодействует с амином, образуя не растворимый в воде диазоаминобензол:
Для предотвращения этой реакции следует поддерживать избыток минеральной кислоты.
Диазотирование почти всегда проводят в водной среде, поэтому возможна еще одна побочная реакция – гидролиз соли диазония с образованием фенола:
Эту реакцию можно свести к минимуму, тщательно соблюдая температурный режим диазотирования (0–5оС).
Повышение температуры способствует протеканию и реакции разложения азотистой кислоты:
Из-за неустойчивости азотистой кислоты, эту реакцию не удается предотвратить даже при низкой температуре, поэтому натрий–нитрита всегда берут на 10–20% больше.
2. Реакции азосочетания
Взаимодействия солей диазония с ароматическими аминами или фенолами, в результате которых получаются азосоединения, называют реакциями азосочетания. Азосоединения окрашены и широко используются на практике как красители. При получении азокрасителей субстрат (амин или фенол) называют азосоставляющей, а реагент (соль диазония) — диазосоставляющей. Реакция азосочетания относится к реакциям электрофильного замещения (SE) в ароматическом ядре и может быть представлена следующими уравнениями:
Катион диазония – слабый электрофил вследствие делокализации (+)-заряда по ароматическому ядру (объяснение см. в [1], с.353-356). Поэтому он способен реагировать только с наиболее активными ароматическими нуклеофилами, а это такие, которые содержат сильные электронодонорные заместители, т. е. фенолы и ароматические амины. Электрофильность диазоний-катиона существенно повышается, если в орто — или пара-положении к диазогруппе находится электроноакцепторная группа (например, 2,4-динитрофенилдиазоний уже сочетается с эфиром фенола).
Из-за малой активности и больших размеров катион диазония атакует в азосоставляющей преимущественно пара-положение к активирующей гидрокси — или аминогруппе. И только когда пара-положение занято, реакция азосочетания протекает по орто-положению субстрата.
Реакцию азосочетания всегда проводят при определенном рН, от величины которого зависит активность азосоставляющей. Диазокатион устойчив в кислой среде, в щелочной же среде сам он превращается в нуклеофил, не способный сочетаться с фенолами и аминами:
сочетается не сочетается не сочетается
Если азосоединение – амин, то в сильнокислой среде большая его часть будет находиться в виде соли, которая является электрофилом и не будет сочетаться с катионом диазония:
сочетается не сочетается
Поэтому сочетание с аминами проводят всегда в слабокислой среде (рН 5–7), при котором концентрации и амина, и диазоний-катиона будут высокими.
Для сочетания с фенолами предпочтительна щелочная среда. В этом случае активируется фенол с образованием фенолят-иона, который является более сильным нуклеофилом и гораздо более активной азосоставляющей, чем сам фенол:
сочетается медленно сочетается быстро
Но в сильнощелочной среде теряется электрофильность диазокатиона, который медленно превращается в диазотат-анион, не способный к сочетанию. Поэтому азосочетание с фенолами проводят в слабощелочной среде (рН 8–9), в которой концентрация диазокатиона еще достаточна для реакции.
7.3. Контрольные теоретические вопросы к беседе по синтезу
Синтезы с использованием солей диазония обычно двухстадийны. На первой стадии получают соль диазония, которую не выделяют из раствора, а тут же используют для синтеза целевого продукта.
Вопросы по 1-ой стадии – получение соли диазония
1. Почему в синтезах с использованием солей диазония всегда применяют их свежеприготовленные растворы?
2. Какую реакцию называют реакцией диазотирования? Какие амины способны вступать в нее и почему?
3. В какой форме – основания или соли – амин способен диазотироваться? Объясните образование этой формы в условиях реакции диазотирования.
4. Поясните роль кислоты в реакции диазотирования. Сколько моль кислоты в синтезе берут на 1 моль амина? Какая побочная реакция протекает при недостатке кислоты?
5. При какой температуре и почему проводят диазотирование? Какие побочные продукты образуются при нарушении теплового режима?
Вопросы по 2-ой стадии – реакции азосочетания
6. Какие реакции называют реакциями азосочетания? Укажите диазо — и азосоставляющие в Вашем синтезе.
7. Какие соединения и почему могут выступать в качестве азосоставляющей? Укажите символ реакции азосочетания, выберите реагент и определите его природу.
8. В какой среде и почему осуществляется реакция азосочетания с: а) фенолами, б) ароматическими аминами?
Синтез № 10. Метиловый оранжевый (гелиантин)
Первая стадия – получение диазосоставляющей п-сульфофенил-диазоний-хлорида. В химическом стакане № 1 объемом 50 мл взвешивают 1 г сульфаниловой кислоты, сюда же приливают раствор 0,1 г гидроксида натрия в 2,5 мл воды и при легком нагревании и перемешивании добиваются полного растворения кислоты (раствор должен иметь рН > 7). В конической колбе на 50 мл готовят раствор 0,4 г нитрита натрия в 5 мл воды, который приливают к раствору соли сульфаниловой кислоты и охлаждают до 2–5оС.
В стакан №2 объемом 100 мл вносят 0,5 мл соляной кислоты (d420 1,34), охлаждают в ледяной бане и небольшими порциями при перемешивании приливают смесь сульфаниловой кислоты и нитрита натрия. Спустя несколько минут появляется белый осадок соли диазония.
Вторая стадия – получение метилоранжа реакцией азосочетания
Приготовление азосоставляющей. В химическом стакане № 3 объемом 50 мл растворяют 1 г N, N-диметиланилина в разбавленной соляной кислоте, которую готовят, смешивая 0,85 мл конц. HCl (d420 1,34) с 10 мл воды. Раствор перемешивают и охлаждают в ледяной бане.
Осуществление реакции азосочетания. К суспензии соли диазония (стакан № 2) быстро приливают раствор азосоставляющей (стакан № 3), тщательно перемешивают и добавляют раствор 0,4 г гидроксида натрия в 2,5 мл воды (стакан № 4). После перемешивания измеряют величину рН, которая должна быть не ниже 9 (если рН 7). В конической колбе на 25 мл готовят раствор 0,2 г нитрита натрия в 2,5 мл воды, который приливают к раствору соли сульфаниловой кислоты (стакан № 1) и охлаждают до 0–5оС.
В стакан № 2 объемом 100 мл вносят 0,5 мл соляной кислоты (d420 1,34), охлаждают в ледяной бане и небольшими порциями при перемешивании приливают смесь сульфаниловой кислоты и нитрита натрия из стакана № 1. Спустя несколько минут появляется белый осадок соли диазония.
Вторая стадия – получение в-нафтолоранжа реакцией азосочетания
Приготовление азосоставляющей. В химическом стакане № 3 объемом 50 мл смешивают 0,4 г NaOH с 5 мл воды, добавляют 0,4 г
в‑нафтола, тщательно перемешивают и охлаждают в ледяной бане.
Реакции азосочетания проводится на холоде. К суспензии соли диазония (стакан № 2) быстро приливают раствор азосоставляющей (стакан № 3) и тщательно перемешивают. После перемешивания измеряют величину рН, которая должна быть не ниже 9 (если рН
http://lektsii.org/3-139106.html
http://pandia.ru/text/80/506/75780.php