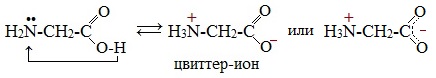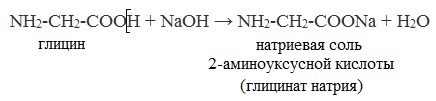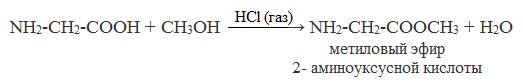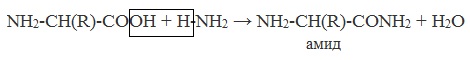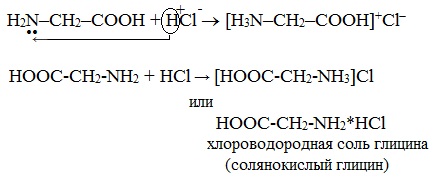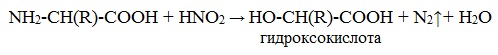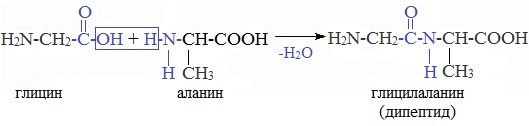Напишите уравнение реакции доказывающее амфотерный характер аминокислот
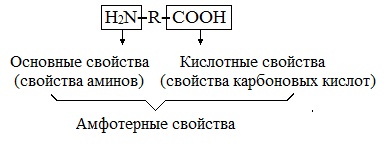
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
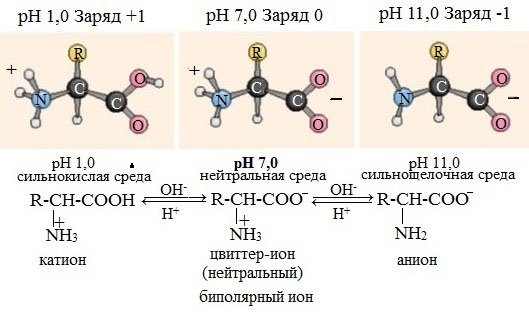
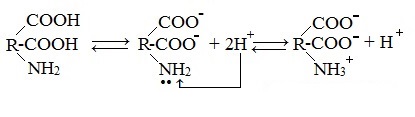
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
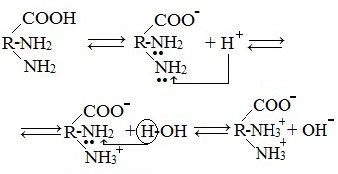
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
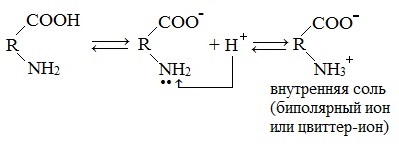
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
2. Взаимодействие с основаниями и кислотами
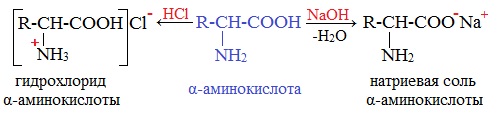
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
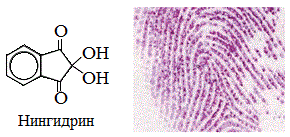
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
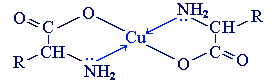
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Напишите уравнение реакций, доказывающие амфотерный характер аминокислот?
Химия | 10 — 11 классы
Напишите уравнение реакций, доказывающие амфотерный характер аминокислот?
Аминокислоты — это органические амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера : аминогруппу – NH₂с основными свойствами икарбоксильную группу – COOH, с кислотными свойствами.
Аминокислоты реагируют как с кислотами, так и с основаниями :
Н₂N — СН₂ — СООН + HCl→Сl[Н₃N — СН₂ — СООН]
Н₂N — СН₂ — СООН + NaOH → H₂N — CH₂ — COONa + Н₂О.
Напишите уравнения реакций, подтверждающих амфотерный характер β — аминовалериановой кислоты?
Напишите уравнения реакций, подтверждающих амфотерный характер β — аминовалериановой кислоты.
Напишите уравнения реакций, доказывающих амфотерный характер Cr(OH)3, Cr2O3?
Напишите уравнения реакций, доказывающих амфотерный характер Cr(OH)3, Cr2O3.
Напишите уравнения реакций солеобразования доказывающие характер оксида (кислотный, основный, амфотерный) SrO?
Напишите уравнения реакций солеобразования доказывающие характер оксида (кислотный, основный, амфотерный) SrO.
Напишите пожалуйста уравнения реакций, которые подтверждают амфотерный характер оксида цинка?
Напишите пожалуйста уравнения реакций, которые подтверждают амфотерный характер оксида цинка.
Напишите формулы высших оксидов и их гидроксидов для элементов с порядковыми номерами 4 ; 37 ; 75?
Напишите формулы высших оксидов и их гидроксидов для элементов с порядковыми номерами 4 ; 37 ; 75.
Напишите уравнение реакций, доказывающих амфотерный характер гидроксида бериллия.
Напишите уравнение реакций, доказывающих кислотный характер оксида серы(IV)?
Напишите уравнение реакций, доказывающих кислотный характер оксида серы(IV).
Составьте ионное уравнение.
! составьте молекулярные и ионно молекулярные уравнения реакций, которые доказывают амфотерный характер : гидроксида свинца (2) , гидроксида олова (4)?
! составьте молекулярные и ионно молекулярные уравнения реакций, которые доказывают амфотерный характер : гидроксида свинца (2) , гидроксида олова (4).
Напишите пожалуйста уравнения реакций, подтверждающие амфотерный характер оксида цинка?
Напишите пожалуйста уравнения реакций, подтверждающие амфотерный характер оксида цинка.
Уравнение реакции доказывающие характер оксида алюминия и кислорода?
Уравнение реакции доказывающие характер оксида алюминия и кислорода.
Напишите уравнение реакции доказывающие амфотерный характер аминоуксусной кислоты?
Напишите уравнение реакции доказывающие амфотерный характер аминоуксусной кислоты.
На этой странице находится вопрос Напишите уравнение реакций, доказывающие амфотерный характер аминокислот?, относящийся к категории Химия. По уровню сложности данный вопрос соответствует знаниям учащихся 10 — 11 классов. Здесь вы найдете правильный ответ, сможете обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С помощью автоматического поиска на этой же странице можно найти похожие вопросы и ответы на них в категории Химия. Если ответы вызывают сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
Напишите уравнение реакции доказывающее амфотерный характер аминокислот
Вопрос по химии:
Напишите уравнения химических реакций , подтверждающих , что аминокислоты являются амфотерными соединениями
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
1) Взаимодействуют с основаниями:
СH₂ — COOH + KOH —> CH₂ — COOK + H₂O
| |
NH₂ NH₂
2) Взаимодействуют с кислотами:
CH₂ — COOH + HCl —> CH₂ — COOH
| |
NH₂ NH₃⁺Cl⁻
3) Внутренняя нейтрализация:
CH₂ — COOH —> CH₂ — COO⁻ (внутренняя соль)
| |
NH₂ NH₃⁺
4) Взаимодействуют между собой:
СH₂-COOH + NH₂ — CH — COOH —> H₂O + NH₂ — CH₂ — C — N — CH — COOH
| | || | |
NH₂ CH₃ O H CH₃
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
http://himia.my-dict.ru/q/3639585_napisite-uravnenie-reakcij-dokazyvausie-amfoternyj-harakter/
http://online-otvet.ru/himia/5cea7e8196f4e19a2910bee0