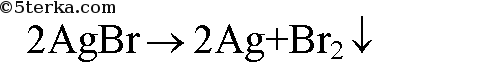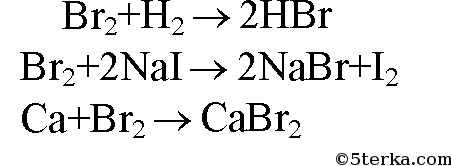Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e312edc59fa1600 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Трифторид алюминия
| Трифторид алюминия | |||
|---|---|---|---|
| |||
| Традиционные названия | трифторид алюминия, фторид алюминия, алюминия трифторид | ||
| Хим. формула | AlF3 | ||
| Состояние | белое твердое кристаллическое вещество без запаха | ||
| Молярная масса | (тригидрат) 138.023 г/моль | ||
| Плотность | 2,88 г/см³ | ||
| Температура | |||
| • плавления | 1291 °C | ||
| Мол. теплоёмк. | 75,10 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −1510 кДж/моль | ||
| Удельная теплота испарения | (возгонка) 272 Дж/кг | ||
| Растворимость | |||
| • в воде | (при 0 °C) 0.56 (при 100 °C) 1.72 г/100 мл | ||
| Кристаллическая структура | ромбоэдрическая | ||
| Рег. номер CAS | |||
| PubChem | 2124 | ||
| Рег. номер EINECS | 232-051-1 (ангидрид) | ||
| SMILES | |||
| RTECS | BD0725000 | ||
| ChEBI | 49464 | ||
| ChemSpider | 2039 | ||
| Предельная концентрация | 2 мг/м3 | ||
| ЛД50 | 100 мг/кг (крысы, орально) | ||
| Пиктограммы ECB |    | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Фторид алюминия — неорганическое бинарное соединение алюминия и фтора. Химическая формула AlF3.
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Токсичность
Физические свойства
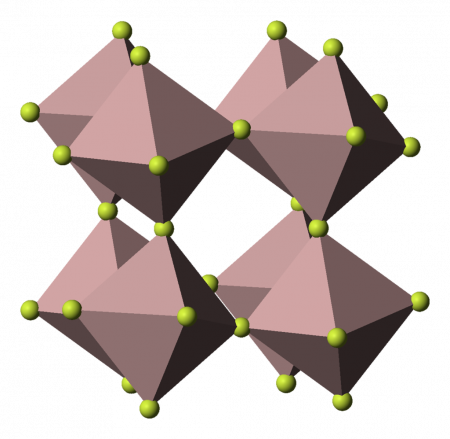
Фторид алюминия представляет собой бесцветное или белое кристаллическое вещество. При сильном нагревании возгоняется без разложения. При обычных условиях устойчива α-модификация с тригональной решеткой (а = 0,5039 нм, α = 58,50°, z = 2, пространственная группа R32), плотность 2,882 г/см³. При нагревании до
700 °C переходит в γ-модификацию с тетрагональной решеткой (а = 0,354 нм, с = 0,600 нм).
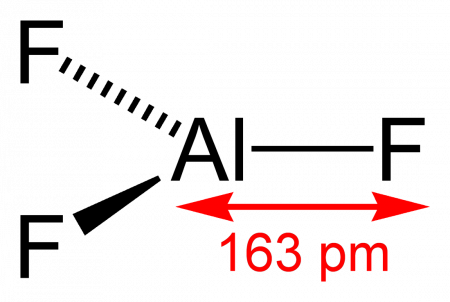
Длина связи Al—F составляет 0,163 нм. В газовой фазе, при температуре около 1000 °C, трифторид алюминия существует в виде молекул тригональной симметрии D3h.
Фторид алюминия плохо растворим в воде (0,41 % по массе при 25 °C), лучше — в растворах HF, не растворим в органических растворителях.
Получение
Взаимодействием Аl2O3 или Аl(ОН)3 с раствором HF с последующим выделением, сушкой и прокаливанием при 500-600 °C образовавшегося кристаллогидрата AlF3·3H2O:
Действием на Аl2O3 газообразного HF при 450-600 °C:
с последующем выделением, сушкой и прокаливанием гидрата.
При температуре в 700 °C гексафторсиликат натрия с алюминием дают на выходе чистый кремний, гексафторалюминат натрия и трифторид алюминия:
Самым легким путём получения трифторида алюминия является прямой контакт фтора с алюминием при температуре 600 °C:
2 Al + 3 F2 → 600oC 2 AlF3
Нагрев до температуры примерно 175 °C моногидрат трифторида алюминия получим воду и трифторид алюминия:
Для получения чистого безводного трифторида алюминия нужно гексафторалюминат аммония нагреть и получится трифторид алюминия с фторидом аммония:
В основном трифторид алюминия получают при обработке оксида алюминия гексафторсиликоновой кислотой, где на выходе получается оксид кремния IV, трифторид алюминия и вода:
Кроме того, он изготавливается путём термического разложения аммония гексафторалюмината.
Химические свойства
Образует кристаллогидраты с 1, 3 и 9 молекулами воды, которые легко разрушаются при нагревании:
При нагревании гидролизуется парами воды:
Медленно взаимодействует с концентрированной серной кислотой H2SO4:
Разлагается растворами и расплавами щелочей.
С фторидами щелочных металлов AlF3 образует фтороалюминаты, например, гексафтороалюминат натрия Na3[AlF6]:
Тема IX. Работа 2. Фтор. Бром. Иод. Вариант 3
Вопросы:
1. Почему на свету у бромида серебра появляется неприятный запах? Ответ подтвердите уравнением реакции.
2. Напишите уравнения реакций алюминия с иодом и фтором. Укажите степени окисления атомов, а также окислитель и восстановитель.
3. Через раствор, содержащий бромид калия и иодид калия, пропустили избыток хлора. После этого раствор выпарили, а осадок прокалили. Что представляет собой остаток после прокаливания? Напишите уравнения соответствующих реакций.
Решения и ответы:
1. При стоянии на свету происходит разложение:

задача №3
к главе «Тема IX. Галогены. Работа 2. Фтор. Бром. Иод».
http://chem.ru/triftorid-aljuminija.html
http://5terka.com/node/11355